miR-142-3p在结直肠癌组织与细胞中的表达及对细胞增殖影响研究*
朱文侠,杨 玲,成 钧,杨彦玲,韩振奎,韩继明,黄广智,王航辉
1.延安大学医学院 (延安716000), 2.西安交通大学附属红会医院 (西安 710054)
miR-142-3p在结直肠癌组织与细胞中的表达及对细胞增殖影响研究*
朱文侠1,杨 玲1,成 钧1,杨彦玲1,韩振奎1,韩继明1,黄广智1,王航辉2△
1.延安大学医学院 (延安716000), 2.西安交通大学附属红会医院 (西安 710054)
*陕西省教育厅科学研究计划项目(2013JK0754)
中国博士后科研项目(2016M600804)
陕西省博士后科研项目(2016BSHEDZZ92)
西安市卫生和计划生育委员会科研项目(J201602023)
西安市红会医院科研项目(YJ2014008)
西安市科技局科研项目[2017115FS/YX009(16)]
△通讯作者
目的:观察微小RNA-142-3p在结直肠癌组织与细胞中的表达,及其对人结直肠癌细胞增殖的影响。方法:通过组织原位杂交的方法,检测miR142-3p在结直肠癌患者组织中的表达。通过Realtime-PCR检测结直肠癌细胞系中的miR142-3p表达。构建pSliencer 4.1-CMV-miR142-3p过表达载体,并转染结直肠癌细胞Caco2,通过Realtime PCR检测重组质粒pSilencer4.1-CMV-miR142-3p载体在结直肠癌细胞系的表达情况。通过Western Blot检测细胞周期相关蛋白CyclinD1的表达变化。结果:miR142-3p主要定位于细胞的胞浆,在癌组织和癌旁组织中miR142-3p的表达存在差异。miR142-3p结直肠癌细胞系中呈低表达。在结直肠癌细胞系中过表达miR142-3p可下调细胞周期相关蛋白CyclinD1,抑制细胞增殖。结论:miR142-3p抑制结直肠癌Caco2细胞的增殖,下调细胞周期相关蛋白CyclinD1,有望成为结直肠癌诊断和治疗的潜在靶点。
结直肠癌(Colorectal cancer,CRC )是最常见的恶性肿瘤之一。其发病率在恶性肿瘤中居第3位,病死率居第4位,成为危害人类生命健康的重要疾病[1-6]。微小RNA (microRNAs,miRNAs)是一类长18~25个核苷酸的小分子非编码RNA,直接与靶基因mRNA 3'UTR结合,这可能进一步导致靶mRNA的降解或抑制蛋白质翻译,诱导mRNA降解或抑制其翻译,从而在转录后水平对靶基因进行调控,一个microRNA可以调节许多靶基因,同时被许多基因调控。通过抑制其转录后水平靶基因的表达,已经证明了miRNAs在调节各种细胞过程(如细胞代谢、增殖、分化和细胞凋亡等生物学过程)以及纤维化中起重要作用[7-10]。研究表明miR-142-3p与肿瘤的发生、发展有关。例如,微小RNA-142-3p在肾细胞癌中表达上调,与肾细胞癌细胞迁移,增殖和凋亡有关[11]。MicroRNA-142-3p调控Wnt信号通路并在乳腺癌的发病中扮有重要作用[12-13]。然而,miR-142-3p是否在结直肠癌的发病机制中起重要作用方面的研究较少,本文拟就该就此发病机制进行如下研究。
材料与方法
1 材料与仪器 细胞株购自中国科学院上海细胞生物学研究所,胎牛血清(Gibco BRL),DMEM培养基、RPMI-1640培养基(Hyclone),转染试剂lipo-2000(Invitrogen公司),SYBR Green试剂盒(大连Takara公司),原位杂交检测试剂盒(博士德公司),hsa-miR-142-3p地高辛探针(Exiqon,18043-15),超净工作台(苏州净化设备有限公司),定量PCR仪(ABI公司7500),紫外光密度分析仪(上海复日公司),分光光度计(Eppendof, Hamburg, Germany),电泳仪(Bio-Rad公司)。
2 细胞与细胞培养 细胞常规培养在DMEM、RPMI-1640培养基(含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素)或K-SFM培养基(含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素)中,于含5% CO2和95% O2混合气体的37 ℃培养箱里培养;根据细胞生长状况,每2~3天传代1次,以保持细胞处于对数生长期; 所有细胞在实验期间全部进行支原体检测,结果均为阴性;经台盼蓝染色分析细胞活力,活力均保持在90%以上。
3 组织原位杂交 组织原位杂交操作过程如下:石蜡切片60℃烤片过夜;二甲苯脱蜡至水;去离子水洗3遍;抗原修复。将片子于1%柠檬酸钠液(pH6.0)中微波热修复,取出后放置于100℃烤箱15min;去离子水洗3遍;3%过氧化氢室温孵育10 min,以消除内源性过氧化物酶的活性;去离子水洗3遍;胃蛋白酶消化8 min;去离子水洗3遍;梯度酒精脱水,室温晾干>20 min;加miR142-3p探针12.5nM/张,封口膜封片,42℃水浴过夜>10h;洗膜液(2XSSC+0.1%SDS,pH7.0)42℃洗3次,30 min /次;洗膜液(2XSSC+0.1%SDS,pH7.0)室温摇床洗3次,15 min /次;PBST(0.01%TWEEN20,pH7.4)室温摇床洗3次,5 min /次;封闭液室温封闭20 min;生物素化鼠抗地高辛37℃孵育1h;PBST(0.01%TWEEN20,pH7.4)室温摇床洗3次,5 min /次;SABC-POD室温孵育30 min;PBST(0.01%TWEEN20,pH7.4)室温摇床洗3次,5 min /次;DAB显色,显微镜下观察15~30s(DAB),充分水洗,终止反应;自来水冲洗,苏木素复染。经梯度酒精脱水,二甲苯透明,中性树胶封片。
4 实时逆转录PCR 按照SYBR Green试剂盒说明书 (大连Takara公司) 操作。反应体系见表1~2。每组设三个复孔,通过计算标准差来衡量实验误差。反应在专用的96孔板(MicroAmp optical 96-well)中进行,以Optical adhesive covers (Applied Biosystems)封口,在 ABI7500 FAST 仪器上设定两步法 PCR扩增程序,详细过程如下:Stage I:95 ℃ 30 sec,循环一次;Stage II: 95 ℃ 5 sec,60 ℃ 30 sec,循环 40 次;Stage III:95 ℃ 15 sec,60 ℃ 30 sec,95 ℃ 15 sec,循环 40 次。采用ABI 7500 fast仪器附带的软件分析数据,计算出荧光信号超过背景荧光强度所对应的阈值,即循环数Ct 值。计算目的基因与内参β-actin的CT值之差(ΔCt),以此来反映在等量cDNA起始反应的情况下目的基因表达的差异。Real-Time PCR最终的结果以2-ΔΔCt表示,体现出实验组目的基因的表达相对于内参表达量的变化倍数,使用这一方法可以直接得到目的基因相对于管家基因的定量。

表1 142-3p引物序列表
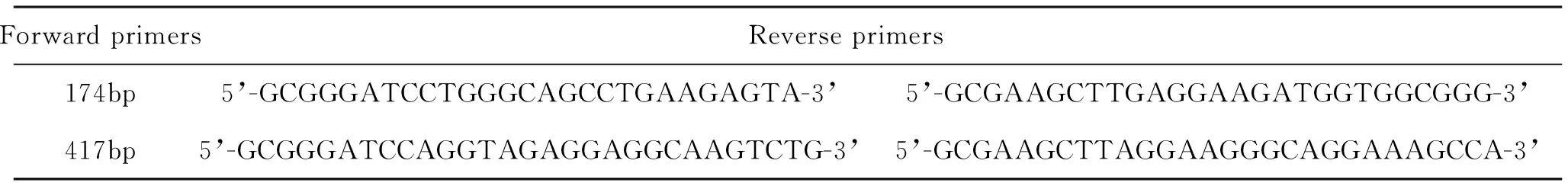
表2 miR142-3p表达载体引物序列表
5 载体构建 以pSliencer 4.1-CMV-puro为载体,选取BamHⅠ和HindⅢ两个酶切位点,插入miR142-3p片段。总共选取两段,一段为174bp(87bp miR142-3p前体序列+上游35碱基+下游52碱基),一段为417bp(87bp miR142-3p前体序列+上游181碱基+下游150碱基)。30l PCR反应体系包括:3l 10×KOD buffer, 1.2l MgSO4,3l dNTP,0.5l 正向引物(10M),0.5l反向引物(10M),2l K562DNA 模板,1l KODase,18.8l双蒸水补足30l。反应程序按照:95 ℃5 min,重复如下循环35次:94 ℃ 30 s,65 ℃ 45 s, 72 ℃ 1 min。最后72 ℃ 10 min(图1)。
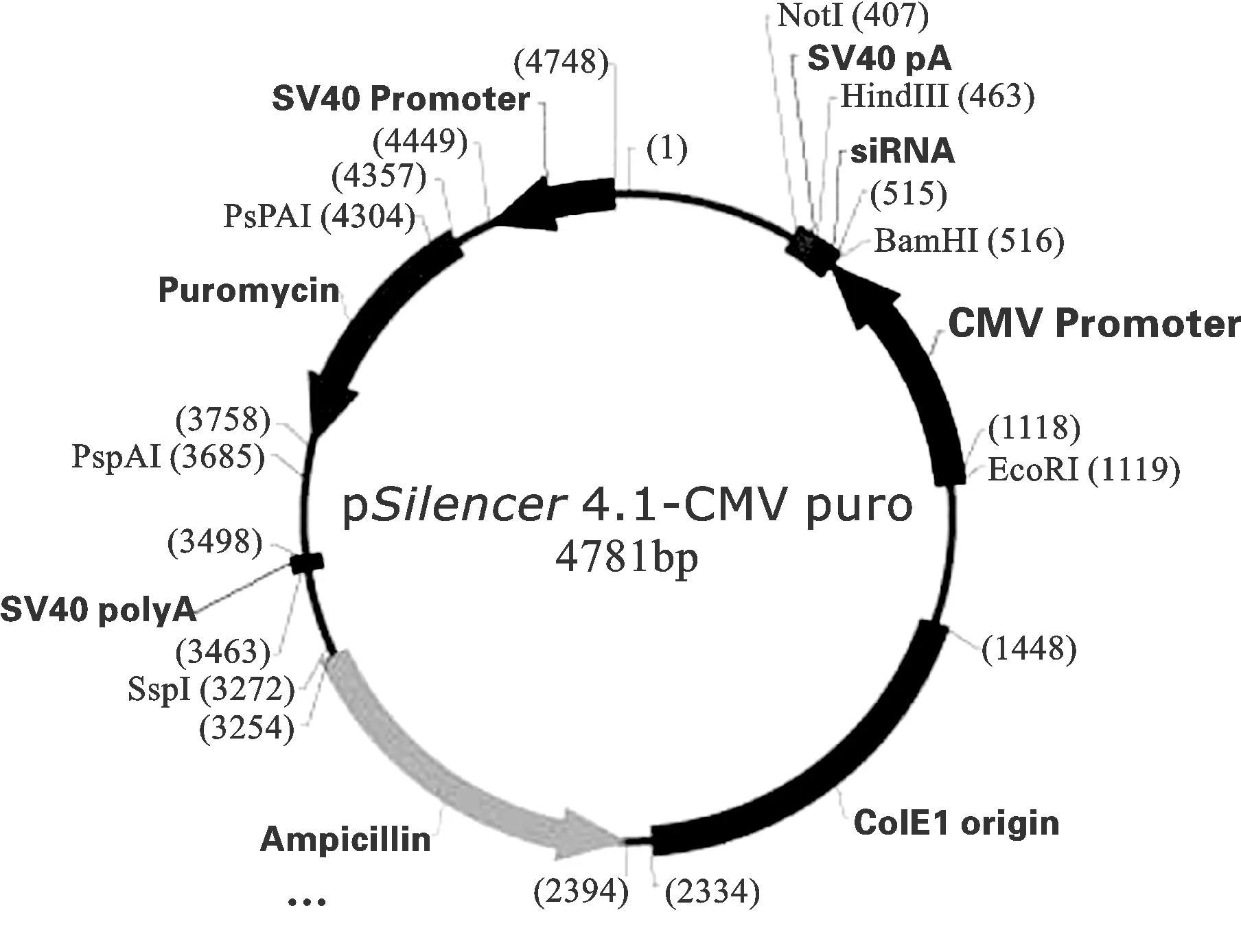
图1 pSliencer4.1-CMV-puro载体图谱
6 蛋白印迹 本研究中蛋白印迹实验(Western blot)的详细操作步骤如下:用预冷的0.01 M 的PBS缓冲液(pH 7.4)润洗细胞2次,按照细胞密度加入适量的含DTT 的2×SDS裂解液,彻底裂解细胞,并收集至EP管中,Type17600 Dri-Bath 调节温度至95℃,95 ℃煮10 min,冰上放置10 min,重复2次,使蛋白彻底变性,再用95 ℃ 煮 10 min后,12 000 rpm,室温离心 5min,将上清(即总蛋白)移至另一干净的EP管中。 利用BCA蛋白质定量试剂盒测定蛋白浓度,蛋白保存在-80℃冰箱备用,以防降解。根据蛋白定量结果,以10孔板,每孔上样10 μl蛋白样品为例,配制蛋白上样体系,不足的体积用2×SDS裂解液补足,同时加入溴酚蓝示踪。根据目的蛋白分子量大小配制8%~12%的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离目的蛋白。
上样完成后,首先用电压80 V电泳至分离胶时换电压为120 V,直至溴酚蓝示踪条带电泳至电泳槽底部,终止电泳。电泳结束后,取出电泳胶,在预冷的转膜液中进行转膜,去除积层胶,将含有蛋白质的分离胶安放在Western blot专用三明治式转膜夹中,安放顺序由负极至正极依次为黑板、海绵、滤纸、分离胶、PVDF膜、滤纸、海绵和白板。转膜采用湿转法,恒流 300 mA或恒压100 V,转膜时间根据蛋白质分子量设定为 1 h 40 min,将蛋白转移至NC膜上。转膜结束后,注意与分离胶接触的一面朝上,用TBST将PVDF膜漂洗1次,经丽春红染色评估蛋白电泳、转膜以及蛋白定量的情况,然后用TBST漂洗PVDF膜3次,每次5 min,充分洗涤直至将丽春红染色洗净。将PVDF膜孵育在TBST配制的5%的脱脂奶粉中,室温 1 h,以封闭PVDF膜上的非特异性结合位点。封闭结束后,将PVDF膜孵育在TBST配制的目的蛋白的相应一抗中,室温 1 至 2 h 或4 ℃ 孵育过夜。TBST漂洗PVDF膜3 次,室温,每次10 min,再将PVDF膜孵育在相应的辣根过氧化物酶标记的二抗中,室温 1 h。TBST漂洗PVDF膜3次,室温,每次10 min。抗原抗体复合物用Immobilon Western Chemilminescent HRP Substrate试剂进行显影,在Fluor Chem E扫膜仪器上检测蛋白表达情况并曝光存图。
7 统计学方法 采用SPSS 18.0统计学软件进行统计分析。计量资料用均数±标准差表示。正态分布的两组组间比较采用t检验;非正态分布的两组组间比较采用非参数检验;率的比较采用卡方检验和确切概率法,P<0.05表示差异有统计学意义。
结 果
1 miR142-3p在结直肠癌组织中表达下调 对20例结直肠癌病人的肿瘤组织样本和20例癌旁组织通过组织原位杂交的方法,检测miR142-3p的表达及定位。实验结果显示,miR142-3p成熟体主要定位于细胞的胞浆,根据miR142-3p表达的强弱,主要判断标准是按照原位杂交染色的强度分为三个等级,阴性(-)、弱阳性(+)和强阳性(),在20例癌组织中miR142-3p阳性表达9例(45%),其中弱阳性表达7例(35%),强阳性表达2例(10%);在20例癌旁组织中miR142-3p阳性表达18例(90%),其中弱阳性表达2例(10%),强阳性表达16例(80%),说明在癌组织和癌旁组织中miR142-3p的表达差异具有统计学意义(P值<0.01,图2)。
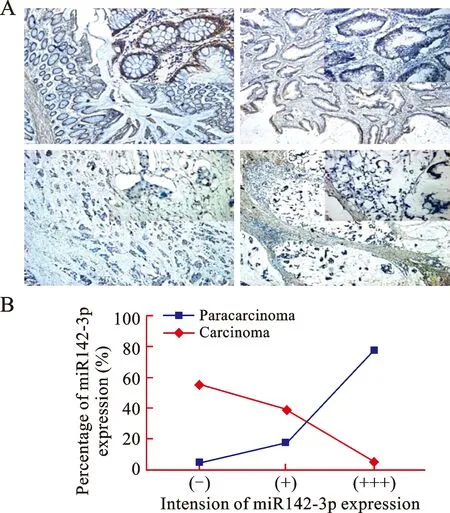
A:组织原位杂交检测hsa-miR142-3p成熟体在各种类型结肠病变的表达情况(正常粘膜上皮、高分化腺癌、低分化腺癌和粘液癌);B:比较hsa-miR142-3p成熟体在结直肠癌患者癌旁组织和癌组织表达的差异(癌旁组织n=20例,癌组织n=20例);表达强度分别记为阴性(-)、弱阳性(+)和强阳性(),*P<0.01
图2 结直肠癌组织hsa-miR142-3p的表达
2 miR142-3p结直肠癌细胞系中呈低表达 通过Realtime-PCR检测结直肠癌细胞系SW1116、Caco2、HCT-116、Lv-174T中的miR142-3p表达含量(K562细胞作为阳性对照),发现结直肠癌细胞系中miR142-3p的表达量很低(图3)。
3 结直肠癌细胞系中过表达miR142-3p下调细胞周期相关蛋白,抑制细胞增殖 将miR142-3p的表达载体(417bp)在结直肠癌细胞系Caco2中瞬时过表达,48 h后细胞计数发现过表达外源性miR142-3p的这组细胞与对照组相比增殖速度明显减慢,说明外源性的miR142-3p能够明显抑制结直肠癌细胞Caco2的增殖。同时Western Blot检测蛋白发现,过表达外源性miR142-3p 48 h后能够使细胞周期相关蛋白CyclinD1在蛋白水平表达下降(图4)。
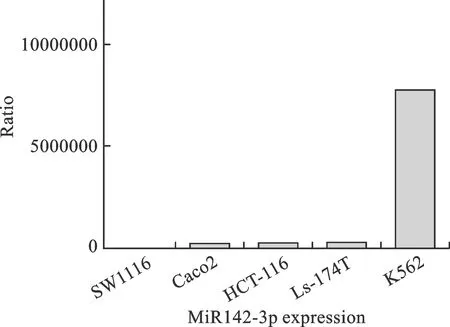
图3 结直肠癌细胞系中miR142-3p的表达
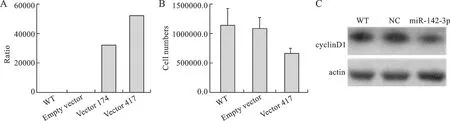
A:从K562基因组DNA中分别克隆长174bp和417bp的miR142-3p片段,构建到miRNA的表达载体pSilencer4.1-CMV,通过Realtime PCR检测重组质粒pSilencer4.1-CMV-miR142-3p载体在结直肠癌细胞系SW1116的表达情况;B:在结直肠癌细胞系Caco2中瞬时转染重组质粒miR142-3p 417,pSilencer4.1-CMV作为阴性对照,48 h后细胞计数评价细胞增殖情况;C:在结直肠癌细胞系Caco2中瞬时转染miR142-3p表达载体miR142-3p 417片段,pSilencer4.1-CMV作为阴性对照,48 h后通过Western Blot检测细胞周期相关蛋白CyclinD1的表达变化
图4 过表达miR142-3p能够抑制细胞增殖
讨 论
miRNAs在细胞的生长 、分化 、增殖 、发育 、凋亡和代谢等多种过程中发挥着重要作用 ,miRNAs表达的失衡会导致肿瘤的发生,miRNAs 与结直肠癌的发生、发展密切相关[14-21]。
本研究发现在正常结直肠癌旁组织的粘膜中miR142-3p高表达,癌组织中表达减少,并且随着肿瘤分化程度的降低,miR142-3p的表达也随之减少。在结直肠癌细胞系中miR142-3p的表达下调。过表达miR142-3p能抑制结直肠癌Caco2细胞的增值。Zhang等[22]将miRNA-143靶向作用于MACC1的3UTR,下调 MACC1表达; 提示 miRNA-143可能直接作用于其靶分子MACC1,抑制癌细胞侵袭。BOL等[23]发现在CRC细胞系和组织样本中miRNA-152表达下调;恢复CRC细胞中miRNA-152表达后,CRC细胞增殖、迁移和入侵显著减少; PIK3R3是miRNA-152直接和功能性下游靶目标,PIK3R3表达和miRNA-152表 达呈负相关;下调PIK3R3表达使miRNA-152超表达,抑制肿瘤细胞生长。另有研究表明[24-28],一部分miRNAs在肿瘤中呈高表达。我们的研究与BOL等的研究获得了相似的结果,我们推测miR142-3p与miRNA-152等一部分miRNAs在结直肠癌的发生、发展中起负性调控,另外一部分miRNAs起正性调控作用,如何精准调控?有待于进一步研究。
如何特异性地将 miRNA的激活剂及抑制剂引入肿瘤细胞,以及如何利用 miRNA的表达谱为早期结直肠癌提供诊断和治疗依据[29-33],将是我们面临的挑战与机遇。
[1] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. Ca Cancer J Clin, 2017,67(1): 7-30.
[2] Torre LA, Sauer AM, Chen MS Jr,etal. Cancer statistics for Asian Americans, Native Hawaiians, and Pacific Islanders, 2016: Converging incidence in males and females[J]. Ca Cancer J Clin,2016,66(3):182-202.
[3] Siegel RL, Miller KD, Jemal A. Cancer statistics,2016[J]. Ca Cancer J Clin, 2016,66(1):7-30.
[4] El-Shami K, Oeffinger KC, Erb NL,etal.American cancer society colorectal cancer survivorship care guidelines[J].Ca Cancer J Clin,2015,65(6):428-455.
[5] Kyu WJ,Young JW,Chang MO,etal.Cancer statistics in Korea:Incidence,mortalcty survival,and prevalence in 2014[J]. Cancer Rancer Treat,2017,49(2): 292-305.
[6] Kuipers EJ, Grady WM, Lieberman D,etal.Colorectal cancer[J]. Nat Rev Dis Primers,2015,1:15065.
[7] Di Leva G, Garofalo M, Croce CM.Micro RNAs in cancer[J].Annu Rev Pathol,2014,9:287-314.
[8] Scott M. Hammond.An overview of microRNAs[J].Adv Drug Deliv Rev,2015,87:3-14.
[9] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism,and function[J]. Cell,2004,116: 281-297.
[10] Wang Y, Ouyang M, Wang Q,etal.MicroRNA-142-3p inhibits hypoxia/reoxygenation induced apoptosis and fibrosis of cardiomyocytes by targeting high mobility group box 1[J]. Int J Mol Med, 2016,38(5): 1377-1386.
[11] Li Y, Chen D, Jin LU,etal.Oncogenic microRNA-142-3p is associated with cellular migration, proliferation and apoptosisin renal cell carcinoma[J].Oncol Lett, 2016,11(2): 1235-1241.
[12] Hu T, Phiwpan K, Guo J,etal. MicroRNA-142-3p negatively regulates canonical Wnt signaling pathway[J].PLoS One, 2016,11(6): e0158432.
[13] Taichi I, Shigeo H, Daniel J H,etal.miR-142 regulates the tumorigenicity of human breast cancer stem cells through the canonical WNT signaling pathway[J].eLife,2014,3: e01977.
[14] 邱 伟,杨成琳,刘 阳.miR-210通过下调JAK-STAT信号通路抑制胆囊癌细胞增殖的实验研究[J].陕西医学杂志,2016,45(6):652-655.
[15] Gemma B, Francisco RM, Alex T,etal.Colorectal cancer: From prevention to personalized medicine[J].World J Gastroenterol,2014,20(22):6786-6808.
[16] 段敏丹,陈 雪,王 悦,等.微小RNA多态性和非小细胞肺癌遗传易感性关系研究[J].陕西医学杂志,2017,46(7):833-835.
[17] Marco R, Cristina B, Luisa S,etal.Non-coding landscapes of colorectal cancer[J].World J Gastroenterol,2015,21(41):11709-11739.
[18] 关 舒,于鑫淼, 毛晓韵,等. miR-487a 增加MCF-7/MX荷瘤鼠对米托葸醌敏感性机制探 讨[J].陕西医学杂志,2015,44(12):1574-1576.
[19] 彭志平,袁 飞,史学森.MicroRNA家族在结直肠癌发生发展过程中的作用[J].内蒙古医科大学学报,2013,35(5):403-406.
[20] 米志宽,赵菊梅, 刘勇峰,等.稀释碘伏对人结肠癌细胞增殖的影响[J].陕西医学杂志,2013,42(3):268-270.
[21] 魏少忠,胡 胜.结直肠癌的精准医学:大数据和微进展的时代[J].中华结直肠疾病电子杂志,2016,5(5):370-375.
[22] Yu Z, Zhongqiu W, Min C,etal.MicroRNA-143 targets MACC1 to inhibit cell invasion and migration in colorectal cancer[J].Mol Cancer, 2012,11: 23.
[23] Bo L,Xie Z,Bai L.miR-152 functions as a tumor suppressor in colorectal cancer by targeting PIK3R3[J].Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine,2016,37(8):10075-10084.
[24] Linwensi Z, Jingyuan F.The structure and clinical roles of MicroRNA in colorectal cancer[J].Gastroenterol Res Pract,2016,2016: 1360348.
[25] Lina C, Peter W, Eide GE.etal.MicroRNAs as growth regulators, their function and biomarker status in colorectal cancer[J].Oncotarget,2016, 7(6): 6476-6505.
[26] Danese E, Minicozzi, AM. Benati M,etal.Reference miRNAs for colorectal cancer: analysis and verification of current data[J].Sci Rep, 2017, 7: 8413.
[27] Laura C, Claudio I, Consalvo P,etal. MicroRNA-mRNA interactions underlying colorectal cancer molecular subtypes[J].Nat Commun, 2015,6: 8878.
[28] Sushmita P, Petra L, Arndt H,etal. Identification of miRNA-mRNA modules in colorectal cancer using rough hypercuboid based supervised clustering[J].Sci Rep,2017,7: 42809.
[29] Jun W, Yong XS, Bin M,etal. Regulatory roles of Non-coding RNAs in colorectal cancer[J].Int J Mol Sci,2015,16(8): 19886-19919.
[30] Jingmei L, Chia CC, Li Z.Potential roles of microRNAs and ROS in colorectal cancer: diagnostic biomarkers and therapeutic targets[J].Oncotarget, 2017, 8(10): 17328-17346.
[31] Gemma B, Francisco R, Alex T,etal.Colorectal cancer: From prevention to personalized medicine[J].World J Gastroenterol,2014,20(22): 6786-6808.
[32] Marco R, Cristina B, Luisa S,etal.Non-coding landscapes of colorectal cancer[J].World J Gastroenterol, 2015,21(41): 11709-11739.
[33] 李 俊.参麦注射液联合化疗对结直肠癌Lovo 细胞的增殖抑制作用[J].陕西中医,2015,36(5):629-630.
(收稿:2017-09-18)
TheexpressionofmiR-142-3pincolorectalcanceranditseffectonproliferation
Zhu Wenxia,Yang Ling,Cheng Jun,et al.
Medical College of Yan’an University(Yan’an 716000)
Objective: To observe the expression of microRNA-142-3p in colorectal cancer and its effect on the proliferation of human colorectal cancer cells. Methods: The expression of miR142-3p in the tissues of colorectal cancer was detected by in situ hybridization. The expression of miR142-3p in colorectal cancer cell lines was detected by Realtime-PCR. Construction of pSliencer 4.1-CMV-miR142-3p overexpressing vector, the colorectal cancer cells Caco2 was transfected. The expression of recombinant plasmid pSilencer4.1-CMV-miR142-3p vector in colorectal cancer cell lines was detected by Realtime PCR. The expression of CyclinD1 was detected by Western Blot. Results: miR142-3p was mainly located in the cytoplasm of cells, The expression of miR142-3p was different in cancer tissues and adjacent tissues. The expression of miR142-3p in colorectal cancer cell lines was low. Overexpression of miR142-3p in colorectal cancer cell lines may down-regulate the expression of cell cycle-associated protein CyclinD1, which inhibit cell proliferation. Conclusion: miR142-3p can inhibits the proliferation of colorectal cancer CAGE2 cells and down-regulation the expression of CyclinD1 and is expected to be a potential target for the diagnosis and treatment of colorectal cancer.
Colorectal neoplasms/physipathology @MicroRNA 142-3p Proliferation
结直肠肿瘤/病理生理学 @微小分子142-3p 增殖
R392.3
A
10.3969/j.issn.1000-7377.2018.03.003

