微卡联合化学药物治疗多耐药结核病临床疗效分析*
毕占友, 郝 军, 陈忠建 ,刘占永,刘秀梅
1.河北省廊坊市疾病预防控制中心(廊坊 065000),2.河北省大城疾病预防控制中心(廊坊 065900)
耐多药肺结核是指患者机体对抗肺结核药物最少两类药联用时产生耐药性,异烟肼和利福平联用最常见,只使用一类药物已无法取得效果[1]。该疾病由于耐药性高,使得用药效果差,治愈率低,对病情难以控制,威胁人们的身体健康和生命安全[2-3]。我院选取80例耐多药肺结核病患者作为研究对象,观察微卡与抗结核化学药物联合使用的治疗效果。
资料与方法
1 一般资料 选取2013年1月至2017年1月我院收治的多耐药结核病患者80例,经临床诊断确诊为多耐药结核疾病,根据治疗的方式分为化学组和联合组,每组40例。化学组男性21例,女性19例,年龄25~61岁,平均(40.8±4.3)岁;病程0.5~12年,平均病程(7.5±1.2)年。联合组男性24例,女性16例,年龄24~63岁,平均年龄(41.7±5.2)岁,病程7个月至13年,平均病程(7.8±1.3)年。两组在男女比例、年龄、病程等方面比较差异不显著(P>0.05),具有可比性。
2 治疗方法 化学组单用抗结核化学药物进行治疗,规范应用异烟肼片(0.3 g,国药准字H36021109)口服,0.3 g/次,1次/d,利福喷汀胶囊(国药准字,20133047)口服,0.3 g/次,3次/周,盐酸左氧氟沙星胶囊(国药准字,H20064126)口服,0.5 g/次,1次/d;联合组在化学组的基础上,于治疗的第8天起给予微卡(国药准字S20010003)注射治疗,使用灭菌注射用水溶解后在臀部行肌肉注射,0.5 mg/次,1次/2周,患者的痰菌转阴即可停止使用。两组的治疗疗程为8个月。
3 观察指标 在治疗的不同阶段(3个月、6个月、8个月)给患者做细菌学的检查,做痰菌涂片检测患者痰结核菌转阴的情况;同时给患者做影像学的检查,做胸部X线片检查患者的病灶闭合情况;检测治疗疗程结束后患者的免疫淋巴细胞群情况(CD4+水平、CD8+水平及CD4+/CD8+水平)。

结 果
1 两组痰菌转阴情况对比 联合组在治疗阶段3个月、6个月、8个月时痰菌转阴病例均明显多于化学组,比较差异有统计学意义(P<0.05),见表1。
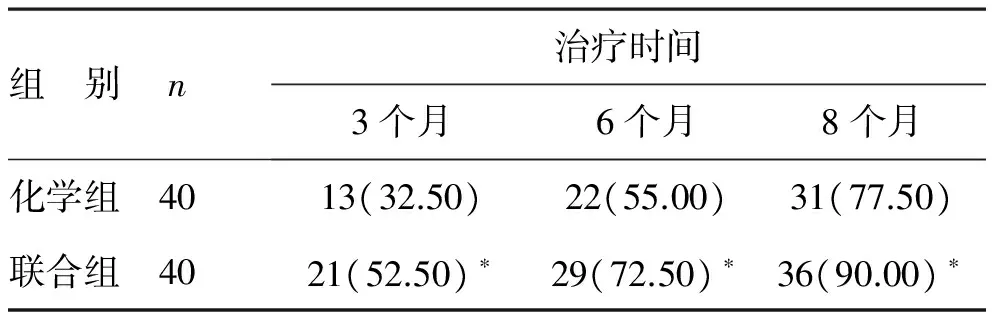
表1 两组不同治疗阶段痰菌转阴情况比较[例(%)]
注:化学组比较,*P<0.05
2 两组X线下病灶闭合情况对比 联合组在治疗阶段3个月、6个月、8个月时X线下病灶闭合病例均明显高于化学组,比较差异有统计学意义(P<0.05),见表2。
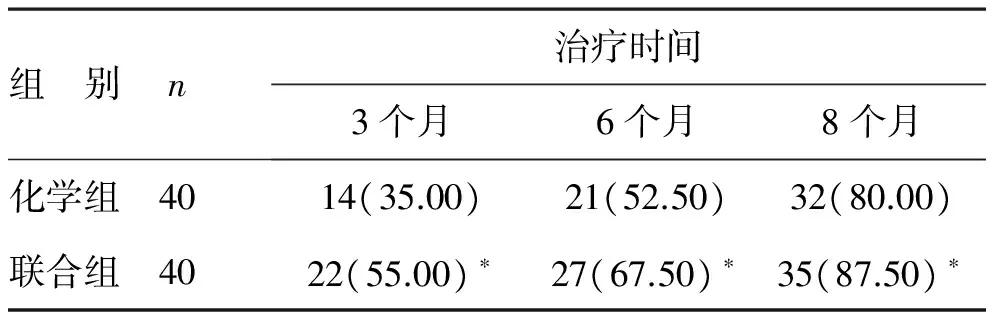
表2 两组不同治疗阶段病灶闭合情况比较[例(%)]
注:化学组比较,*P<0.05
3 两组治疗后免疫淋巴细胞情况对比 联合组治疗后的血清CD4+、CD8+及CD4+/CD8+水平均明显高于化学组,比较差异有统计学意义(P<0.05),见表3。

表3 两组治疗后免疫细胞水平比较
注:与化学组比较,*P<0.05
讨 论
目前的肺结核病治疗中,随着多种化学抗菌药物的广泛使用,肺结核病菌出现了多种耐药性,致使耐多药的肺结核病患者的数量在不断上升,耐多药肺结核疾病不仅治愈率低,而且是呼吸系统的传染性疾病,给公众的健康安全造成极大的隐患[4-6]。因此,制定有效的治疗方案是控制病情发展的关键。临床相关研究发现[7-10],微卡菌苗与化学抗结核药物联合治疗可以提高该疾病的治疗效果和预后。
本研究中,通过对照分析研究探讨了单纯抗结核化学药物与微卡联合抗结核化学药物治疗多耐药肺结核病的疗效,结果表示在治疗过程的几个阶段中,联合组的痰菌转阴和病灶愈合的情况均明显优于化学组,疗程结束后联合组的免疫提高水平明显优于化学组,对于用药产生的不良反应,两组无明显差异,说明微卡与化学药物联合使用疗效显著,能取得更好的预后。结核病是由结核杆菌感染所引发的传染性疾病,对患者肺部、淋巴系统的破坏性非常强,随着病情发展,患者的脑部、中枢神经、循环系统甚至关节等都会受到程度不等的感染,危害性非常大。
化学药是临床治疗结核病的主要方案,由于患者对一类化学药产生了耐药菌株,单一类药对耐多药肺结核患者没有作用,只能采用二类、三类的化学药物进行治疗[11-13]。长期服用抗结核化学药不仅给患者造成很大的经济压力,而且毒副反应也给患者的身心造成损害。因此,临床上注重于新型的、安全的、高效的治疗方案,微卡是通过生物技术从母牛分枝杆菌中提炼出来的冻干无毒的母牛分枝杆菌菌苗,其具有与结核病菌相似的抗原,可以产生双向的免疫调节的功能。微卡菌苗进入机体后,能增强体内巨噬细胞的作用,其产生过氧化氢、一氧化氮的水平提高,进而促进T淋巴细胞的增殖反应;可以抑制结核杆菌的感染,转化淋巴细胞提高免疫力低下患者的免疫功能,巨噬细胞的吞噬作用进一步被增强[14-15]。微卡能明显增强患者机体的抵抗能力,有效防御结核杆菌感染,与化学药物联用可以加快疾病治愈,减少需长期服药可能产生的毒副作用,安全性高[16-17]。有动物试验表明[18-21],微卡可以明显增加正常小鼠腹腔巨噬细胞产生的过氧化氢与一氧化氮水平,与此同时可以促进T淋巴细胞的增殖反应,抑制结核菌感染豚鼠反应方面具有比较高的价值;也有动物研究发现[22-26]微卡能够提高小鼠免疫力及巨噬细胞的吞噬功能。本次研究由于样本量小,对于联合用药其远期效果及不良反应的情况不能作深入分析,其结果受到一定局限,还有待于临床的进一步观察研究已完善其结果。
综上所述,微卡与化学药物联合应用于多耐药结核病患者中,治疗效果显著,可明显改善患者的痰结核菌阴转情况,促进病灶空洞的愈合,有效提高患者自身的免疫功能,临床应用价值十分重要。
[1] 李史来,刘新民,刘桂华,等.莫西沙星联合微卡治疗耐多药肺结核的短期效果分析[J].中国临床研究,2015,28(6):706-708.
[2] Yates F, Janakiraman A, Headly A,etal. Attitudes Towards Latent Tuberculosis Among Physicians in Training: The Role of BCG Vaccination.[J]. Journal of Community Health, 2015, 40(2):364-366.
[3] 刘迎宣, 胡晓平, 段 瑜. 草分枝杆菌F.U.36治疗儿童耐多药潜伏结核感染防止转成耐多药结核病近期评估[J]. 陕西医学杂志, 2013,42(11):1489-1490.
[4] 魏振宏, 梁 忠, 马守叶,等.-干扰素释放试验诊断终末期肾脏病患者潜伏结核感染的荟萃分析[J]. 临床检验杂志, 2015, 33(7):550-553.
[5] Schaaf HS, Garcia-Prats AJ. Multidrug-Resistant Tuberculosis in Children: Recent Developments in Diagnosis, Treatment and Prevention[J]. Current Pediatrics Reports, 2016,4(3):1-10.
[6] 张广恩, 符彩云, 黄静静,等. 海南省结核病耐药状况调查研究[J]. 中国热带医学, 2016, 16(12):1178-1182.
[7] 任红梅.微卡联用抗结核药治疗耐多药肺结核的临床效果观察[J].中国现代药物应用,2016,10(16):206-207.
[8] 王继业.微卡联合化疗药物治疗耐多药肺结核的疗效观察[J].中国医药指南,2017,15(5):159-160.
[9] 张海邻, 郑仰明. 关注儿童潜伏结核感染[J]. 中华实用儿科临床杂志, 2017, 32(4):256-259.
[10] 李 锋, 卢水华. 干扰素释放试验在儿童结核病和潜伏结核感染中的诊断价值[J]. 中国防痨杂志, 2015, 37(7):732-735.
[11] Lienhardt C,Vernon A, Raviglione MC. New drugs and new regimens for the treatment of tuberculosis: review of the drug development pipeline and implications for national programmes[J]. Current Opinion in Pulmonary Medicine, 2010, 16(3):186-193.
[12] Prasad R. Management of multi-drug resistant tuberculosis: practitioner's view point.[J]. Indian Journal of Tuberculosis, 2007, 54(1):3-11.
[13] 卢家泉,高 冰.扶正抗痨1号散配合化疗治疗耐多药肺结核32例[J].陕西中医.2014,35(3):319-315.
[14] Trotta T, Fasanella A, Scaltrito D,etal. Comparison between three adjuvants for a vaccine against canine leishmaniasis: in vitro evaluation of macrophage killing ability[J]. Comparative Immunology Microbiology & Infectious Diseases, 2010, 33(2):175-182.
[15] Gein SV, Sharav'Eva IL. Chronic cold stress modulates the function of peritoneal macrophages in vivo[J]. Doklady Biological Sciences, 2017, 474(1):129-131.
[16] 凌应冰,谢鸿恩,卢艳春.莫西沙星联合微卡治疗复治耐多药肺结核患者的临床疗效及免疫功能观察[J].中国实用医药,2017,12(5):133-135.
[17] 张 凡.微卡联合化疗药物治疗耐多药肺结核疗效观察[J].黑龙江医药,2016,29(6):1141-1142.
[18] Kovaevic-Jovanovic V, Mitic K, Stanojevic S,etal. Production of H2O2and no by rat peritoneal macrophages in response to gut commensal bacteria.[J]. Acta Veterinaria, 2009, 59(2-3):111-122.
[19] Gonzalez A, Restrepo A, Cano LE. Role of iron in the nitric oxide-mediated fungicidal mechanism of IFN-gamma-activated murine macrophages against Paracoccidioides brasiliensis conidia[J]. Rev Inst Med Trop Sao Paulo, 2007, 49(1):11-16.
[20] Breuillard C, Curis E, Le PS,etal. Nitric oxide production by peritoneal macrophages from aged rats: A short term and direct modulation by citrulline[J]. Biochimie, 2017, 133(12):66-73.
[21] Payushina OV. Hematopoietic microenvironment and the role of mesenchymal stromal cells in its organization[J]. Biology Bulletin Reviews, 2015, 5(4):383-393.
[22] Cybulsky MI, Cheong C, Robbins CS. Macrophages and Dendritic Cells: Partners in Atherogenesis[J]. Circulation Research, 2016, 118(4):637-652.
[23] Fuchs T, Hahn M, Riabov V,etal. A combinatorial αβ T cell receptor expressed by macrophages in the tumor microenvironment.[J]. Immunobiology, 2015, 222(1):39-44.
[24] Takamatsu M, Hirata A, Ohtaki H,etal. Inhibition of indoleamine 2,3-dioxygenase 1 expression alters immune response in colon tumor microenvironment in mice[J]. Cancer Science, 2015, 106(8):1008-1015.
[25] Terkawi MA, Cao S, Herbas MS,etal. Macrophages Are the Determinant of Resistance to and Outcome of Nonlethal Babesia microti Infection in Mice[J]. Infection & Immunity, 2015, 83(1):8-16.
[26] Bioley G, Lassus A, Terrettaz J,etal. Long-term persistence of immunity induced by OVA-coupled gas-filled microbubble vaccination partially protects mice against infection by OVA-expressing Listeria[J]. Biomaterials, 2015, 57(6):153-160.

