甲氨蝶呤对类风湿性关节炎大鼠滑膜细胞凋亡基因调控的实验研究*
周文旭,方 堃,谭湘淑,佘 君,梁 熹 ,刘 江,蒲 丹
1.西安交通大学第一附属医院(西安710061),2.西安交通大学医院(西安710049)
类风湿性关节炎(Rheumatoid arthritis, RA)是一种临床常见的以侵犯关节滑膜、软骨及骨为主的自身免疫病,病变过程多涉及多种细胞和细胞因子。位于关节滑膜内层的成纤维样滑膜细胞(Fibroblast-likesynoviocytes, FLS)在RA病变中异常活化,是介导关节局部炎症的关键细胞之一。有研究表明:类风湿关节炎的关节软骨和骨组织损害,与滑膜细胞的过度增生活化与凋亡不足密切相关[1]。因此抑制炎性滑膜组织增生及诱导滑膜组织中各种细胞凋亡是类风湿性关节炎治疗的靶点[2-3]。
甲氨蝶吟(Methotrexate, MTX)近多年来已成为RA临床治疗的基石用药(Anchor drug)[4]。但对于其治疗RA的作用机制尚不明确。本研究采用CIA模型,观察甲氨蝶吟对大鼠整体疗效及对滑膜组织中Bcl-2、Bax、Caspase-3、9蛋白的表达影响,进一步探讨甲氨蝶吟治疗RA的作用机制,为寻找新的抗类风湿关节炎药物提供实验依据。
材料与方法
1 实验动物 SPF级健康雌性SD大鼠60只,体重(120±20)g,鼠龄4~5周,中国医学科学院生物制品研究所提供。实验开始前1周进行适应性饲养,保持室内22℃,自由摄食。
2 药品与试剂 酸可溶性II型胶原蛋白(CII)与弗氏不完全佐剂为Sigma公司产品。甲氨蝶吟片,2.5 mg购自上海医药有限公司信谊制药总厂。Caspase-3,Caspase-9,Bax,Bcl-2和GAPDH抗体及辣根过氧化物酶标记山羊抗大鼠IgG购自碧云天生物技术有限公司。Trizol购自Invitrogen公司;反转录试剂盒(美国Thermo公司);荧光定量试剂购自北京康为世纪生物科技有限公司。引物由Invitrogen公司合成。药物均研磨成粉末,采用生理盐水制成所需浓度。
3 实验方法
3.1 动物造模与分组:选取清洁级Wistar大鼠40只,体重50~100 g,用0.1 mmol/L醋酸溶解II型胶原蛋白(2 mg/ml,4℃,过夜),再与等量的弗氏完全佐剂混合,于冰浴中充分乳化除正常组外,每只大鼠尾根部皮下多点注射胶原蛋白0.2 mg。造模后10 d将动物随机分为假模型组,模型组,高、中、低给药组各8只。各组给药量如下:高剂量给药组30 mg/kg,中剂量给药组3 mg/kg,低剂量给药组0.3 mg/kg,按10 ml/kg量灌胃,每日1次,假模型组,模型组给予等量生理盐水灌胃,1.0 g/kg,1次/d。各组连续30 d用药。分别于致炎后第14、16、18、20、24、28天用毛细管放大测量法测右后足体积,求出肿胀增长百分率=[(给药后值-给药前值)/给药前值]×100%。
3.2 滑膜细胞分离培养:各组大鼠末次给药后24 h,无菌操作取大鼠膝关节滑膜组织,并剪成1 mm3大小后加4 m1 0.4 mg/ml的II型胶原酶(溶于含10%胎牛血清的DMEM培养基),于5% CO2条件下孵育3 h,离心收集未贴壁的细胞,将细胞重悬于含有15%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基,置37℃、体积分数为5% CO2培养箱中培养。实验用第2~4代细胞。实验时用含15%小牛血清的DMEM培养液将滑膜细胞数调整至每毫升1×106个细胞加入6孔培养板内,每孔2 ml,于37℃、5%CO2培养箱培养4 h。
3.3 流式细胞术检测细胞凋亡率:取对数生长期细胞,按细胞浓度为2×105/ml,每孔接种1 ml于6孔培养板。培养24 h后,吸弃残余培养基,根据造模结果选取大鼠足肿胀抑制作用最有效的药物浓度组(3 mg/kg MTX),与未给药的模型组共3个组。继续培养24 h后吸弃上清液,PBS洗涤2次,胰酶消化收集细胞,重悬于离心管中,室温下2000 r/min离心5 min。用Loading Buffer悬浮细胞,制备细胞悬液,向悬液中加入5 μl AnnexinV FITC和 10μl碘化丙啶(PI),混匀。室温避光孵育5 min,流式细胞仪检测细胞凋亡率。重复3次。
3.4 Caspase-3,Caspase-9,Bax,Bcl-2 蛋白表达测定:提取细胞总蛋白,后取蛋白质样品50 μg加缓冲液煮沸变性后,10%SDS PAGE;电转移至PVDF膜;用含5%脱脂奶粉TBS (pH 8.0)封闭2 h;加入适量Bc1-2、Bax 鼠单抗IgG (1∶400)、Caspase-3兔多抗IgG(1∶400),摇床上室温反应2 h;洗膜3次,每次20 min;加辣根过氧化物酶标记的羊抗鼠IgG(1∶6000),室温反应2 h;洗膜后作ECL化学发光,X光显影。图像扫描仪扫描后,用图像分析软件Band Scan 5.0行吸收度积分值分析,计算目的蛋白与内参照GAPDH蛋白表达量的吸收度积分值之比作为目的蛋白表达量相对含量,实验重复3次。

结 果
1 大鼠佐剂关节炎模型的制备 致炎各组大鼠和正常大鼠相比,毛色晦暗并轻微脱毛,精神萎靡,食量减少,体重增长减缓,尾部出现明显结节,双侧后踝关节出现明显肿胀,造模成功,模型成功率达85%。模型组大鼠右后足在致炎后14 d出现肿胀,在致炎后28 d前后肿胀度达峰值见表1。与模型组比较,甲氨蝶呤显示出剂量依赖性抑制大鼠足肿胀的作用,且模型组的足肿胀度越高,甲氨蝶呤的抑制作用越强,药物在致炎后28 d左右抑制作用达到峰值,见图1。其中,以高剂量最为明显(P<0.01),与对照组比较, 差异有统计学意义(P<0.05),我们选择其进行下面的实验。
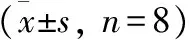
表1 甲氨蝶呤对Ⅱ型胶原蛋白(CⅡ)诱导大鼠足肿胀的抑制作用
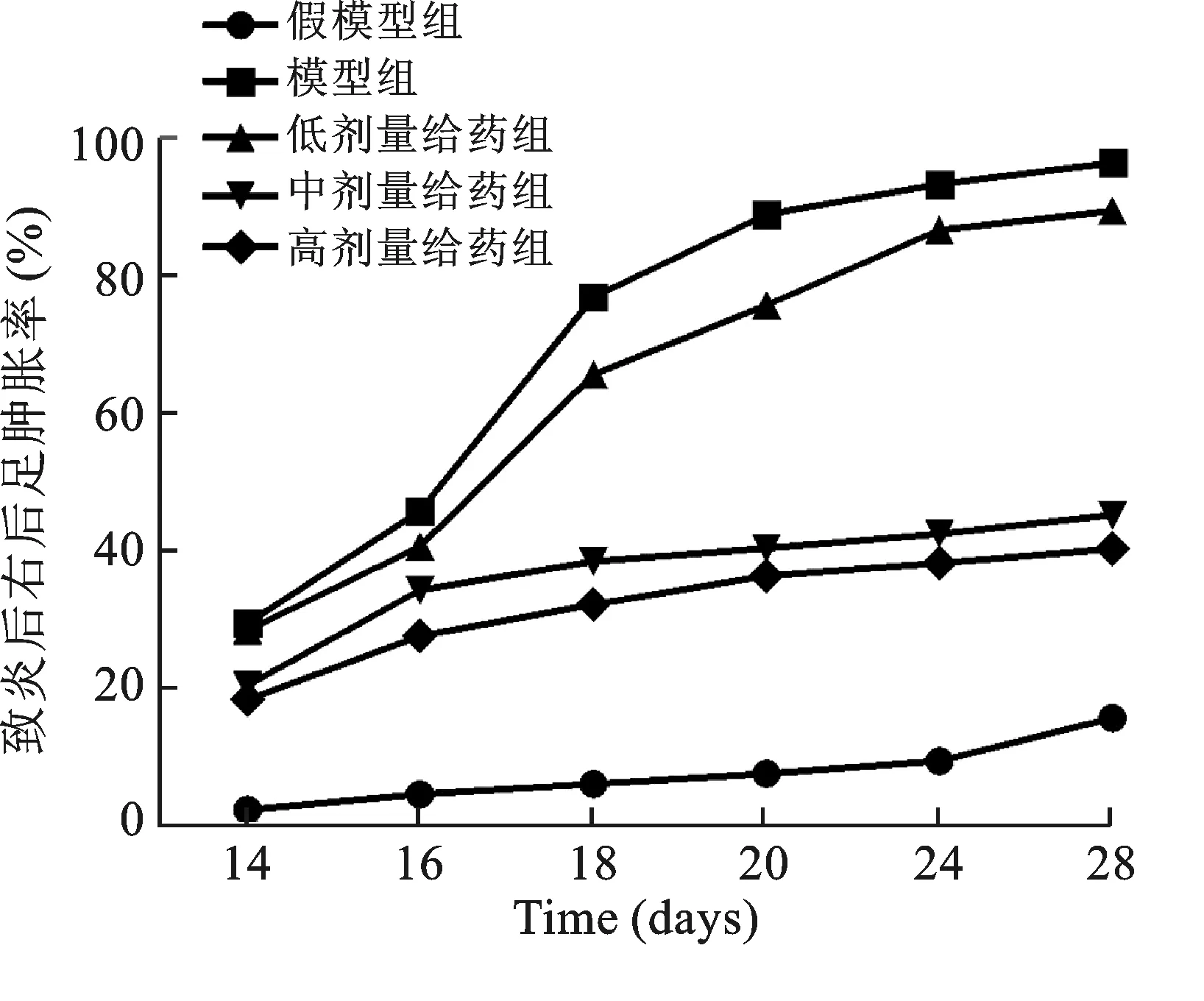
图1 甲氨蝶呤对Ⅱ型胶原蛋白诱导大鼠足肿胀的抑制作用
2 甲氨蝶呤对RA滑膜细胞凋亡的影响 细胞分离后培养48 h经Anziexin V/PI染色,用流式细胞术检测各组凋亡细胞(图2),以右上和右下象限为凋亡细胞,统计各组凋亡细胞百分率。各组均能不同程度诱导RA滑膜细胞凋亡,以给药组的作用最明显。与对照组比较,模型组和假模型组明显诱导RA滑膜凋亡(P<0.05)。
3 对大鼠关节滑膜细胞中Caspase-3、Caspase-9、Bax、Bcl-2 蛋白表达的影响 见图3。高剂量甲氨蝶呤组的Caspase-3、Caspase-9、Bax蛋白表达量与模型组比较明显上调;而与模型组相比较,Bc1-2蛋白表达量下降(P<0.01)。

假模型组 模型组 给药组
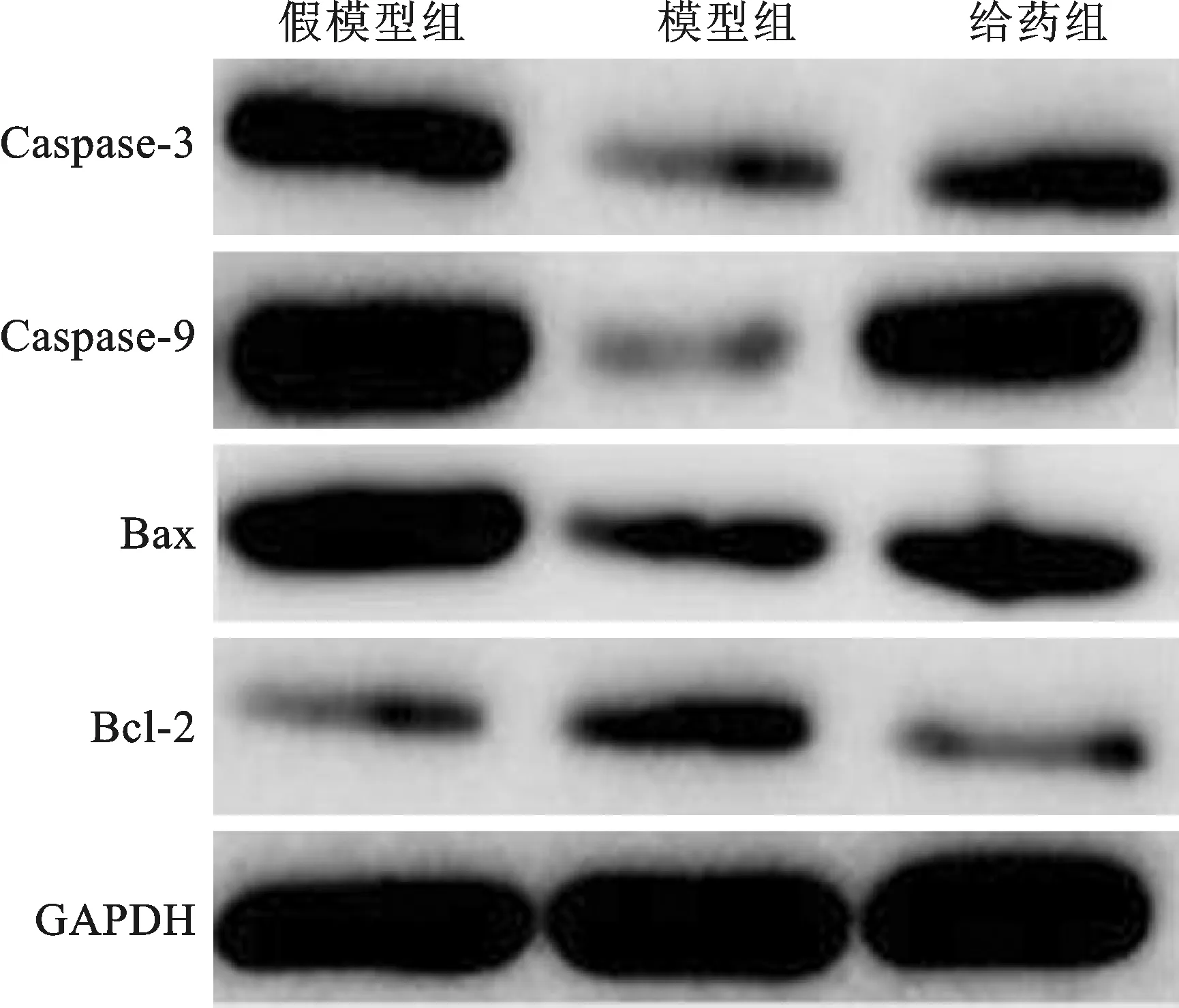
图3 线粒体凋亡途径凋亡蛋白水平
讨 论
RA是一种病变累及周围关节的多系统性炎症性的自身免疫病[5]。常因没有早期诊治,在发病两年内出现不可逆的骨关节破坏,造成关节畸形以及功能丧失,最终残疾[6]。有研究表明:类风湿关节炎的关节软骨和骨组织损害,与滑膜细胞的过度增生活化与凋亡不足密切相关[1]。因此,抑制自身免疫反应的细胞增殖及促进该免疫反应的细胞凋亡,阻止关节滑膜中炎性细胞的浸润可减轻关节炎病变,是治疗关节炎的一条重要途径。
甲氨喋吟是目前公认的治疗RA有效的免疫抑制剂,通过对腺苷诱导的免疫抑制作用、对炎性细胞增殖和凋亡的影响及对单核细胞和淋巴细胞因子及其抑 制因子的作用等,以及使滑膜组织金属蛋白酶水平降低,从而发挥抗炎及免疫抑制作用[7-9]。有研究表明:许多RA患者单用MTX即可使炎症缓解,疾病活动性得到明显的控制,且单药治疗除了极高的卫生经济学价值外,还有相当好的安全性。Bologna等也对服用甲氨蝶吟的类风湿关节炎患者的长期随访研究发现患者的关节肿痛晨僵血沉及C-反应蛋白的指标在6个月左右开始显著改善。本研究显示:CIA大鼠造模后关节出现明显肿胀,以后肢最为明显,在第28天达到了高峰。进一步研究发现,治疗后,高剂量治疗组肢体炎症的肿胀程度与模型组相比均有改善。结果表明MTX的应用对局部关节炎症均有明显控制作用,这与文献报道相一致[10]。
我们的研究还发现治疗组滑膜细胞的凋亡幅度明显上升,与对照组差异显著,进一步研究发现,模型组大鼠滑膜组织的Bcl-2表达增加,而Caspase-3、Caspase-9、Bax蛋白表达下降,提示滑膜细胞凋亡相关
基因表达异常,导致细胞增生与凋亡不平衡,从而引起滑膜细胞增生。而甲氨蝶呤使从大鼠滑膜细胞Bc1-2表达减少,Caspase-3、Caspase-9、Bax表达升高。提示甲氨蝶呤可能通过调控Bcl-2和Bax等凋亡相关基因,诱导RA滑膜细胞Caspase-3、9活化,促进滑膜细胞的凋亡,抑制关节滑膜细胞的增殖,减轻滑膜增厚而发挥治疗作用。
总之,通过甲氨蝶呤对大鼠类风湿性关节炎模型滑膜细胞凋亡基因调控体内、体外的动物实验研究,初证明了甲氨蝶呤对RA滑膜细胞有较强的诱导凋亡作用,为临床上治疗RA提供了实验和理论依据,同时甲氨蝶呤在诱导RA滑膜细胞凋亡有非常复杂的作用机制,涉及体液、内分泌、免疫网络中的多种调节因子、多种转录、代谢调控因素,故还需从其他相关基因或蛋白表达方面而做进一步研究。
[1] Dhaouadi T, Sfar I, Abelmoula L,etal. Role of immune system,apoptosis and angiogenesis in pathogenesis of rheumatoid arthritis and joint destruction, a systematic review[J]. Tunis Med,2007,85(12): 991-998.
[2] Derk CT. Rheumatoid arthritis: an update[J]. Del Med J, 2015,77(2):59-63.
[3] Kawai S. Current drug therapy for rheumatoid arthritis[J]. J Orthop Sci,2013,8(2): 259-263.
[4] American college of rheumatology subcommittee on rheumatoid arthritis guidelines. Guidelines for the management of ruhematoid arthritis [J].Arthrisrheum, 2012,46(2):328-326.
[5] Rannou F,Francois M,Corvol MT. Cartilage breakdown in rheumatoid arthritis[J]. Joint Bone Spine,2006 ,73 (1) :29-36.
[6] 李 娟.艾拉莫德与甲氨蝶呤配伍治疗老年类风湿关节炎84例[J].陕西医学杂志, 2016, 45(1) : 120-121.
[7] 蒋 明,张奉春.风湿病诊断与诊断评析[M].上海:科学技术出版社,2004: 9-91.
[8] 缪 逸,朱建琴.来氟米特联合甲氨喋吟治疗类风湿关节炎26例疗效观察[J].中国现代医生, 2012, 50(21 ) : 64-65.
[9] 王秀梅.来氟米特和白芍总苷联合甲氨喋吟治疗类风湿关节炎的临床观察[J].中国医药科学, 2011, 1 (2) : 69.
[10] 霍爱鑫.肿瘤坏死因子拮抗剂联合甲氨蝶呤治疗活动期中重度类风湿关节炎56例对比观察[J].陕西医学杂志, 2015, 44(9) : 1209-1211.

