单味中药对多重耐药鲍曼不动杆菌体外抑菌作用的研究
李凯旋,赵小军,魏娟,王建云,潘奇
西安医学院第二附属医院 检验科,陕西 西安 710038
鲍曼不动杆菌(Acinetobacterbaumannii,A.baumannii)是我国院内感染最常见的病原菌之一,是一类氧化酶阴性、非发酵糖的革兰阴性杆菌,调查显示全球不同国家多重耐药、广泛耐药、全耐药的鲍曼不动杆菌都呈流行趋势[1]。对临床常用抗菌素的耐药率达84.96%[2],感染率最高的是重症监护病房(ICU)患者,病死率也逐年增高,达10%~43%[3],引起国内外医疗机构极高的关注。因此,探索寻找新的抗菌药物或药物增效剂迫在眉睫。传统中药在治疗感染性疾病方面有着悠久的历史,相关研究显示中药制剂对多重耐药细菌有明显的抑菌作用[4]。本研究采用药敏纸片琼脂扩散法和微量肉汤稀释法对板蓝根、鱼腥草、黄芩、黄连、五倍子、金银花、苦参、连翘、乌梅和穿心莲等10种单味中药免煎颗粒剂的体外抑菌作用进行检测。
1 材料与方法
1.1菌株的选取 收集来自本院2016年1月到12月门诊及住院患者的各种临床标本30株,包括痰液23株,伤口分泌物3株,血培养3株,尿液1株。选择标准菌株大肠埃希菌ATCC 25922、铜绿假单胞菌 ATCC 27853(均购于上海三踏生物科技有限公司)用于对比分析。
1.2中药颗粒剂 板蓝根、鱼腥草、黄芩、黄连、五倍子、金银花、苦参、连翘、乌梅和穿心莲均由广东一方药业公司提供,工艺先进,质量可靠。
1.3仪器和耗材 全自动细菌鉴定仪VITEK-2(法国生物梅里埃公司),恒温培养箱(上海跃进医疗器械有限公司),细菌比浊仪(山东鑫科生物科技股份有限公司),精密分析天平(Mettler-Toledo仪器上海有限公司),琼脂粉(杭州滨和微生物试剂有限公司),LB营养肉汤培养基(杭州滨和微生物试剂有限公司),96孔细胞培养板(赛业生物科技有限公司)。
1.4方法
1.4.1细菌分离及鉴定 对临床分离的各种标本进行接种、培养,参照《临床微生物学操作规程》,用法国生物梅里埃全自动细菌鉴定仪进行细菌鉴定,采用药敏纸片琼脂扩散法和微量肉汤稀释法相结合进行药敏分析,参照美国CLSI标准(2012版)规定进行结果判定,筛选出符合实验要求的多重耐药鲍曼不动杆菌。
1.4.2中药颗粒剂的制备 取适量中药免煎颗粒剂用精密分析天平精确称量,倒入烧杯中用无菌蒸馏水溶解,得每毫升相当于1 g中药材的中药免煎颗粒溶液,用滤纸过滤去除药渣颗粒,分装于试管中121℃高压灭菌15~20 min,收集滤液静置备用。
1.4.3液体培养基的配制 称取5.5 g营养肉汤培养基于锥形瓶中,加入250 mL蒸馏水,震荡摇匀使培养基完全溶解,必要时加热煮沸,用橡胶塞封口,121℃高压灭菌15~20 min,超净台放凉备用。
1.4.4菌悬液的制备 将冻存的已经过临床分离鉴定的多重耐药A.baumannii接种于血平板中,35℃恒温培养18~24 h,挑取分离纯化的菌落于无菌生理盐水中,校正浓度至0.5麦氏浊度。
1.4.5药敏纸片琼脂扩散法 用打孔器将新华1号定性滤纸制成直径为5 mm的小纸片,放入平皿中,121℃高压灭菌15~20 min,取出放凉即为无菌纸片。MH琼脂平板均匀涂上0.5麦氏单位的菌悬液,选取亚胺培南药敏纸片作阳性对照贴于中间,6片无菌小纸片贴于四周,用灭菌的加样枪加入10 μL的中药颗粒剂溶液,每种颗粒剂重复3次,35℃恒温培养箱培养18~24 h后测量抑菌圈的大小,所有结果取平均值计算。
1.4.6最低抑菌浓度(MIC)测定 96孔细胞培养板高压灭菌,将第一排和第二排标记为“肉汤空白对照、肉汤加菌阳性对照”。第三排第一孔加入相当于1 g/mL的中药滤清液200 μL,依次每孔加入100 μL肉汤对中药滤清液进行倍比稀释,第三排只加药液作为药液对照组。第四排第一孔加入相当于1 g/mL的中药滤清液100 μL,依次每孔加入100 μL菌悬液,从第二孔开始加入1 g/mL的中药滤清液100 μL倍比稀释,这样每孔的药物浓度与第三排每孔的药物浓度相同形成对照。按上述方法,依次加入10种中药滤清液,将细胞培养板置于35℃恒温培养箱中培养18~24 h,观察有无细菌生长。
1.5统计学处理 用SPSS 17.0统计软件分析,10种中药免煎颗粒对多重耐药A.baumannii的MIC值比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1药敏纸片琼脂扩散法 10种中药免煎颗粒剂对随机选取的10株多重耐药A.baumannii抑菌效果各不同,五倍子抑菌作用最强,黄芩次之;五倍子抑菌圈直径为17~30 mm,黄芩抑菌圈直径为9~22 mm;黄连、鱼腥草抑菌活性相对较弱,而乌梅、连翘、板蓝根、苦参、金银花和穿心莲的抑菌作用很弱甚至无抑菌作用(表1)。
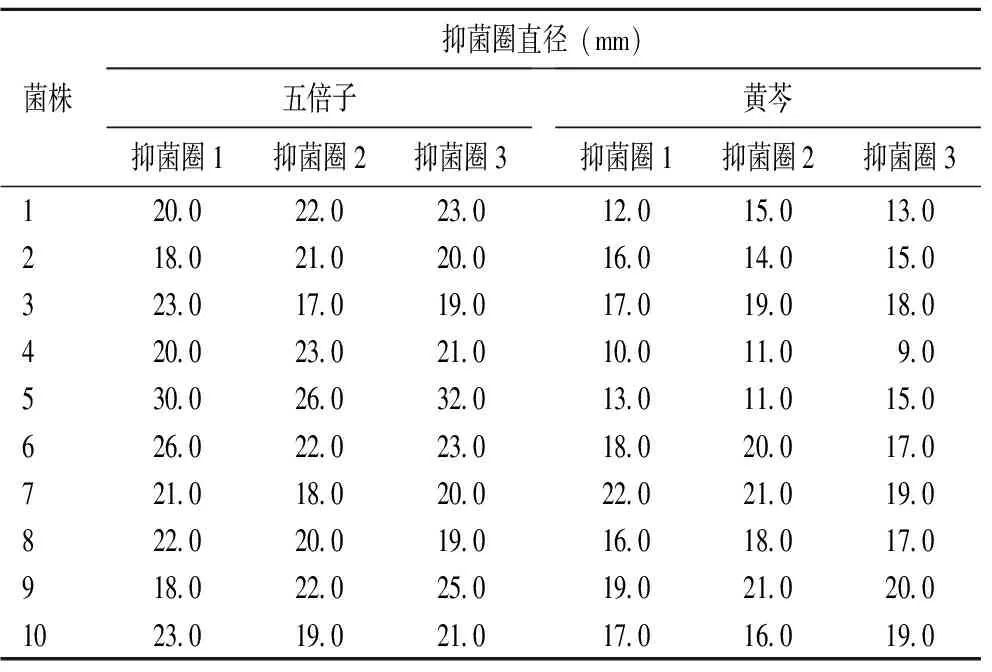
表1 中药五倍子、黄芩对临床多重耐药A. baumannii的抗菌作用
2.2微量肉汤稀释法 结果显示五倍子对多重耐药A.baumannii抑菌作用最强,MIC值为0.975 mg/mL;黄芩次之,MIC值为15.63 mg/mL;乌梅抑菌作用相对较弱,MIC值为62.5 mg/mL;而黄连、鱼腥草、连翘、板蓝根、苦参、金银花和穿心莲的抑菌作用很弱甚至无抑菌作用(t=1.639,P>0.05)(表2)。

表2 10种中药免煎颗粒对MDR-AB的体外抑菌活性
注:“-”有抑菌活性,“+”无抑菌活性(肉眼观察)。
3 讨 论
3.1鲍曼不动杆菌耐药现状 据权威部门统计发现,抗菌素在我国医疗行为中的使用率高达70%,远高于欧美等发达国家,但真正需要抗菌素治疗的疾病不到20%[5]。滥用抗菌素成为我国多重耐药细菌逐年增多的重要原因。A.baumannii是一种条件致病菌,最常见于住院患者尤其是烧伤患者或ICU患者,主要由长期应用抗菌药物、留置管道、各种侵入性操作、基础疾病长期卧床、机体免疫力低下等因素导致感染[6]。A.baumannii仅对多粘菌素B的敏感性最高,耐药率为1.4%,但因其肾毒和神经毒性作用,临床甚少使用;对头孢哌酮-舒巴坦、米诺环素、左氧氟沙星和阿米卡星的耐药率分别为33.0%、42.2%、45.5%和40.2%,对头孢吡肟、头孢西丁、头孢他啶、亚胺培南、美罗培南和环丙沙星等耐药率均在50%以上,且有逐年增高的趋势[7-9,11]。因此探索新型抗菌药物或药物替代剂已成为国内外相关学者关注的焦点。
3.2中药抑菌研究分析 中国传统中药抑菌谱广,毒副作用小,在菌体内作用途径多样化,能产生多方面药理效应,且具有避免细菌耐药和抑制细菌生长的功效,与抗菌药物联合使用更能增强抗菌药物杀菌和抗感染能力,成为抗感染药物的另一研究重点。有研究表明中药可阻断细菌某些组分的合成或抑制细菌外排泵,从而达到抑菌作用[9]。本研究通过对板蓝根、鱼腥草、黄芩、黄连、五倍子、金银花、苦参、连翘、乌梅和穿心莲等10味中药免煎颗粒剂进行体外抑菌试验,发现五倍子对A.baumannii抑菌作用最强,抑菌圈直径为17~30 mm,MIC值为0.975 mg/mL;与陈泽慧[10]报道的五味子、石榴皮等中草药对A.baumannii有一定的抑菌作用结果一致。黄芩也有较好的抑菌效果,抑菌圈直径为9~22 mm,MIC值为15.63 mg/mL;乌梅抑菌活性相对较弱,MIC值为62.5 mg/mL;而黄连、鱼腥草、连翘、板蓝根、苦参、金银花和穿心莲的抑菌活性很弱甚至无抑菌效果。五倍子对革兰阴性菌和阳性菌均有很好的抑菌作用,这与五倍子含有大量鞣质,可与细菌蛋白质结合形成鞣质蛋白,从而起到抑制或杀灭细菌的作用有关[2,9]。
3.3本研究不足及后期方向 本研究为临床治疗多重耐药鲍曼不动杆菌感染提供新的治疗思路,但发挥抑菌作用的具体中药抑菌成分仍不太清楚,目前国内外中药抑菌研究都处于体外实验阶段,抗菌中药的体内实验、临床试验仍然较少[12]。因此,选择合适的实验方法,加强对中药抑菌活性成分和机制的研究,使其更具有科学性、理论性;为今后体外实验、动物实验、临床试验及应用提供理论依据,确保药物的安全性和有效性,使中药的抑菌活性真正发挥其功效。期望具有抑菌活性的中药能在多重耐药A.baumannii感染中发挥作用。
[1] CHEN Baiyi, HE Lixian, HU Bijie, et al. Chinese expert consensus on diagnosis treatment, prevention and control ofAcinetobacterbaumanniiinfection[J]. Chin Med Pharm, 2012, 2(8): 3-8. (in Chinese)
陈佰义, 何礼贤, 胡必杰, 等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学, 2012, 2(8): 3-8.
[2]MA Mingyuan, XU Jie, YU Na, et al. Analysis of drug resistance ofAcinetobacterbaumanniiand its related factors in ICU[J]. Chin Critical Care Med, 2013, 25(11): 686-689. (in Chinese)
马明远, 徐杰, 于娜, 等. 综合ICU内鲍曼不动杆菌的耐药性和相关因素分析[J]. 中华危重病急救医学, 2013, 25(11): 686-689.
[3]Chopra T, Marchaim D, Awali R A, et al. Epidemiology of bloodstream infections caused byAcinetobacterbaumanniiand impact of drug resistance to both carbapenems and ampicillin-sulbactam on clinical outcomes[J]. Antimicrob Agents Chemother, 2013, 57(12): 6270-6275.
[4]CHEN Meiling, WANG Jian, ZHOU Hongxia, el al. Inhibitory effect of Chinese herbal medicine on multiple antibiotic -resistant bacteria[J]. Acta Chin Med Pharm, 2012, 40(2): 10-13. (in Chinese)
陈美玲, 王剑, 周红霞, 等. 中药饮片对多重抗生素耐药细菌的抑菌作用[J]. 中医药学报. 2012, 40(2): 10-13.
[5]McConnell MJ, Actis L, Pachón J.Acinetobacterbaumannii: Human infections, factors contributing to pathogenesis and animal models[J]. FEMS Microbiol Rev, 2013, 37(2): 130-155.
[6] SUN Lanqing, ZHOU Peng, QIAN Xuefeng. The characteristics of infection and genotyping of A. calcoaceticus-A.baumanniicomplex by multiplex PCR[J]. Chin J Microecol, 2017, 29(4): 457-461. (in Chinese)
孙兰清, 周鹏, 钱雪峰. 醋酸钙-鲍曼不动杆菌复合体临床分离株多重 PCR 分型和感染特征分析[J]. 中国微生态学杂志, 2017, 29(4): 457-461.
[7]Jiang M, Zhang Z, Zhao S. Epidemiological characteristics and drug resistance analysis of multidrug-resistantAcinetobacterbaumanniiin a China hospital at a certain time[J]. Pol J Microbiol, 2014, 63(3): 275-281.
[8]Liu Q, Li W, Du X, et al. Risk and prognostic factors for multidrug-resistantAcinetobacterbaumanniicomplex bacteremia: A retrospective study in a tertiary hospital of West China[J]. PLoS One, 2015, 10(6): e0130701.
[9]LI Xinyi, LIU Xin, The progress in researches onAcinetobacterbaumanniiphage[J]. Chin J Microecol, 2015, 27(3): 364-367. (in Chinese)
李新伊, 刘新. 鲍曼不动杆菌噬菌体的研究进展[J]. 中国微生态学杂志, 2015, 27(3): 364-367.
[10] CHEN Zehui , TIAN Yingbiao, LI Dandan, el al. Antibacterial effect of Chinese herbs, such as Schisandra and Pomegranate peel onAcinetobacterbaumanniiinvitro[J]. Chin Hosp Pharm J, 2015, 27(3): 364-367. (in Chinese)
陈泽慧, 田应彪, 李丹丹, 等. 五味子、石榴皮等中药对鲍曼不动杆菌体外的抑菌作用[J]. 中国医院药学杂志, 2011, 31(15): 1248-1251.
[11] Chen J, Li H, Yang J, et al. Prevalence and characterization of integrons in multidrug resistantAcinetobacterbaumanniiin Eastern China: A multiple-hospital study[J]. Inte J Env Res Pub Heal, 2015, 12(8): 10093-10105.
[12] Nowak P, Paluchowska P.Acinetobacterbaumannii: Biology and drug resistance—role of carbapenemases[J]. Folia Histochem Cyto, 2016, 54(2): 61-74.

