减压-超声辅助醇法提取薇菜黄酮及其对抗氧化活性的影响
符群,李卉,王振宇,王路
(1.东北林业大学林学院,黑龙江哈尔滨 150040)(2.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨 150090)
薇菜,学名紫萁(Osmunda japonica Thunb.),民间俗称野鸡头、大巢菜、扫帚菜,古时名为“巢菜”或“野豌豆”。紫萁科(Osmundaceae)紫萁属(Osmunda)多年生真蕨类植物。薇菜味苦性凉并富含多种蛋白质、氨基酸、维生素及微量元素[1],薇菜整株均可入药,具有抗菌、凝血、消炎退热[2]、抗氧化、增进人体免疫力、抗癌防癌及延缓衰老的作用,其中促进细胞修复等功效明显[3]。薇菜多年在国际上被称为“无污染菜”,在日本更被誉为“野山菜之王”。
薇菜是我国重要的山珍和药食同源植物,对薇菜最早的开发源于日本,20世纪80年代,我国学者对薇菜进行研究[4],内容多为生态学、培育学和初级加工工艺学,对薇菜高值化及深加工研究甚少。薇菜中富含黄酮类物质,李凤霞[5]等人通过醇提法制备提取液中薇菜总黄酮含量为15.99%。黄酮是一类具有多种生物活性的物质[6],目前黄酮类物质的制备有传统的浸提回流法[7]、生物酶法[8]、超声波辅助提取法[9]和微波辅助提取法[10]等,单一方法提取存在一定局限性,耗能高、时间久、提取不完全,多种方法联合提取可以更高效、省时的提取出原料中黄酮类化合物。
本研究采用减压-超声波辅助溶剂法提取薇菜黄酮,减压方法是通过真空泵抽取容器内的空气使提取物的气压维持在(0.08 MPa~-0.1 MPa)的范围内的方法。减压条件下气压降低,容器内的气体变稀薄,溶剂分子之间的距离变大,打破溶剂之间分子链的能量随之减少,从而使溶剂的沸点降低,同时通过超声波的空化作用,分子之间的加速度加大了对分子链和细胞壁的作用,使得提取物可以有效流出。通过响应面法对其提取工艺条件进行了优化,并且将提取的黄酮化合物与常压条件下提取物的抗氧化活性进行对比分析,为薇菜深加工技术推广提供参考。
1 材料与方法
1.1 材料与试剂
薇菜:采自吉林长白山。
亚硝酸钠、硝酸铝、氢氧化钠、铁氰化钾、三氯化铁、三氯乙酸均为分析纯;芦丁,纯度≥98%,Solarbio;DPPH,Sigma;ABTS,Sigma。
1.2 仪器与设备
KQ-300DE数控超声波清洗器,昆山市超声仪器有限公司;SHB-IIIG循环水式多用真空泵,郑州长城科工贸有限公司;ME204分析天平,Mettler-Toledo;UV-1810型紫外分光光度计,上海普析通用。
1.3 方法
1.3.1 薇菜原料的预处理
将干制薇菜原料置于 40 ℃烘箱中烘干至残余水分含量小于3%,以超高速粉碎机粉碎过筛60目,按照料液比1:10加入石油醚,连续搅拌2 h脱脂脱色,挥干溶剂后备用。
1.3.2 标准曲线的绘制
采用 NaNO2-Al(NO3)3-NaOH 比色法测定[11]。将芦丁标准品干燥至恒重后,准确称取0.0140 g定容于50 mL容量瓶中,得浓度0.28 mg/mL的芦丁标准溶液。准确吸取芦丁标准溶液0.0、0.2、0.3、0.4、0.5、0.6 mL于25 mL容量瓶中,加入5% NaNO2溶液0.75 mL,摇匀,放置6 min再加入10%的Al(NO3)3溶液0.75 mL,摇匀,放置6 min后再加入4% NaOH溶液10 mL,70%乙醇定容,摇匀,静置10~15 min后于510 nm处测定吸光度A,以芦丁浓度X(mg/mL)对吸光度Y进行线性回归,得回归方程y=0.4367x-0.0006,R2=0.9996。
1.3.3 薇菜中黄酮类化合物提取量的测定
以芦丁为对照品,采用UV法测定总黄酮含量。取一定体积的黄酮提取样液,按1.3.2操作,加75%乙醇定容至25 mL,在波长510 nm处测定其吸光度。黄酮提取液中的黄酮含量以每g样品中芦丁当量计,按照公式(1)计算黄酮提取量。
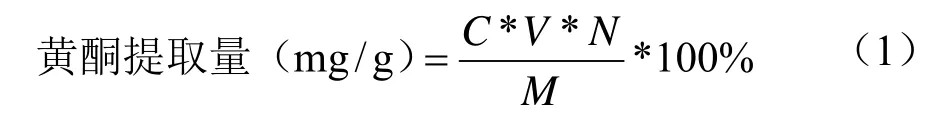
式中:C表示测定液总黄酮含量(mg/mL);N表示稀释倍数;V表示为样品体积(mL);M表示样品质量(g)。
1.3.4 薇菜黄酮提取单因素试验
试验时为减少在抽滤过程中提取溶剂乙醇体积分数的变化,需将真空泵与抽滤瓶连接管替换成软质橡胶管,抽滤时橡胶管迅速变形闭合同时用夹子夹住橡胶管即可有效减少提取液的损失又可保证提取瓶内气压稳定。此外,将样品和提取液装入抽滤瓶后,应做好详细刻度标记,并每隔5 min观察提取液损失情况并及时补充,最大限度减少乙醇体积分数受真空条件的影响。通过对抽滤瓶密封程度的改变来控制减压压力范围。
准确称取烘干至恒重的薇菜粉末1.00 g,分别研究料液比(1:40、1:50、1:60、1:70、1:80),乙醇体积分数(30%、40%、50%、60%、70%),超声功率(180、210、240、270、300 W),提取压力(0.00~0.02、0.02~0.04、0.04~0.06、0.06~0.08、0.08~-0.1 MPa),提取温度(40、50、60、70、80 ℃),提取时间(20、30、40、50、60 min)对薇菜黄酮提取量的影响。
1.3.5 提取工艺的响应面试验设计
在单因素试验的基础上,通过Plackett-Burman试验选取对黄酮提取量影响显著的因素(p<0.05),非显著条件选择单因素最优条件,采用中心组合Box-Benhnken Design(BBD)设计试验进行响应面优化减压-超声波辅助醇法提取薇菜黄酮工艺。
1.3.6 薇菜黄酮DPPH·自由基清除能力的对比
参照吕英华等[12]人的方法稍作修改,取不同梯度浓度稀释样品2 mL和1 mmoL/L DPPH·2 mL,加入同一试管中,混匀后室温下避光反应6 min,在515 nm下测定吸光值 Ai,对照组 Aj以等体积蒸馏水代替DPPH·溶液,空白组A0以等体积的蒸馏水代替样品溶液,并以等体积蒸馏水空白调零,清除率按公式2计算,并以Vc为阳性对照,平行测定3次。

式中:Ai表示2 mL样品+2 mL DPPH;Aj表示2 mL样品+2 mL蒸馏水;A0表示2 mL蒸馏水+2 mL DPPH。
1.3.7 薇菜黄酮ABTS+·自由基清除能力对比
ABTS+·的测定方法参考白海娜等[13]人方法稍作修改,取不同梯度浓度稀释样品1.5 mL和ABTS+·1.5 mL,加入同一试管中,混匀后室温下避光反应6 min,在734 nm下测定吸光值Ai,对照Aj以等体积蒸馏水代替ABTS+·溶液,空白组A0以等体积的蒸馏水代替样品溶液,并以等体积蒸馏水空白调零,清除率按式3计算,并以Vc为阳性对照,平行测定3次。
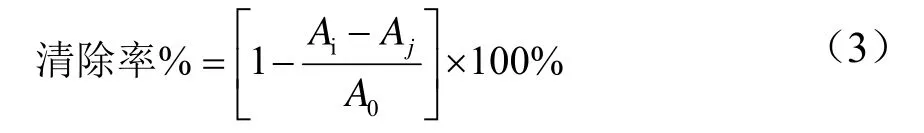
式中:Ai表示 1.5 mL 样品+1.5 mL ABTS+·;Aj表示 1.5 mL样品+1.5 mL蒸馏水;A0表示1.5 mL蒸馏水+1.5 mL ABTS+·。
1.3.8 薇菜黄酮总还原力能力的对比
总还原力的方法参考萨茹丽[14]等人的方法,并稍作修改,考察减压-超声法提取的薇菜黄酮对总还原能力的影响。在试管中分别加入2.5 mL pH为6.6的PBS溶液,再加入0.01 g/mL的铁氰化钾溶液1 mL混匀后加入薇菜总黄酮1 mL,充分摇匀50 ℃水浴静置20 min,待冷却后迅速加入10%三氯乙酸溶液2.5 mL混匀,吸取2 mL于另一试管中,加入0.1 g/mL的三氯化铁溶液1 mL混匀,静置10 min后于700 nm处检测吸光值。
1.4 数据处理
本文绘图软件使用OriginPro 8.6,Plackett-Burman和BBD试验设计使用Design-Expert 8.0.6,所有实验数据均重复3次,所得数据标准误差及其单因素方差显著行分析(LSD)、IC50计算均使用SPSS 19.0。
2 结果与讨论
2.1 减压-超声波辅助醇法提取薇菜总黄酮的单因素试验结果
2.1.1 料液比对薇菜总黄酮提取量的影响

图1 料液比对薇菜总黄酮提取量的影响Fig.1 Effects of solid-liquid ratio on the yield of total flavonoids extracted from Osmunda japonica Thunb
在提取温度50 ℃,乙醇体积分数50%,提取时间30 min,超声功率为150 W,提取压力为0.08~-0.1 MPa的条件下,考察不同液料比对薇菜黄酮提取量的影响。由图1可知,料液比在1:40~1:60的范围内,溶剂量增加对薇菜黄酮提取量有明显提高,当液料比为1:60时,薇菜黄酮提取量达到最大71.93 mg/g,当料液比在 1:60~1:80的范围内时,料液比与溶剂成负相关,此现象表明薇菜黄酮类物质已不随溶剂的增加而溶出。且液料比过大,成本增加,因此液料比选择在1:50~1:70范围内,进行响应面优化试验。
2.1.2 乙醇体积分数对薇菜总黄酮提取量影响
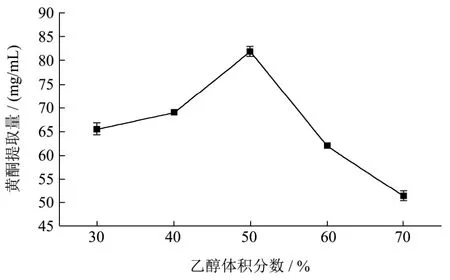
图2 乙醇体积分数对薇菜总黄酮提取量的影响Fig.2 Effects of volume fraction of ethanol on the yield of total flavonoids extracted from Osmunda japonica Thunb
在提取温度50 ℃,料液比1:60,提取时间30 min,超声功率为150 W,提取压力为0.08~-0.1 MPa的条件下,考察不同乙醇体积分数比对薇菜黄酮提取量的影响。由图2可知,乙醇体积分数在30%~50%范围内,乙醇体积分数与黄酮提取量成正相关,当乙醇浓度50%黄酮提取量达到最大81.91 mg/g,当乙醇体积分数超过50%时,乙醇浓度与黄酮提取量成负相关。溶液提取根据相似相溶的原则,浓度过高过低都不利于提取物的溶出,因此最适乙醇体积分数选择40%~60%范围,进行响应面优化。
2.1.3 超声功率对薇菜总黄酮提取量的影响

图3 超声功率对薇菜总黄酮提取量的影响Fig.3 Effects of ultrasonic power on the yield of total flavonoids extracted from Osmunda japonica Thunb
在提取温度50 ℃,料液比1:60,提取时间30 min,乙醇体积分数50%,压力为0.08~-0.1 MPa的条件下,考察不同超声功率对薇菜黄酮提取量的影响。
由图3可知,薇菜黄酮提取量随功率增加而持续增长,当超声功率达到300 W时,黄酮提取量达到最大值90.04 mg/g,此现象说明,超声功率越高,热效应、空穴效应及机械效应相应增加,共同促进了分子间运动相互作用的程度,有利于黄酮类化合物的溶出。超声波清洗器最大工作功率为300 W,选择超声功率300 W为黄酮最佳提取条件。
2.1.4 超声温度对薇菜总黄酮提取量的影响

图4 超声温度对薇菜总黄酮提取量的影响Fig.4 Effect of ultrasonic temperature on the yield of Osmunda japonica Thunb
在乙醇体积分数50%,液料比1:60,提取时间30 min,超声功率为300 W,气压为0.08~-0.1 MPa的条件下,考察不同的超声温度对薇菜黄酮提取量的影响。
由图4可知,超声温度在40~70 ℃范围内,超声温度与黄酮提取量成正比,当超声温度70 ℃黄酮提取量达到最大104.2 mg/g,当超声温度超过70 ℃时,薇菜黄酮提取量开始降低,此现象说明,温度高会加速分子间的运动,增加黄酮的提取量。
2.1.5 减压对薇菜黄酮提取量的影响

图5 压强对薇菜总黄酮提取量的影响Fig.5 Effects of pressure on the yield of total flavonoids extracted from Osmunda japonica Thunb
在乙醇体积分数50%,料液比1:60,提取时间30 min,超声功率为300 W,超声温度70 ℃,考察不同压强对薇菜黄酮提取量的影响。由图5可知,随着提取压强的逐渐降低,黄酮提取量不断提高,当压强在0.00~0.02 MPa接近常压时,黄酮提取量为84.19 mg/g,而压强降至0.08~-0.1 MPa接近真空时,黄酮提取量达到最大104.2 mg/g。减压比常压条件下黄酮提取量增加20.01 mg/mL。此现象说明:相同温度条件下,减压处理比常压更有利于黄酮类物质的溶出,低压时提取容器内空气稀薄,提取溶剂内的提取物受到的外力减小,分子链变大,需要打破分子链的能量降低,因此,相同条件下低压强提取较常压提取效率更高。
2.1.6 超声时间对薇菜总黄酮提取量的影响
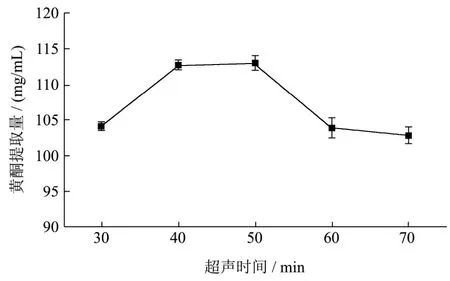
图6 超声时间对薇菜总黄酮提取量的影响Fig.6 Effects of ultrasonic time on the yield of total flavonoids extracted from Osmunda japonica Thunb
在乙醇体积分数 50%,料液比 1:60,超声温度70 ℃,超声功率为300 W,提取压力为0.08~-0.1 MPa的条件下,考察超声时间对薇菜黄酮提取量的影响。
由图6可知,超声时间在30~50 min范围内,超声温度与黄酮提取量成正比,当超声时间50 min黄酮提取量达到最大113.05 mg/g,当超声时间超过50 min时,薇菜黄酮提取量开始降低,此现象说明,超声时间越长,提取物提取越充分;但时间过长对黄酮类物质活性会起到破坏作用,且提取时间过长在生产实践时会造成能源浪费,因此最佳提取时间为50 min。
2.2 减压-超声波辅助醇法提取薇菜总黄酮的响应面优化试验结果
通过Plackett-Burman试验对6组单因素数据行进显著性分析,得到方程如下:
黄酮提取量=91.68+3.25A+3.49B-1.71C+2.05D-0.98E-1.31F。
计算结果显示,在6个主效应中,料液比、乙醇体积分数、超声温度是显著影响因素(p<0.05),显著性顺序为乙醇体积分数(B)>料液比(A)>超声温度(D),三因素与响应值均呈正相关,而其它因素影响不显著。根据PB结果,按照3因素3水平设计响应面试验。

表1 试验因素与水平设计Table 1 Experimental factors and levels design
2.3 响应面法优化试验结果
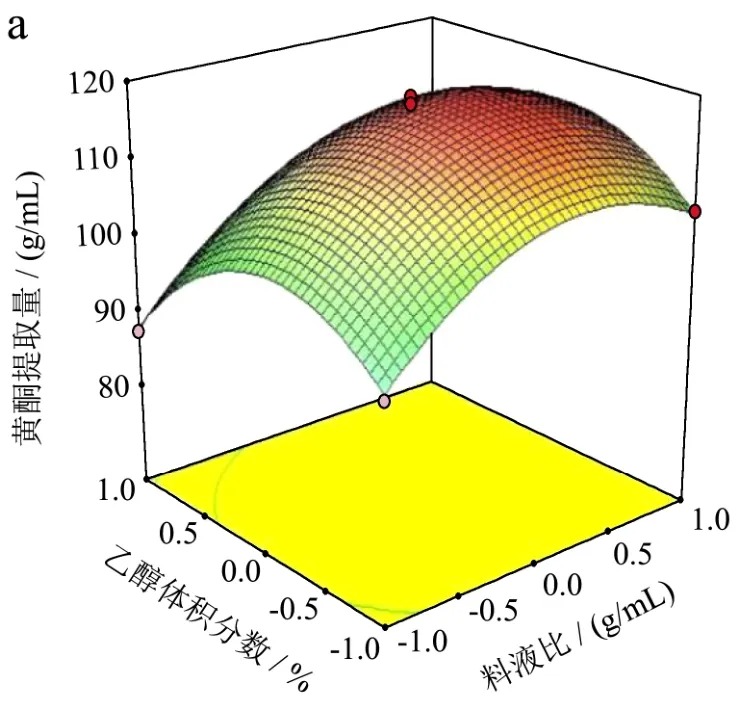

图7 乙醇体积分数和料液比对黄酮提取量交互影响的响应面图和等高线图Fig.7 Contour plot and response surface diagram of effects of the interaction between the volume fraction of ethanol and solid-liquid ratio on the yield of flavonoids
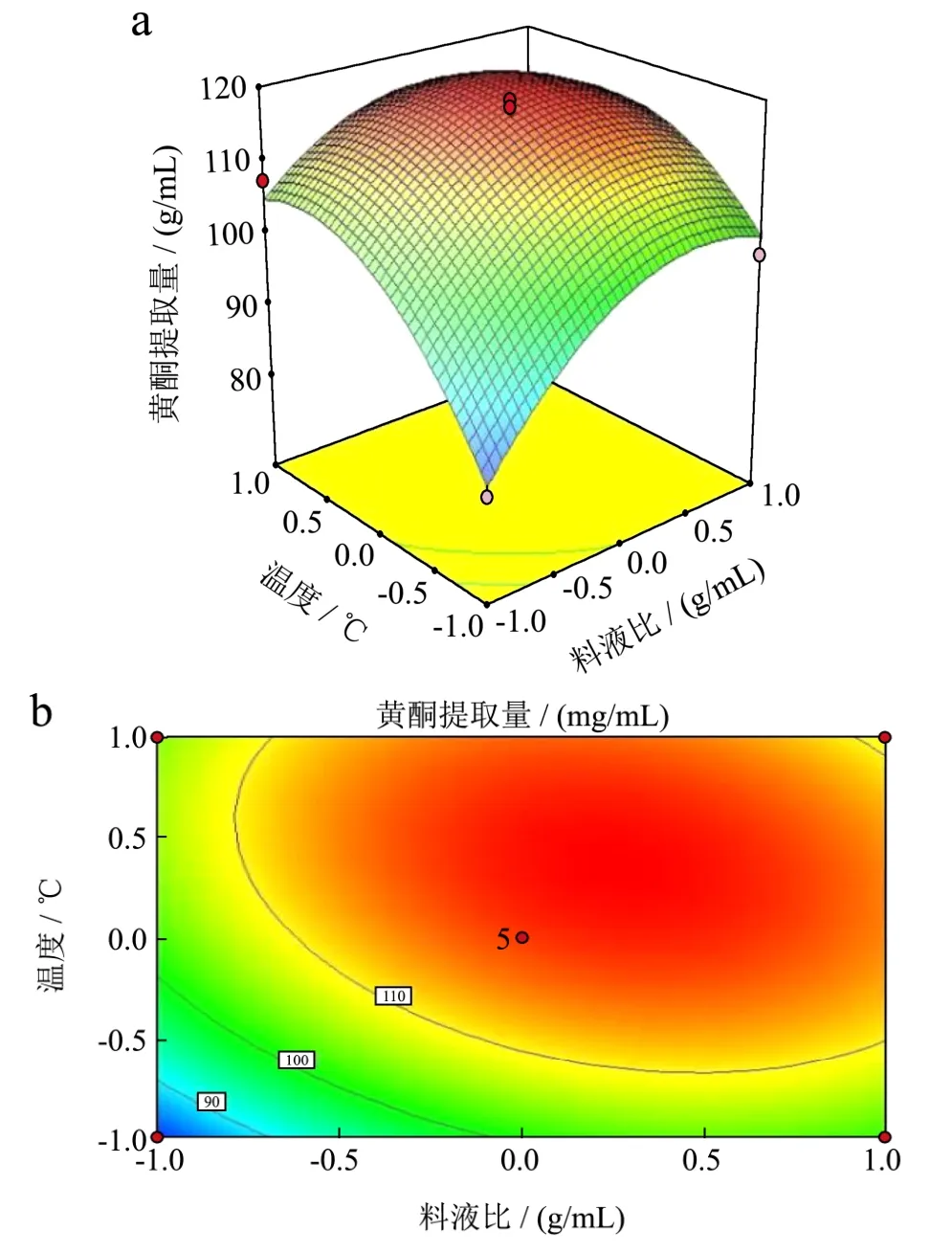
图8 超声温度和料液比对黄酮提取量交互影响的响应面图和等高线图Fig.8 Contour plot and response surface diagram of effects of the interaction between ultrasonic temperature and solid-liquid ratio on the yield of flavonoids
通过对图7~图9响应面和等高线的观察分析,可直观的得出料液比(A)、乙醇体积分数(B)和超声温度(C)之间的交互作用对薇菜黄酮提取量的影响,当等高线呈马鞍形或椭圆形时,交互作用显著;当等高线呈圆形时,则表示交互因素不显著[15]。
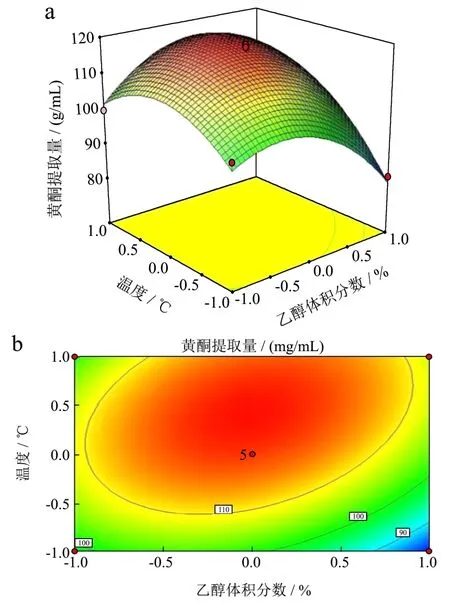
图9 超声温度和乙醇体积分数对黄酮提取量交互影响的响应面图和等高线图Fig.9 Contour plot and response surface diagram of effects of the interaction between the ultrasonic temperature and volume fraction of ethanol on the yield of flavonoids
由图7可知,等高线呈较为明显的圆形,说明乙醇体积分数和料液比之间的交互作用不显著,与方差分析结果相符。由图8可知,超声温度的变化曲面和料液比的变化曲面较陡峭,说明这两个因素对薇菜黄酮提取量影响均较显著,温度比料液比的变化坡面陡峭,说明温度比料液比对薇菜总黄酮提取量的影响更为显著。与方差分析结果相符。由图9可知,等高线呈明显的椭圆形,说明温度和乙醇体积分数之间的交互作用较为显著,对薇菜总黄酮的提取量影响较大。
在单因素的基础上进行3因素3水平的试验,结果如表2所示,数据的方差分析见表3。
通过Design Expert.V8.0.6软件对表2中薇菜黄酮提取量进行优化处理,进行二次多项式回归拟合,得到薇菜黄酮提取量对料液比(A)、乙醇体积分数(B)、提取温度(C)的回归模型方程为:
Y=116.89+5.82A-2.77B+7.36C+1.05AB-3.86AC+5.83BC-8.66A2-10.83B2-8.87C2
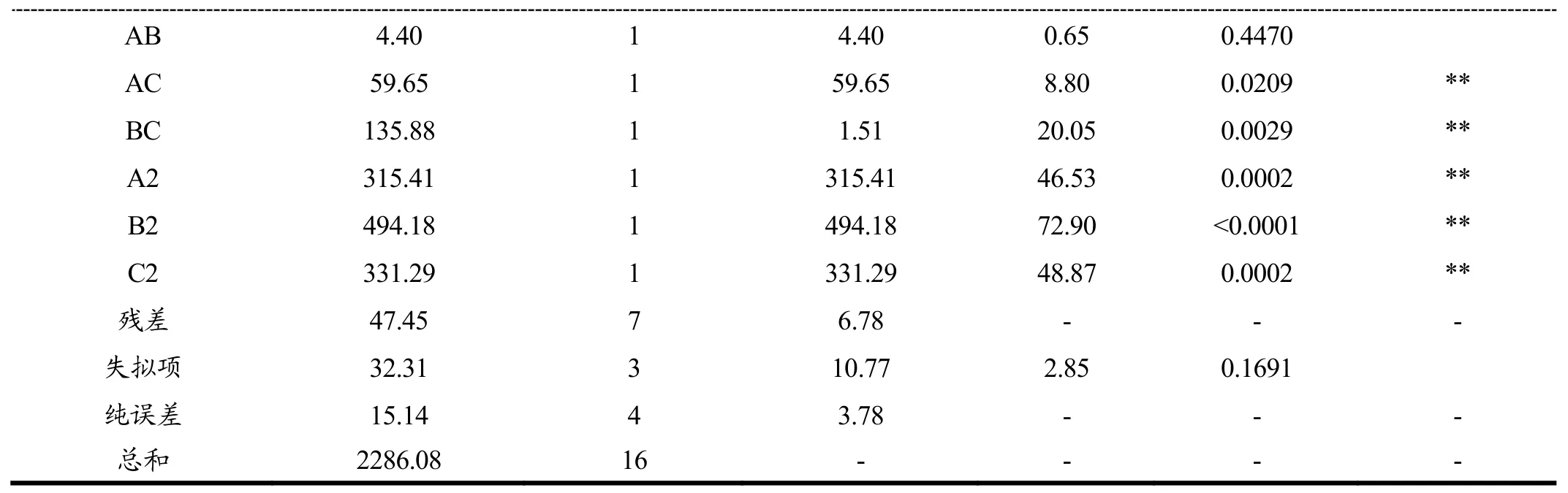
从表3可看出,该模型p<0.01,说明该模型极显著;失拟项不显著 p>0.05,校正决定系数(R2Adj):0.9526;R2:97.29%,说明拟合度良好,试验误差小,方程的显著性及可靠性很高,能够反映响应值的变化。通过此回归模型对减压-超声波辅助醇法提取薇菜总黄酮的工艺参数进行分析和预测。通过对回归模型显著性分析可知,A、C、AC、BC对黄酮提取量有极显著的影响(p<0.01),B对黄酮提取量具有显著影响(p<0.05),AB影响不显著。由F值可知,各因素对薇菜黄酮提取量影响的顺序为:超声时间(C)>料液比(A)>乙醇体积分数(B)。

表2 响应面法试验设计结果Table 2 Response surface experimental design and results

表3 方差分析结果Table 3 Analysis of variance for quadric regression model
注:决定系数R2=0.9729;调整系数R2Adj=0.9526;*表示差异显著,p<0.05;**表示差异极其显著,p<0.01。
2.4 最佳条件的确定和回归模型的验证
通过响应面法得到减压-超声辅助超声波提取薇菜总黄酮最佳工艺条件为:液料比 1:60(g/mL)、乙醇体积分数 49.97%、超声温度 70.19 ℃,提取压力0.08~-0.1 MPa、超声功率300 W、超声时间50 min此条件下提取黄酮的最佳工艺(118.924±1.950)mg/g。为便于产业化控制,调整最佳工艺为料液比:1:60(g/mL)、乙醇体积分数50 %、超声温度为70 ℃,在此条件下进行验证试验,得到的黄酮含量为(117.133±1.120)mg/g,与理论值接近。
2.5 薇菜总黄酮的体外抗氧化活性对比分析
2.5.1 DPPH·清除率比较分析

图10 两种方法提取薇菜总黄酮DPPH自由基清除率差异Fig.10 Comparison of DPPH· radical scavenging capacity of flavonoids extracted from Osmunda japonica Thunb by two different methods
由图10可知,常压超声和减压-超声提取薇菜总黄酮与水溶Vc组进行对照,两种方法对DPPH的清除能力均高于 Vc,且样品质量浓度与 DPPH·的清除率成正相关,两种样品及Vc对DPPH·清除率的IC50分别为:0.117 mg/mL(减压-超声)、0.119 mg/mL(常压超声)、0.121 mg/mL(水溶Vc)。通过比较分析,两种方法提取的样品对DPPH自由基的清除效果差异均不显著(p>0.05)[15]。
2.5.2 ABTS+·清除率比较分析

图11 两种方法提取薇菜总黄酮ABTS+·清除率差异Fig.11 Comparison of ABTS+· radical scavenging capacity of flavonoids extracted from Osmunda japonica Thunb by two different methods
由图11可知当样品浓度范围在0.05~0.2 mg/mL之间时,减压-超声提取的薇菜黄酮对ABTS+·消除率增强。两种样品及Vc对ABTS+·清除率的IC50分别为[16]:0.072 mg/mL(减压-超声)、0.076 mg/mL(常压超声)、0.1 mg/mL(水溶Vc)。两种提取方法的薇菜黄酮样液与Vc通过方差分析进行两两比较,两种提取物对自由基的清除率显著高于水溶 Vc(p<0.05),但两种方法的黄酮提取液对自由基的清除率差异不显著(p>0.05)。说明常压超声和减压-超声提取的薇菜总黄酮均对ABTS+·有较强的清除效果。
2.5.3 总还原能力比较分析
通过图12可知,随各样品浓度逐渐增加,总还原能力也不断增强。两种方法提取的样液的还原能力均高于水溶Vc,通过单因素方差分析进行两两比较,两种提取方法黄酮提取液的总还原能力差距不显著(p>0.05)。
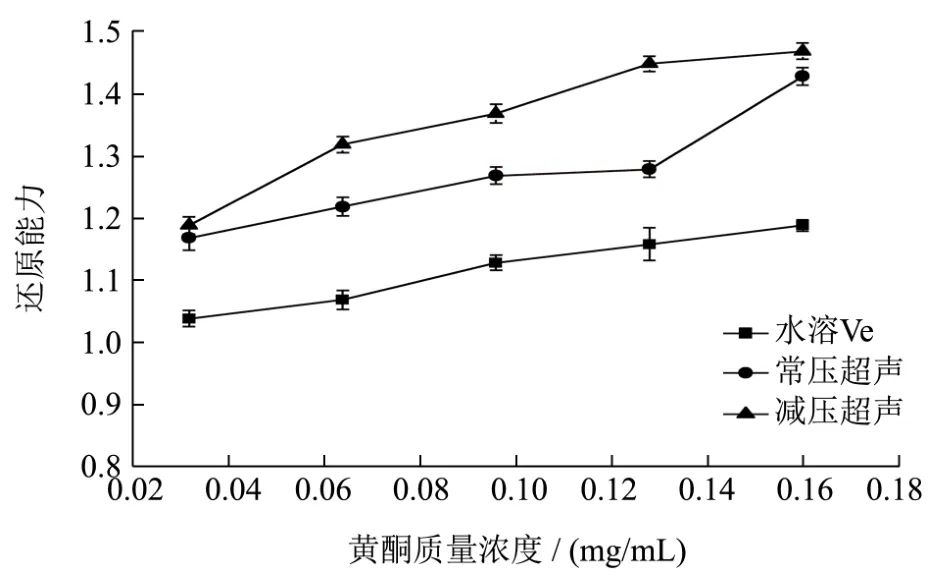
图12 两种方法提取薇菜总还原力差异Fig.12 Comparison of total reducing power capacity of flavonoids extracted from Osmunda japonica Thunb by two different methods
3 结论
3.1 采用减压-超声波辅助乙醇提取薇菜黄酮的最佳条件为:液料比1:60(g/mL)、乙醇体积分数49.97%、超声温度70.19 ℃,提取压力0.08~-0.1 MPa、超声功率300 W、超声时间50 min此条件下提取黄酮的最佳工艺(118.924±1.950)mg/g。以水溶 Vc为对照,通过对比常压超声和减压-超声提取液的体外抗氧化活性可知,两种提取方法与Vc对DPPH自由基的清除能力从大到小:减压-超声>常压-超声>水溶Vc,单因素方差分析两两比较结果显示,两种提取方法的样品对DPPH自由基的清除效果差异不显著(p>0.05);对ABTS自由基的清除能力从大到小:减压-超声>常压-超声>水溶Vc,两种方法的黄酮提取液清除率差异不显著(p>0.05),与Vc相比差异显著(p<0.05);两种提取方法的总还原能力差异均不显著(p>0.05)。
3.2 综上所述,通过减压-超声法辅助乙醇提取薇菜黄酮,使薇菜黄酮提取量得到显著(p<0.05)提升,也很好地保留了黄酮的抗氧化活性。相比常压超声辅助乙醇提取法,减压-超声工艺通过降低提取容器内压强接近至真空状态,减小提取液分子间相互压力,从而降低提取所需能量,缩短了超声提取时间,降低了提取温度,对降低产业化成本有积极指导作用。
[1]黄祥丰,李道新,徐慎东,等.我国森林薇菜研究进展[J].林业科技通讯,2015,10:75-77 HUANG Xiang-feng, LI Dao-xin, XU Shen-dong, et al.Research progress of forest osmunda japonica thunb in China[J]. Journal of Forestry Science and Technology, 2015, 10:75-77
[2]王谋强,励启腾.薇菜干的营养品质分析[J].植物资源与环境,1995,4(2):63-64 WANG Mou-qiang, LI Qi-teng. Analysis on nutritional quality of osmunda japonica thunb dry [J]. Journal of Plant Resources and Environment, 1995, 4(2):63-64
[3]조현우, 김민석, 이기호, et al. Isolation and quantitative analysis of cinnamtannin b-1 from osmunda japonica thunb[J]. Korean Journal of Pharmacognosy, 2016, 47(3):232-236
[4]赵莉,杨文钰.蕨类植物的活性成分研究进展[J].中药材,2004,27(6):452-456 ZHAO Li, YANG Wen-yu. Research progress on the active components of pteridophytes [J]. Chinese Herbal Medicines,2004, 27(6):452-456
[5]李凤霞,王青,张钟,等.薇菜黄酮类化合物的提取及抗氧化研究[J].包装与食品机械,2008,26(1):7-11 LI Feng-xia, WANG Qing, ZHANG Zhong, et al. Study on extraction and antioxidation of flavonoids from osmuda japomca thamb [J]. Packaging and Food Machinery, 2008,26(1):7-11
[6]LUO Jiaqiang, CAI Weixi. WU Tong, et al. Phytochemical distribution in in hull and cotyledon of adzuki bean (vigna angularis L.) and mung bean (vigna angularis L.), and their contribution to antioxidant. anti-inflammatory and anti-diabetic activities [J]. Food Chemistry, 2016, 201:350-360
[7]NIE W, LUO J G, WANG X B, et al. An insight into enrichment and separation of oleanane-type triterpenoid saponins by various chromato-graphic materials [J].Separation and Purification Technology, 2009, 65(3):93-95
[8]Jitendra K S, Patel A K, Adsul M, et al. Cellulase adsorption on lignin:a roadblock for economic hydrolysis of biomass [J].Renewable Energy, 2016, 98:29-42
[9]ZHU Caiping, ZHAI Xichuan, LI Linqiang, et al. Response surface of ultrasound-assisted polysaccharides extraction from pomegranate peel [J]. Food Chemistry, 2015, 177:139-146
[10]Pare J R J, Belanger J M R, StalTord S S.Microwave-Assisted Process (MAPTM)a:a new tool for the analytical laboratory [J]. Trends in Analytical Chemistry,1994, 13(4):176-1R4
[11]萨茹丽.沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D].呼和浩特:内蒙古农业大学,2014 SA Ru-li. Study on extraction technology, structure identification and related biological activity of flavonoids from onions [D]. Hohhot:Inner Mongolia Agricultural University, 2014
[12]吕英华,苏平,那宇,等.桑椹色素体外抗氧化能力研究[J].浙江大学学报(农业与生命科学版),2007,33(1):102-107 LV Ying-hua, SU Ping, NA Yu, et al. Study on antioxidant capacity of mulberry pigment [J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2007, 33(1):102-107
[13]白海娜,王振宇,张华.多酚类化合物与黑木耳多糖协同抗氧化作用研究[C]//中国食品科学技术学会第九届年会.国黑龙江哈尔滨. 2012 BAI Hai-na, WANG Zhen-yu, ZHANG Hua. Synergistic antioxidation of polyphenols and polysaccharides from black fungus [C]// The 9th Annual Meeting of China Food Science and Technology Society. Harbin Heilongjiang China. 2012
[14]萨茹丽,木其尔,王翠芳,等.沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用[J].食品科学,2014,35(24):1-8 SA Ru-Li, MU Qi-er, WANG Cui-fang, et al. Total flavonoids from allium mongolicum regel: optimization of extraction process and antioxidant and antibacterial effects in vitro [J]. Food Science, 2014, 35(24): 1-8
[15]李新原,李斌,颜廷才,等.超高压与超声波对蓝靛果多酚提取及抗氧化活性的影响[J].食品科学,2017,38(2):271-277 LI Xin-yuan, LI Bin, YAN Ting-cai, et al. Comparative effects of ultra-high pressure and ultrasonic treatment on the extraction and antioxidant activity of polyphenols from lonicera caerulea fruits [J]. Food Science, 2017, 38(2):271-277
[16]J L Li, X Y Liu, J T Xie, et al. A Comparison of different estimation methods for fungicide EC50and EC95values [J].Journal of Phytopathology, 2015, 163(4): 239-244

