呋喃西林代谢物半抗原的制备及其免疫检测中的应用
李斌,俞思明,胡睿,于淑娟
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广州润坤生物科技有限公司,广东广州 510800)(3.暨南大学生物材料广东高校重点实验室,生物医学工程系,广东广州 510632)
呋喃西林属于硝基呋喃类药物,近年来频繁用于水产类养殖和禽类养殖[12]。硝基呋喃类药物进入动物体内后,快速代谢为氨基脲(Semicarbazide,SEM),具有致畸、致突变和致癌作用[3]。欧美和我国相继公布了禁止使用硝基呋喃类药物的法令,并明确了其代谢物的最高残留量为0.25 μg/L[4]。
现阶段有关呋喃西林代谢物残留的检测技术主要有:高效液相(HPLC)、液相质谱(LC-Ms或LC-Ms/Ms)、高效气相(GC)、气相质谱(GC-Ms)和免疫分析技术。前四种技术主要是通过 SEM 与邻硝基苯甲醛过夜衍生后,用仪器测定其衍生物(2-NPSEM)[5~7]。色谱技术的样本处理较繁琐费时,需昂贵的仪器设备,且需要专业分析人员操作,不适合大批量的样本筛查,无法满足现有市场的需求。酶联免疫分析技术作为一种快速、高灵敏度、高特异性的检测方法,正广泛应用于有毒、有害药物的残留检测。
免疫分析技术的关键是生物原材料(抗原、抗体)的制备,其性能决定了快检产品的质量。由于呋喃西林代谢物(SEM)分子量较小,只具有反应原性,免疫时必须与大分子载体偶联,制备成人工合成抗原后才能获得免疫原性,从而刺激动物机体产生特异性抗体[8]。Cooper等[9]用羧基苯甲醛制备了SEM衍生物的多克隆抗体,并建立了检测SEM残留的ELISA法,在鸡肉中的检测限为0.25 μg/L。李军平[10]用3-羧基苯甲醛与 SEM 衍生制备了半抗原,通过偶联蛋白后免疫小鼠制备了单克隆抗体,其IC50值为31.25 μg/L。任海涛[11]等将4-(4-醛基苯氧基)-丁酸和4-(4-醛基苯氧基)-乙酸与SEM衍生合成半抗原,通过偶联蛋白后免疫小鼠制备了单克隆抗体,其 IC50值为12.37 μg/L。Huang Deng Yu等[12]用4-羧基苯甲醛与SEM衍生制备了半抗原,通过偶联蛋白后免疫小鼠制备了单克隆抗体,其IC50值为0.54 μg/L。现有文献报道合成的SEM半抗原结构都为传统的4-CP或3-CP衍生物结构,共同点是没有保留待测目标物硝基端的优势基团,导致制备获得的抗体存在特异性差、亲和力低。
本文重点解决现有 SEM 半抗原结构不含硝基端优势基团的不足,提供一种新的呋喃西林代谢物SEM衍生化半抗原及人工抗原的制备方法,获得具有高灵敏度和特异性的单克隆抗体,用于 ciELISA法检测2-NPSEM的研究。
1 材料与方法
1.1 材料与主要仪器
牛血清蛋白 BSA、卵清蛋白 OVA、弗氏完全与不完全佐剂,美国sigma公司;HRP标记的羊抗鼠IgG抗体,上海杰一生物技术有限公司;2-NPSEM、氢氧化锂、呋喃西林代谢物、吐温-20,上海阿拉丁试剂公司;分析级 Na2CO3、NaHCO3、KH2PO4、Na2HPO4·12H2O、KCl、浓硫酸和柠檬酸等,广州化学试剂有限公司;HRP显色用的 3,3,5,5-四甲基联苯胺(TMB),上海安耐吉化学有限公司;实验用水均为Milipore超纯水;SPF级Balb/c纯种雌性小鼠,广东省医学实验动物中心。
酶联免疫测定(ELISA)用溶液:磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4)、碳酸盐缓冲液(CB,0.05 mol/L,pH 9.6)、洗涤液(PBST,0.01 mol/L,pH 7.4,PBS-0.05 mol/L 吐温20)、封闭液(1% BSA-PBS)、3,3,5,5-四甲基联苯胺(TMB)底物液(TMB-过氧化氢脲溶液)、终止液(10% H2SO4溶液)。
Multiskan MK3酶标仪、Wellwashi MK2洗板机,美国Thermo公司;高速冷冻离心机、恒温培养箱,上海一恒科学仪器有限公司;恒温加热磁力搅拌器、磁力搅拌器、旋转蒸发仪,巩义予华仪器有限责任公司。
1.2 半抗原合成
(1)将2.0 g(7.1 mmol)的化合物Ⅰ溶于10 mL乙醇中,通过6 mol/L的氢氧化锂溶液将化合物Ⅰ的乙醇溶液调至pH值为10~12,室温反应15~26 h,加入40 mL纯化水,所得溶液通过1 M的稀盐酸调PH值至4~5,过滤,烘干得到1.1 g的化合物Ⅱ。1H NMR(600 MHz,CDCl3,TMS):δ 10.50(s,1H),8.20(d,1H),7.35(d,1H),7.15~7.19(dd,1H),4.23(t,2H),2.66(t,2H),2.26(m,2H)。ESI-MS:167 [M-CH2CH2CH2COOH-1],252 [M-1],288[M+2H2O-1],315 [2×167-H2O-1],505 [2M-1],537[2M+MeOH-1]。
(2)将0.5 g(即2.0 mmol)的化合物Ⅱ溶解于10 mL甲醇中,加入0.18 g(即2.4 mmol)的呋喃西林代谢物SEM,于60~70 ℃反应2 h,反应完毕,冷却至室温,过滤,得0.42 g的呋喃西林代谢物的半抗原。半抗原合成路线图如图1如示:

图1 半抗原的合成路线图(式Ⅲ为合成的半抗原)Fig.1 Synthetic route of SEM hapten (III was the synthesized hapten)
1.3 人工抗原合成
人工抗原采用活泼酯法制备,将式Ⅲ半抗原在碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)作用下与载体蛋白上的氨基偶联,合成示意图如图2所示:
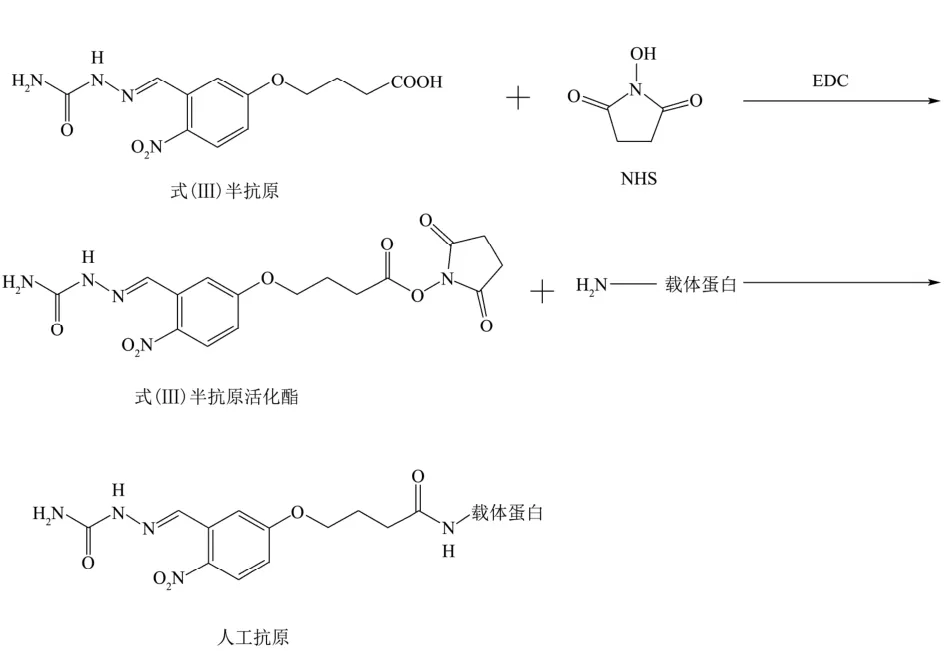
图2 人工抗原合成示意图Fig.2 Synthetic route of artificial antigen
本文所制备的人工抗原包括免疫原与包被原,两者的不同之处在于制备过程中偶联的载体蛋白种类不同,免疫原通过半抗原与牛血清蛋白(BSA)偶联制备(式(Ⅲ)-BSA),包被原通过半抗原与卵清蛋白(OVA)偶联制备(式(Ⅲ)-OVA)。具体合成步骤如下:
(1)取10.0 mg式Ⅲ半抗原,溶解于0.5 mL二甲基甲酰胺(DMF)中,搅拌充分后,加入 8.0 mg的碳二亚胺(EDC)和6.0 mg的N-羟基琥珀酰亚胺(NHS),室温下搅拌4 h,即可得到半抗原活化酯;
(2)称取70.9 mg BSA(或43.0 mg OVA)(式Ⅲ半抗原与BSA和OVA的摩尔比均控制在30:1),使其充分溶解在4 mL的浓度为0.01 mol/L的PBS溶液中,形成载体蛋白溶液,在搅拌下将半抗原活化酯逐滴缓慢滴加至载体蛋白溶液中,并在室温下搅拌24 h;
(3)步骤(2)制得的溶液用0.01 mol/L的PBS溶液室温透析3 d,每天换3次透析液,以除去未反应的小分子物质;
(4)分装,于4 ℃保存备用。
1.4 单克隆抗体的制备
将制备的免疫原式(Ⅲ)-BSA,与等体积弗氏佐剂乳化后,免疫 BALB/C小鼠。每只小鼠免疫剂量为50~100 μg,免疫间隔3周,免疫3次后,采小鼠尾部静脉血检测血清效价。如抗血清效价不达100000,需加强免疫,待抗体效价不再升高后,以100 μg免疫原进行皮下加强免疫,5 d后取小鼠的脾细胞与SP20细胞融合。融合后的细胞在HAT培养基中筛选,5 d后以完全培养基替换成 HAT培养基进行培养。用ciELISA对细胞上清进行检测,将检测结果为强阳性的孔内细胞进行有限稀释法克隆培养,经3次克隆培养检测后,均呈阳性的孔内细胞即为分泌单克隆抗体的杂交瘤细胞。将杂交瘤细胞放大培养后,接种至小鼠腹腔,产生含抗体的腹水。用辛酸-硫酸铵沉淀法纯化腹水,即可得到高纯度、高特异性的单克隆抗体。
1.5 单克隆抗体的效价及特异性测定
用pH 9.6的碳酸盐缓冲液作包被稀释液,将合成的免疫原式(Ⅲ)-OVA按预试0.5 μg/mL的浓度包被酶标板,将纯化好的单克隆抗体按 1:20000、1:40000、1:160000、1:320000、1:640000、1:1280000、1:2560000倍稀释,用ciELISA法测定单克隆抗体效价和特异性。选择效价高且抑制率好的抗体浓度,根椐方阵滴定法以450波长下的OD值在2.0左右的稀释浓度作为抗2-NPSEM单克隆抗体的工作浓度,将呋喃西林代谢物SEM 的衍生物标准品配制成浓度为 0、0.05、0.15、0.45、1.35和 4.05 μg/L的系列标准品溶液,建立ciELISA法标准曲线[13]。通过测定20个0 μg/L标准液,计算OD值的平均值和标准差,根据最低检测限公式Z=平均值-3标准差,在标准曲线上的Z值(即Y值)对应的浓度即为标准品最低检测限值[14]。
将 SEM 结构类似物呋喃它酮、呋喃唑酮和呋喃妥因代谢物的衍生物,按上述方法获得ciELISA标准曲线,计算其半抑制浓度 IC50值,并计算其与 SEM的交叉反应率。
2 结果
2.1 半抗原的结构鉴定
半抗原的核磁共振氢谱和质谱表征结果分别如图3(a)和图3(b)所示。核磁共振氢谱结果为:1H NMR(600 MHz,DMSO,TMS):δ 12.17(s,1H),10.61(s,1H),8.37(s,1H),8.03(d,1H),7.12(dd,1H),6.68(s,2H),4.21(s,2H),2.44(t,2H),2.03(m,2H)。质谱结果为ESI-MS:311 [M+1]。以上结果表明,本文设计的半抗原被成功合成,且半抗原结构中含有末端羧基,能够用于人工完全抗原合成。
2.2 人工抗原的结构鉴定
人工抗原利用紫外光谱法进行分析鉴定[15],紫外图谱如图4所示,其中半抗原、BSA和OVA的紫外图谱作为对照。从图4中可看出,BSA在280 nm处有特征吸收,式Ⅲ半抗原在265 nm处有强的特征吸收。式(Ⅲ)-BSA完全抗原在260 nm左右出现一个宽的吸收峰,相对于式Ⅲ半抗原吸收峰有所蓝移,且未见BSA蛋白的特征吸收,这是因为式Ⅲ半抗原与BSA发生共价偶联所致。同样的,式(Ⅲ)-OVA在265 nm处出现宽的吸收峰,且相对于式Ⅲ半抗原和OVA,吸收峰有所蓝移,说明式Ⅲ半抗原与 OVA成功偶联。综上所述,免疫原式(Ⅲ)-BSA和包被原式(Ⅲ)-OVA被成功合成。

图3 半抗原的核磁共振氢谱图(a)和质谱图(b)Fig.3 1H NMR spectrum (a) and mass spectrum of hapten (b)

图4 BSA、OVA、式Ⅲ半抗原以及免疫原式(Ⅲ)-BSA和包被原式(Ⅲ)-OVA的紫外图谱Fig.4 UV-Vis spectra of BSA, OVA, Ⅲ-hapten, immunogen SEM-BSA (Ⅲ)and coating antigen SEM-OVA(Ⅲ)
2.3 单克隆抗体效价检测
第三次免疫BALB/C小鼠后,结合细胞融合技术制备的单克隆抗体的效价如表1所示,结果表明包被原式(Ⅲ)-OVA对应的抗体效价为1:2560000。
2.4 单克隆抗体的灵敏度和特异性的ciELISA法检测结果

图5 SEM衍生物ciELISA法标准曲线Fig.5 Calibration curve of SEM derivates by ciELISA method
本文利用ciELISA法对制备的单克隆抗体的灵敏度和特异性进行了测定分析。在ciELISA法中,对不同SEM衍生物浓度的OD值以及B/B0(不同浓度的标准品测试孔OD值与含量为0的标准品测试孔OD值的比值)进行了测定,结果如表2所示。从表2中可看出,当呋喃西林代谢物SEM的衍生物含量为0.05 μg/L时,其B/B0值为73.44%,说明其检测OD与含0 μg/L浓度的呋喃西林代谢物SEM的衍生物测试孔OD值有明显差异。
通过表2数据,采用ELISA Calc软件进行四参数Logistic曲线拟合绘制标准曲线(图5),线性方程为:y=(A-D)/[1+(x/C)^B]+D,R2=0.9998,A=2.15892,B=0.64857,C=0.28492,D=-0.14724,x表示待测物浓度,y表示OD值,计算得到IC50值为0.23 μg/L,在0.05~4.05 μg/L呈线性关系。通过测定20个0 μg/L标准液,按公式Z=平均值-3标准差,计算出了Z值为1.6484,把Z值做为Y值代入标准曲线即可算出最低检测限为0.04 μg/L。

表1 抗2-NPSEM单克隆抗体效价Table 1 Anti 2-NPSEM monoclonal antibody titer

表2 ciELISA法测试不同浓度SEM衍生物标准品的OD值及B/B0值Table 2 OD and B/B0 value of different concentrations of SEM derivate standards by ciELISA method
以相同方法对抗血清的交叉反应性进行测定,对结构类似物NPAMOZ、NPAOZ和NPAHD的交叉反应率分别为0.03%、0.02%和0.26%,结果表明该抗血清对其他三种硝基呋喃代谢衍生物均无交叉反应,特异性良好。
3 讨论
3.1 免疫检测技术的关键是获得性能优良的人工合成抗原和抗体,而抗体的效价和特异性取决于人工合成抗原的结构和活性。现有文献报道的呋喃西林代谢物 SEM 抗原的常用方法是将其改造为具有 4-CP或3-CP衍生物结构的半抗原,然后偶联蛋白制备完全抗原。此种方法共同点是半抗原结构改造时没有保留待测目标物的优势基团硝基端,导致制备获得的抗体存在特异性差、亲和力低。如李军平[10]用3-羧基苯甲醛与 SEM 衍生制备了半抗原,通过偶联蛋白后免疫小鼠制备了单克隆抗体,其IC50值仅为31.25 μg/L。因此,探索一种新的合成方法,对喃西林代谢物SEM结构进行合理衍生化改造,保留其优势基团硝基端,对于获得高效价的抗体及建立高效的ciELISA法检测呋喃西林代谢物SEM极为关键。
3.2 本实验以呋喃西林代谢物 SEM 为模型,4-(3-醛基-4-硝基-苯氧基)-丁酸为衍生手臂,合成了一种新型SEM半抗原,偶联载体蛋白后,通过Balb/c免疫,成功制备了对2-NPSEM 有较好识别作用的单克隆抗体。本实验的半抗原与传统的4-CP或3-CP衍生化半抗原相比,具有明显优势。半抗原引入的手臂不仅具有活性基团,还完整保留了待测目标物的硝基端,使得半抗原与待测目标物的电子云密度一致,有效提高了小分子半抗原的免疫原性,提高了抗体质量。
[1]Vass M, Hruska K, Franek M. Nitrofuran antibiotics:a review on the application, prohibition and residual analysis[J]. Veterinarni Medicina, 2008, 53(9):469-500
[2]Samsonova J, Douglas A, Cooper K M, et al. The identification of potential alternative biomarkers of nitrofurazone abuse in animal derived food products [J]. Food and Chemical Toxicology 2008, 46(5):1548-54
[3]Jia Q, Yu S, Cheng N, et al. Stability of nitrofuran residues during honey processing and nitrofuran removal by macroporous adsorption resins [J]. Food Chemistry, 2014,162(6):110-6
[4]农业部公告 781-4-2006,动物源食品中硝基呋喃类代谢物残留量的测定[S]Announcement No.781-4-2006 of the Ministry of Agriculture,Determination of metabolite residues of furans in animal derived foods [S]
[5]张平安,张建威,乔明武,等.高效液相色谱-串联质谱法测定蜂蜜中硝基呋喃代谢物的研究[J].浙江农业科学,2010,1(3):611-614 ZHANG Ping-an, ZHANG Jian-wei, QIAO Ming-wu, et al.Determination of metabolites of nitrofuran antibiotics in honey by high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Zhejiang Agricultural Sciences, 2010, 1(3):611-614
[6]Pereira A, Pampana L, Donato J, et al. Analysis of nitrofuran metabolic residues in salt by liquid chromatography-tandem mass spectrometry [J]. Analytica Chimica Acta, 2004, 514:9-13
[7]Mottier P, Khong S-P, Gremaud E, et al. Quantitative determination of four nitrofuran metabolites in meat by isotope dilution liquid chromatography-electrospray ionization-tandem mass spectrometry [J]. Journal of Chromatography A, 2005, 1067:85-91
[8]潘孝成,祁克宗,孙国仁,等.兽药单克隆抗体研究进展[J].动物医学进展,2005,26(4):31-33 PAN Xiao-cheng, QI Ke-zong, SUN Guo-ren, et al. Progress on monoclonal antibodies of veterinary drug [J]. Progress in Veterinary Medicine, 2005, 26(4):31-33
[9]Cooper K M, Samsonova J V, Plumpton L, et al. Enzyme immunoassay for semicarbazide-The nitrofuran metabolite and food contaminant [J]. Analytica Chimica Acta, 2007, 592:64-71
[10]李军平.抗呋喃西林代谢物衍生物单克隆抗体的研制及其ELISA检测方法的建立[D].扬州:扬州大学,2008 LI Jun-ping. Development of Monoclonal antibody against derivant of nitrofural,s metablite and establishment of its ELISA detection [D]. Yangzhou:Yangzhou University, 2008
[11]任海涛,沈玉栋,徐振林,等.呋喃西林代谢物多克隆抗体制备及酶联免疫吸附分析方法[J].食品工业科技,2012,33(5):330-333 REN Hai-tao, SHEN Yu-dong, XU Zhen-lin, et al.Production and identification of polyclonal antibody detect nitrofurazone metabolite and development of enzyme-linked immunosorbent assay [J]. Science and Technology of Food Industry, 2012, 33(5):330-333
[12]Huang D, Gao L, Li Y, et al. Determination of nitrofurazone metabolite in animal-derived food by indirect competitive chemiluminescence enzyme immunoassay [J]. Journal of Food Safety and Quality, 2017, 8:402-10
[13]贾慧勤,丁焕中,刘晓云,等.呋喃唑酮代谢物人工抗原的合成及抗体的制备[J].中国兽药杂志,2013,47(6):20-23 JIA Hui-qin, DING Huan-zhong, LIU Xiao-yun, et al.Synthesis of artificial antigens and preparation of specific antisera against 3-amino-2-oxazolidinone, a metabolite of furazolidone [J]. Chinese Journal of Veterinary Drug, 2013,47(6):20-23
[14]杨利国,胡少昶,魏平化,等.酶免疫测定技术[M].南京:南京大学出版社,1988 YANG Li-guo, HU Shao-chang, WEI Ping-hua, et al.Enzyme immunoassay technology [M]. Nanjing:Nanjing University Press, 1988
[15]Ruwona T B, Johnson V J, Hettick J M, et al. Production,characterization and utility of a panel of monoclonal antibodies for the detection of toluene diisocyanate haptenated proteins [J]. Journal of Immunological Methods,2011, 373(1-2):127-35

