井冈山黑木耳多糖的制备及结构分析
孙永敢,鄢为唯,聂少平,胡婕伦
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
黑木耳(Aurcularia auricular)属真菌界、真菌门、子菌纲、木耳目、木耳科、木耳属[1,2],又称木耳、云耳[3]。子实体群生或丛生,胶质体,浅圆盘形、耳状或不规则形状,直径为 2~12 cm[4]。根据《食物成分表》中的记载,每100 g黑木耳干品含有蛋白质约10 g,与肉类相当,远高于蔬菜,且吸收率也远高于肉类;高纤维、高糖、低脂;含铁量约是猪肝的7倍,芹菜的20倍,肉类的100倍。黑木耳除了可供食用之外更主要的是它的药用价值[5~7],自古以来,就有用黑木耳治疗多种疾病的记录[8]。《神农百草经》记载,“桑耳黑者,主女子漏下赤汁”,本草纲目谓之“木耳生犍为山谷,六月多雨时采”等[9]。现代医学表明,黑木耳具有多种生物学功效如降血糖、抗氧化、降血脂、清除人体内自由基和抗癌等[10~14]。
研究表明,黑木耳的很多生物学功效都与黑木耳多糖的组分密切相关[15],多糖是由大量单糖分子通过糖苷键相互连接形成的聚合物,多糖的提取工艺较为复杂且通过不同方法制备的黑木耳多糖的得率、糖含量、单糖组分等大不相同[16,17]。本实验通过比对超声法、纤维素酶法、超声协同纤维素酶法、超声协同纤维素酶及胰蛋白酶四种不同提取工艺制得的黑木耳多糖的含量及得率,得出最优提取方法并选出最优的黑木耳多糖 AAP3,此工艺探讨为黑木耳多糖的工业化生产提供理论参考。
AAP3经过分级纯化后,在异丙醇体积分数为20%及 60%得到相对单一的多糖组分 AAP3-20和AAP3-60。此外,本实验还对 AAP3-20和 AAP3-60进行了分子质量、单糖组成和红外光谱等理化性质和组成成分分析,为黑木耳多糖进一步的开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
黑木耳干制品购自江西省吉安市井冈山产区,纤维素酶、胰蛋白酶(上海阿拉丁试剂有限公司,酶活力分别为10 U/mg、4.2 U/mg);Dextran T-10、Dextran T-40、Dextran T-50、Dextran T-70、Dextran T-500、蓝色葡聚糖、岩藻糖、鼠李糖、阿拉伯糖、葡萄糖、半乳糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸(美国 Sigma公司,纯度≥99.4%);牛血清蛋白、考马斯亮蓝G-250,磷酸二氢钾、磷酸氢二钠、苯酚、浓硫酸、叠氮钠、硝酸钠、浓硫酸、95%工业乙醇、85%磷酸等试剂。
1.2 仪器与设备
DFY-500摇摆式高速万能粉碎机,温岭市林大机械有限公司;pH计,德国Sartorius公司;KQ 5200E超声波清洗器,昆山市超声仪器有限公司;EYELA SB-1000旋转蒸发仪,东京理化器械株式会社;冷冻干燥机,美国Labconco公司;Milli-Q超纯水仪,美国Millipore公司;1260高效液相色谱,美国Agilent公司;多角度激光光散射凝胶色谱联用系统,美国Wyatt Technology公司;TWCL-G磁力搅拌器,北京瑞成伟业仪器设备有限公司;T6紫外可见分光光度计,北京普析通用有限责任公司;Dionex ICS-5000 DC离子交换色谱仪,美国Thermo公司。
1.3 方法
1.3.1 黑木耳粗多糖的提取
1.3.1.1 超声法
(1)称粉碎后的黑木耳粉末40 g,过20目筛,pH 4.5,温度 50 ℃,蒸馏水:原料=1:25(g/mL)浸提60 min,间歇搅拌;
(2)超声加热80 min,取出升温至100 ℃,反应10 min;
(3)80 ℃回流提取多糖2 h,过滤,旋蒸浓缩滤液,加入4倍滤液体积的95%乙醇,4 ℃过夜醇沉,沉淀复溶于蒸馏水中,冷冻干燥,得黑木耳粗多糖AAP1。
1.3.1.2 纤维素酶法
(1)同超声法(1);
(2)加入纤维素酶0.6 g,继续加热80 min,升温至100 ℃,10 min灭酶;
(3)同超声法(3),得黑木耳多糖AAP2。
1.3.1.3 超声协同纤维素酶法
(1)同超声法(1);
(2)加入纤维素酶0.6 g,边超声边加热80 min,升温至100 ℃,10 min灭酶;
(3)同超声法(3),得黑木耳多糖AAP3。
1.3.1.4 超声协同纤维素酶及蛋白酶复合法
(1)同超声法(1);
(2)加入纤维素酶0.6 g,边超声边加热80 min,降温至40 ℃,调节pH至7.0加入胰蛋白酶0.12 g,反应15 min,升温至100 ℃,10 min灭酶;
(3)同超声法(3),得黑木耳多糖AAP4。
1.3.2 多糖得率测定
总糖测定采用苯酚-硫酸法(以葡萄糖为标准),还原糖用3,5-二硝基水杨酸(DNS)法测定[18]。按如下公式计算黑木耳粗多糖得率:

1.3.3 多糖分级纯化及含量分析
取总糖含量最高的AAP3复溶于蒸馏水中,采用Sevag法脱蛋白,取脱蛋白后的AAP3复溶于蒸馏水中滴加20%双氧水,于40~50 ℃水浴中保温2~3 h,进行脱色,将脱色后样液透析72 h,浓缩,冷冻干燥,得纯化后黑木耳多糖AAP3-P。
取脱蛋白、脱色后的AAP3-P复溶于0.1 M NaCl的蒸馏水中,用异丙醇进行梯度醇沉,于20%及60%体积分数时收集到多糖组分(分别命名为AAP3-20及AAP3-60),复溶,透析,浓缩,冷冻干燥,得黑木耳分级多糖。对分级后的多糖进行糖含量和蛋白含量分析,蛋白质含量采用考马斯亮蓝法(以牛血清蛋白为标准)[19,20]进行测定。
1.3.4 多糖分子质量及分布分析
采用HPSEC-MALLS分析AAP3的分子质量分布情况:分别采用HPSEC广谱校正和HPSEC串联多角度激光散射的标准方法对黑木耳多糖的 Mw及其分布进行分析。HPSEC串联多角度激光光散射检测器(MALLS,DAWN HELEOS-II)、黏度检测器(DP,ViscoStar-II)和示差检测器(RI,Optilab T-rEX)。Model 1500 HPLC泵连接两个分析柱:SB-806 HQ和SB-804 HQ(日本Showa Denko K.K公司,Shodex OHpak,8×300 mm),柱温35 ℃。流动相为0.2 mol/L NaNO3(含0.02% NaN3),流速为0.6 mL/min,ASTRA 6.1 software采集和分析数据。
准确称取5 mg样品,用流动相进行溶解,配制成浓度为1 mg/mL的样品溶液,并用0.22 μm水系滤膜过滤3次。
1.3.5 单糖组成分析
离子色谱工作条件:Dionex ICS-5000离子交换色谱系统,脉冲安培检测器,色谱柱分别为 CarboPac PA20(3×30 mm)保护柱及 CarboPacTM PA20(3×150 mm)分析柱,流动相包括A(250 mmol/L NaOH溶液)、B(H2O)及C(1 mol/L NaOAc),柱温30 ℃,流速0.5 mL/min,进样量10 μL,运用Chromeleon色谱工作站采集处理数据。
样品水解:精确称取5 mg黑木耳粗多糖AAP3于20 mL具塞试管中,冰浴条件下,加入12 mol/L H2SO40.5 mL,磁力搅拌30 min,取出加入超纯水2.5 mL,于100 ℃油浴中磁力搅拌2 h,取出转移至50 mL容量瓶中定容,室温放置约20 min后,吸取2 mL,加水至10 mL容量瓶中定容,得到多糖样品水解液,绘制标准曲线。
1.3.6 红外光谱分析
称取充分干燥的多糖样品2 mg与KBr混匀研磨后压片,上机扫描分析(扫描范围400~4000 cm-1)。
1.3.7 甲基化分析
称取干燥样品3 mg,加入无水二甲基亚砜1 mL,磁力搅拌使样品完全溶解,加入干燥 NaOH粉末 20 mg,密封并磁力搅拌3 h,冰浴搅拌下避光加入1 mL碘甲烷,密封并避光磁力搅拌2.5 h,滴加蒸馏水终止反应,加入等量二氯甲烷进行萃取,并用蒸馏水洗涤3次,加入过量无水硫酸钠,吸出样液,置于N2下挥干,得干燥的甲基化多糖,红外光谱检测。若样品在3500 cm-1附近没有吸收峰,表示多糖上的羟基已甲基化完全。
用1 mL二氯甲烷将甲基化产物洗入安瓿管中,置于N2下挥干,加入4 M三氟乙酸0.5 mL,真空下100 ℃水解6 h,用少量水将水解液转移出安瓿管,置于N2下挥干,加入蒸馏水0.3 mL及NaBD45 mg,室温下过夜搅拌还原,滴加冰醋酸至无气泡产生,置于N2下挥干,依次用10%醋酸甲醇溶液及纯甲醇除尽还原过程中产生的硼酯,加入醋酐0.5 mL,真空下100 ℃乙酰化2 h,得部分甲基化的糖醇乙酸酯衍生物,置于N2下挥干,复溶于二氯甲烷中,进行GC-MS分析[21,22]。
GC-MS工作条件:色谱柱为SP-2330 ms毛细管柱(美国Supelco公司,30 m×0.25 mm×0.2 μm),载气为 He,升温程序为 160~210 ℃(2 ℃/min)、210~240 ℃(5 ℃/min),离子化模式为 EI(70 kV)。
1.3.8 数据统计分析
以下数据均用excel 2013、origin 7.0、SPSS17.0等软件处理完成。各组数据以±s表示。应用 SPSS 17.0软件单因素方差分析,LSD检验。p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 不同提取工艺条件下黑木耳多糖的含量及得率
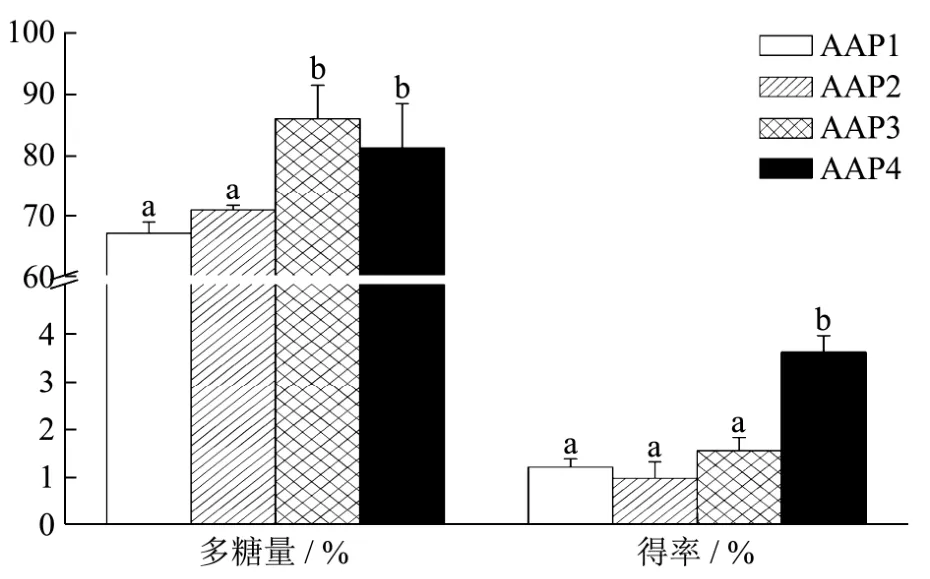
图1 不同提取工艺制得的黑木耳多糖含量及得率Fig.1 Content and yield of Aurcularia auricular polysaccharides extracted by different extraction methods
AAP3黑木耳多糖的含量最高,AAP4黑木耳多糖的得率最大,高于其他三组,AAP3的糖含量与AAP4无明显差异,但AAP3与AAP4的得率有显著性差异,我们可以推测胰蛋白酶对黑木耳多糖的糖含量无太大影响,但对黑木耳多糖的得率有较大影响。对比AAP1和AAP3的糖含量,得出纤维素酶酶对黑木耳多糖的糖含量影响较为显著。AAP3的糖含量最高且得率高于AAP1和AAP2,综合考虑,选定AAP3进行进一步的分级纯化和结构表征。
2.2 多糖纯化
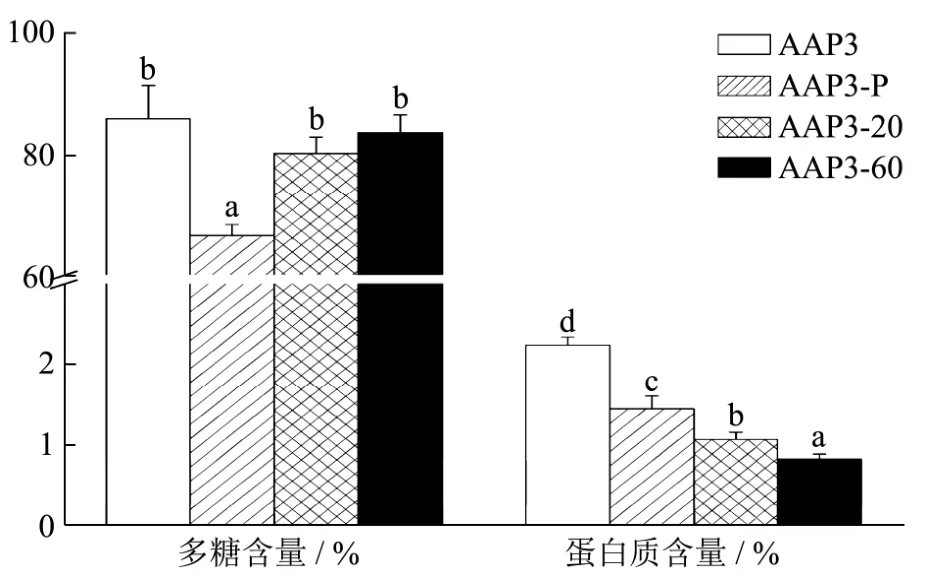
图2 黑木耳多糖的化学组成Fig.2 Chemical composition of Aurcularia auricular polysaccharides
从图2中可以看出,脱蛋白及脱色处理对糖含量有一定的影响。黑木耳多糖的多糖含量由纯化前的85.93%(AAP3)下降至 66.56%(AAP3-P)。这可能是由于多糖与部分蛋白质结合形成糖蛋白,脱蛋白时损失了部分糖,这也符合黑木耳多糖分子量较大,样品溶液较粘稠的特性。相比之下,AAP3-20及AAP3-60样品在经过脱蛋白及脱色处理后,蛋白质含量分别为1.06%和0.82%,证明这两种级份多糖的纯度较高,杂质较少。
2.3 HPSEC分析
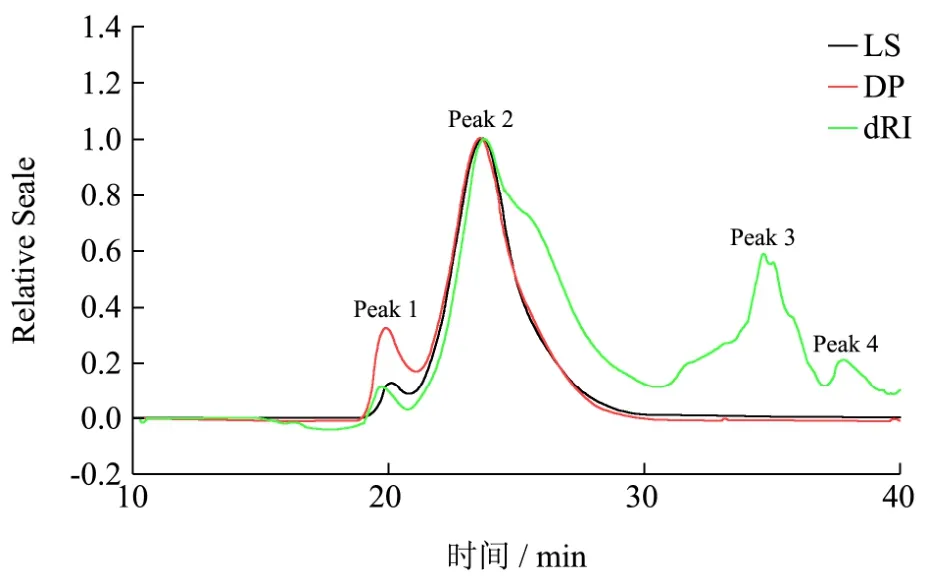
图3 AAP3的HPSEC色谱图Fig.3 HPSEC chromatogram of AAP3
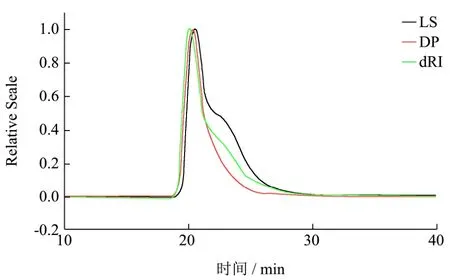
图4 AAP3-20的HPSEC色谱图Fig.4 HPSEC chromatogram of AAP3-20
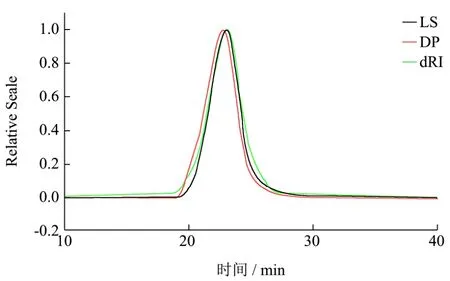
图5 AAP3-60的HPSEC色谱图Fig.5 HPSEC chromatogram of AAP3-60
HPSEC串联多检测器(多角度激光光散射检测器MALLS、粘度检测器DP和示差检测器RI)技术已经被广泛应用于聚合物分子质量和大小的分析。图3为黑木耳多糖AAP3在不同检测器下的洗脱曲线,如图所示AAP3主要由四个峰组成,Peak1、2、3的重均分子量分别为 3.7×103、5.8×102和44 ku(Peak 4 分子量过小未能检出)。
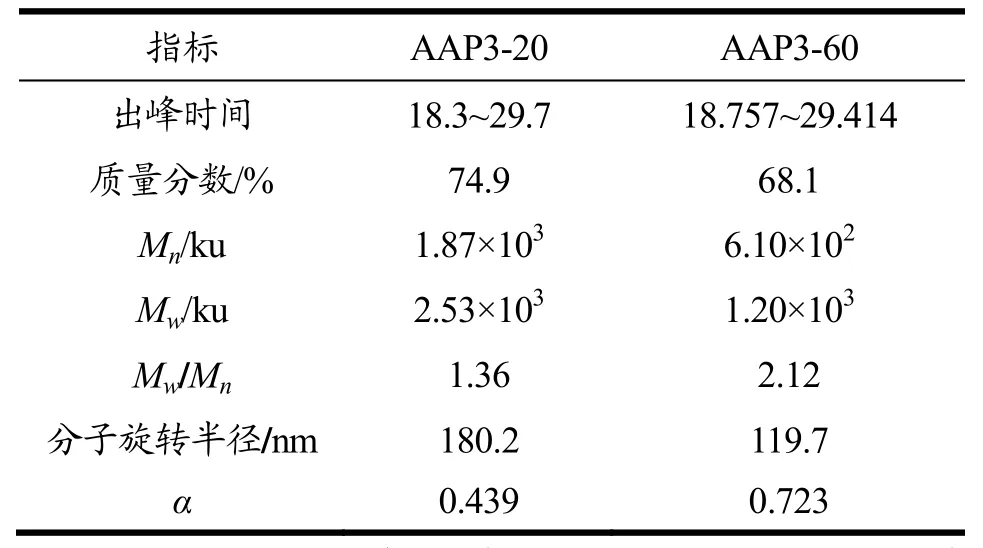
表1 AAP3-20和AAP3-60的分子参数Table 1 Molecular parameters of AAP3-20 and AAP3-60
对纯化前黑木耳粗多糖AAP3和纯化后级份多糖AAP3-20和AAP3-60进行HPSEC分析(图3、图4和图 5),结果表明纯化后的精多糖 AAP3-20和AAP3-60的主要组分较纯化前粗多糖AAP3均一。表1为 AAP3-20和 AAP3-60的主要组分分子参数。AAP3-20和 AAP3-60主要组分的重均分子量分别为2.53×103和1.20×103ku,数均分子量分别为 1.87×103和6.10×102ku,由此可知AAP3-20和AAP3-60的多分散系数PI(Mw/Mn)分别为1.36和2.12,表明该两种级份多糖的分子尺寸是一种宽分布。ASTRA软件分析多糖样品的构象,即由分子旋转半径 RMS与分子摩尔数之间的关系曲线可得,该关系曲线用α表示[23~25]。一般认为α在0.5~0.8之间,表明多糖分子呈柔性无规则线团;当α增大,多糖的刚性随之增强。当α超过1时,表明多糖链呈棒状结构,低于0.3时则呈球形结构[26,27]。AAP3-20和AAP3-60的α值分别0.439和0.723,表明AAP3-60的刚性较AAP3-20大,AAP3-20可能呈高支化紧缩链构象,而AAP3-60可能呈无规则线团结构。
2.4 单糖组分分析
表2为AAP3、AAP3-20和AAP3-60的单糖组成,结果表明AAP3主要由甘露糖、葡萄糖、半乳糖、木糖组成,是一种杂多糖,其中葡萄糖含量最高(48.43%),其次是甘露糖、木糖,半乳糖,AAP3单糖组成总和(80.75%)与多糖含量结果(85.93%)相似。
AAP3-20组分仅由葡萄糖组成(77.82%),这与魏红[28]报道的黑木耳多糖(CMAAP33)单糖组成一致;AAP3-60组分则含有4种单糖,其中大部分为甘露糖(51.91%)与木糖(43.62%),还含有少量的葡萄糖及半乳糖,AAP3-60单糖种类及比例与Anthony[29]提取的黑木耳多糖(AAPW-1)相近,但葡萄糖和甘露糖的比例有一定差异,这可能是黑木耳的产地或提取工艺不同导致。AAP3-20和AAP3-60两种级份多糖中各单糖组成总和与多糖含量的结果基本一致。

表2 AAP3-20及AAP3-60单糖组成情况Table 2 Monosaccharide composition of AAP3-20 and AAP3-60
2.5 FT-IR光谱分析
AAP3-20和 AAP3-60的红外光谱分析见图 6,AAP3-20 和AAP3-60在3600~3200 cm-1,3000~2800 cm-1和1400~1200 cm-1的峰均是糖类化合物的特征吸收峰 cm-1处是多糖分子中O-H的伸缩振动引起的吸收,说明存在分子内和分子间氢键[30,31]。2910 cm-1波长处的峰是多糖类 C-H或亚甲基伸缩振动,1650 cm-1为羰基伸缩振动,1380 cm-1之间的吸收峰是多糖类C-H的变角振动[33]。1050 cm-1的中等强度的信号峰是C-O-H和吡喃糖环C-O-C中C-O键伸缩振动引起的。相比于AAP-20,AAP-60在669 cm-1处存在吸收峰,说明该多糖为一种β-型吡喃多糖[33]。
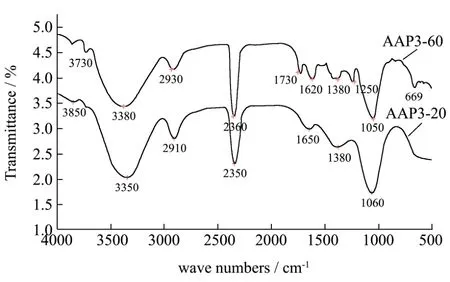
图6 黑木耳多糖的红外光谱图Fig.6 FT-IR spectrum of Aurcularia auricular polysaccharides
2.6 甲基化分析
在单糖组成基础上,对AAP3-20和AAP3-60甲基化分析,甲基化分析通过甲基化试剂将多糖中各单糖残基上的游离羟基甲基化,再将多糖中的糖苷键水解以暴露出单糖残基的连接位点,再通过还原和乙酰化反应得到它们的衍生物进行GC-MS检测分析,确定出不同单糖残基的连接位点。同时,根据不同单糖残基在甲基化产物中的比例得到不同连接类型单搪在多糖中的分子比例[34,35]。AAP3-20和AAP3-60甲基化后对应的质谱碎片、糖苷键类型及百分比见表3。
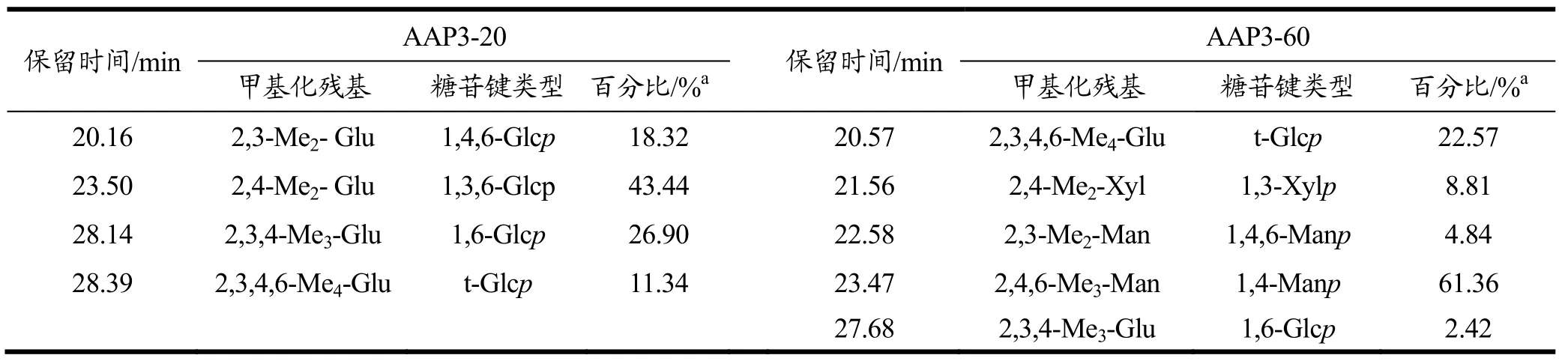
表3 AAP3-20和AAP3-60的甲基化分析结果Table 3 Methylation analysis of AAP3-20 and AAP3-60
AAP3-20甲基化PMAA产物主要由2,4-Me2- Glu(43.44%),2,3,4-Me3-Glu(26.90%),2,3-Me2- Glu(18.32%),2,3,4,6-Me4-Glu(11.34%)组成,结合单糖组成结果及文献,AAP3-20残基主要有1,3,6-Glcp,1,6-Glcp,1,4,6-Glcp,t-Glcp;AAP3-60中 1,4-Manp含量最高(61.36%),t-Glcp(22.57%),1,3-Xylp(8.81%),1,4,6-Manp(4.84%),1,6-Glcp(2.42%),该结论与刘大政[36]提取的黑木耳多糖(AA4HE2)甲基化结果几乎一致,主要体现在1,4-Manp及1,3-Xylp残基所占比例。根据Harker、Lee和Frechet的计算方法[37],AAP3-20和AAP3-60的支化度分别为73.1%和27.4%,表明AAP3-20属于支化度较高的多糖链。
3 结论
本研究通过对比四种黑木耳多糖的提取工艺,得出黑木耳粗多糖的最佳提取方式是超声协同胰蛋白酶法,在该条件下制得的黑木耳粗多糖AAP3是一种葡萄糖含量较高的杂多糖。经过进一步的分级纯化得到纯度较高的 AAP3-20和 AAP3-60两种组分多糖,AAP3-20仅由葡萄糖组成,而AAP3-60主要由甘露糖和木糖组成;甲基化结果表明 AAP3-20含有1,4,6-Glcp、1,3,6-Glcp、1,6-Glcp、t-Glcp四种残基,AAP3-60 含有 t-Glcp、1,3-Xylp、1,4,6-Manp、1,4-Manp、1,6-Glcp五种残基,结合HPSEC分析和甲基化结果表明,AAP3-20可能呈高支化紧缩链构象,AAP3-60可能是一种呈无规则线团结构的β-型吡喃多糖。
[1]王献友,陈培云,吴广臣,等.黑木耳多糖提取及其药理活性的研究进展[J].南方农业学报,2012,43(5):683-687 WANG Xian-you, CHEN Pei-yun, WU Guang-chen, et al.Advances on polysaccharide extraction from Auricularia auricular and its pharmacological activity [J]. Journal of Southern Agriculture, 2012, 43(5):683-687
[2]周国华,于国萍.黑木耳多糖降血脂作用的研究[J].现代食品科技,2005,21(1):46-48 ZHOU Guo-hua, YU Guo-ping. Effect study of auricularia polysaccharide on reducing blood lipid [J]. Modern Food Science and Technology, 2005, 21(1):46-48
[3]江雄波,陈益娴,张俊青,等.氮源比例和耳场条件对黑木耳胶原蛋白含量的影响[J].中国食用菌,2016,35(1):50-52 JIANG Xiong-bo, CHEN Yi-xian, ZHANG Jun-qing, et al.Effects of nitrogen source and fruiting environment on collagen content of auricularia auricula-judae [J]. Edible Fungi of China, 2016, 35(1):50-52
[4]黄来年.中国大型真菌原色图鉴[M].北京:中国农业出版社,1998 HUANG Lai-nian. China 's large-scale fungal primary colors[M]. Beijing:China Agriculture Press, 1998
[5]卞春,王振宇,John Shi.黑木耳多糖生物功能的研究进展[J].食品工业科技,2015,16:390-394 BIAN Chun, WANG Zhen-yu, John Shi. Research progress of Auricularia auricular polysaccharide(AAP)biological functions [J]. Science and Technology of Food Industry, 2015,16:390-394
[6]白海娜,王振宇,刘瑞海,等.白藜芦醇与黑木耳多糖协同清除 ABTS自由基活性的研究[J].现代食品科技,2014,3:64-68 BAI Hai-na, WANG Zhen-yu, LIU Rui-hai, et al. Synergistic ABTS radical scavenging activity of resveratrol with auricularia auricular polysaccharides [J]. Modern Food Science and Technology, 2014, 3:64-68
[7]Guo H Y, Lu Y D, Li Z H, et al. A new drimane-type sesquiterpenoid from fermentation broth of fomitiporia punicata [J]. Natural Product Research and Development,2014, 26(1):6-82
[8]朱宝兰.中国黑木耳生产[M].北京:中国农业出版社,2000 ZHU Bao-lan. Production of Auricularia auricula in China[M]. Beijing:China Agriculture Press, 2000
[9]彭强.黑木耳培养料及营养生理特牲研究[D].哈尔滨:东北农业大学,2007 PENG Qiang. Studies on substrates and nutrient physiological characteristics of aurlcularia auricular [D].Harbin:Northeast Agricultural University, 2007
[10]Jun G, Hua T, Bao-shu L, et al. Steroids from fungus engyodontium album associated with the South China Sea cucumber Holothuria nobilis Selenka [J]. Academic Journal of Second Military Medical University, 2013, 33(3):310-314[11]Yi Y. Study on chemical constituents of hippocampus erinaceus [J]. China Pharmacy, 2014, 19(1):13-17
[12]Noh H J, Yang H H, Kim G S, et al. Chemical constituents of Hericium erinaceum associated with the inhibitory activity against cellular senescence in human umbilical vascular endothelial cells [J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2015, 30(6):934-940
[13]Du Z Z, Shen Y M. A rare new cleistanthane diterpene from the pericarp of Trewia nudiflora [J]. Helvetica Chimica Acta,2006, 89(11):2841-2845
[14]Khaskheli S G, Zheng W, Sheikh S A, et al. Characterization of Auricularia auricula polysaccharides and its antioxidant properties in fresh and pickled product [J]. International Journal of Biological Macromolecules, 2015, 81:381-395
[15]周鹏,谢明勇.多糖的生物活性[J].食品研究与开发,2001,22(2):6-8 ZHOU Peng, XIE Ming-yong. Biological activity of polysaccharides [J]. Food Research and Development, 2001,22(2):6-8
[16]许淑琴.黑木耳刚性链葡聚糖结构、链构象转变及自组装行为[D].武汉:武汉大学,2013 XU Shu-qin. Chemical structure, chain conformational transition, and self-assembly behaviors of stiff glucan from auricularia auricular-judae [D]. Wuhan:Wuhan University,2013
[17]Cui S W. Food carbohydrates:chemistry, physical properties,and applications [M]. CRC Press, 2005
[18]Kim Y S, Martin D F. Colorimetric estimation of acidic polysaccharide content of Gymnodinium Breve [J].Environmental Letters, 1973, 4(2):109-116
[19]Ozturk S, Aslim B, Suludere Z, et al. Metal removal of cyanobacterial exopolysaccharides by uronic acid content and monosaccharide composition [J]. Carbohydrate Polymers,2014, 101:265-271
[20]Georgiou C D, Grintzalis K, Zervoudakis G, et al. Mechanism of Coomassie brilliant blue G-250 binding to proteins:a hydrophobic assay for nanogram quantities of proteins [J].Analytical and Bioanalytical Chemistry, 2008, 391(1):391-403
[21]Hakomori S. A rapid permethylation of glycolipid and polysaccharide catalyzed by methylsulfinyl carbanion in dimethyl sulfoxide [J]. Journal of Biochemistry, 1964, 55(2):205-208
[22]Gray G R. The reductive cleavage method for polysaccharide structural analysis [J]. Carbohydrate Polymers, 1998, 34(4):429
[23]王海燕,戴军,陈尚卫.灵芝菌丝体多糖的分离纯化及其单糖组成分析与分子质量测定[J].食品与机械,2015, 5:201-205 WANG Hai-yan, DAI Jun, CHEN Shang-wei. Separation,monosaccharide composition and molecular weight analysis of polysaccharide from G.lucidum mycelium [J]. Food and Machinery, 2015, 5:201-205
[24]PU X, MA X, LU L, et al. Structural characterization and antioxidant activity in vitro of polysaccharides from angelica,and astragalus [J]. Carbohydrate Polymers, 2016, 137:154-164
[25]张攀峰,陈玲,李晓玺,等.不同直链支链比的玉米淀粉分子质量及其构象[J].食品科学,2010,31(19):157-160 ZHANG Pan-feng, CHEN Ling, LI Xiao-xi, et al. Molecular mass and conformation of corn starches with ddifferent amylose/amylopectin ratios [J]. Food Science, 2010, 31(19):157-160
[26]康继.天然高性能乳化剂-印度树胶的精细分子结构和构象特性研究[D].无锡:江南大学,2011 KANG Ji. Study of fine structures and conformational properties of gum ghatti [D].Wuxi:Jiangnan University, 2011
[27]杨涛,郭龙,李灿,等.红芪多糖 HPS1-D 的化学结构和抗补体活性研究[J].中国中药杂志,2014,39(1):89-93 YANG Tao, GUO Long, LI Can, et al. Studies on chemical structure and anti-complement activity of HPS1-D in astragalus polysaccharides [J]. Chinese Journal of Chinese Medicine, 2014, 39(1):89-93
[28]魏红.黑木耳多糖的羧甲基化修饰及抗氧化活性研究[D].苏州:江苏大学,2010 WEI Hong. Carboxymethylated derivative and their antioxidant activities of polysaccharides from auricularia auricular [D]. Suzhou:Jiangsu University, 2010
[29]Anthony Daniel Foday. Sequential isolation and fractionation of polysaccharides from auricularia auricular fruit bodies and their pharmacological activities [D]. Changchun:Northeast Normal University, 2012
[30]黄静涵,艾斯卡尔·艾拉提,毛健.灵芝多糖的分离纯化及结构鉴定[J].食品科学,2011,32(12):301-304 HUANG Jing-han, Asker Erati, MAO Jian. Purification and structural identification of a bioactive polysaccharide fraction from ganoderma lucidum [J]. Food Science, 2011, 32(12):301-304
[31]ZHOU X, XU L, FENG S, et al. Characteristics and bioactivities of different molecular weight polysaccharides from camellia seed cake [J]. International Journal of Biological Macromolecules, 2016, 9:1025-1032
[32]许峰,吴玲芳,林善,等.发酵冬虫夏草菌丝体中虫草多糖含量的检测及结构鉴定[J].基因组学与应用生物学,2014,33(6):1294-1302 XU Feng, WU Ling-fang, LIN Shan, et al. The content determination and structural characterization of polysaccharides from the mycelium of ophiocordyceps sinensis [J]. Genomics and Applied Biology, 2014, 33(6):1294-1302
[33]WU F, YAN H, MA X, et al. Comparison of the structural characterization and biological activity of acidic polysaccharides from Cordyceps militaris, cultured with different media [J]. World Journal of Microbiology &Biotechnology, 2012, 28(5):2029-2038
[34]Mischnick P. Structural analysis of polysaccharides and polysaccharide derivatives [J]. Macromolecular Symposia,1995, 99:3-13
[35]Mukerjea R, Kim D, Robyt J F. Simplified and improved methylation analysis of saccharides, using a modified procedure and thin-layer chromatography [J]. Carbohydrate Research, 1996, 292(1):11-20
[36]刘大政.黑木耳多糖的分离纯化及结构分析[D].长春:东北师范大学,2008 LIU Da-zheng. Fracitonation and structural analysis of the polysaccharides from Auricularia auricala [D]. Changchun:Northeast Normal University, 2008
[37]Hawker C J, Lee R, Frechet J M J. One-step synthesis of hyperbranched dendritic polyesters [J]. Journal of the American Chemical Society, 2002, 113(12):4583-4588

