CKD合并地贫患者铁代谢情况及其与Hepcidin水平相关性研究
谭军华,王洁,陈红,黄鹏,古贤君,黄美英,蒙陈宝
(广西百色右江民族医学院附属医院肾内科,广西 百色 533000)
0 引言
慢性肾脏病患者(CKD)由于肾脏的内分泌功能下降、促红细胞生成素(EPO)分泌少,导致红细胞生成减少。往往会伴有不同程度的血色素下降,我们称之为肾性贫血。在CDK3期后容易发生,贫血的严重程度常与肾脏功能减退的程度成正比。地中海贫血(thalassemia)简称地贫,地中海贫血常年反复慢性溶血、无效红细胞生成,贫血和铁过载是其最主要的并发症。根据α或者β珠蛋白基因的缺陷使得α或者β珠蛋白肽链合成α珠蛋白与非α珠蛋白不同分为α地贫和β地贫。肾性贫血合并地中海贫血的贫血机制、铁代谢情况复杂,地贫患者通常表现为铁负荷过重、 Hepcidin浓度水平下降,而肾性贫血则多表现为铁负荷不足、 Hepcidin排泄功能下降,Hepcidin浓度水平上升。我们本次研究主要是探讨慢性肾脏病贫血合并不同类型地中海贫血患者体内铁代谢情况、Hepcidin表达水平及其两者彼此间的关联。
1 研究对象
选取我院2015年3月1日至2017年3月1日期间在我科治疗CKD非透析病人30例(CKD组)、CKD合并α地贫非透析患者30名(CKD-α地贫组)、CKD合并β地贫非透析患者30名(CKD-β地贫组)、对照组选取同期体检部正常健康体检人员30名(正常组)。CKD组原发病是慢性肾炎12名,高血压肾损害6名,糖尿病肾损害5名,结石梗阻肾损害4名,遗传性多囊肾损害2名,系统性红斑狼疮肾损害1名;CKD-α地贫组原发病是慢性肾炎14名,高血压肾损害6名,糖尿病肾损害6名,结石梗阻肾损害3名,遗传性多囊肾损害3名;CKD-β原发病是慢性肾炎15名,高血压肾病8名,糖尿病肾病6名,系统性红斑狼疮肾损害1名。
入选标准:(1)慢性肾脏病贫血合并珠蛋白异常组:新发病人在院外未接受治疗,肾功能损害并贫血珠蛋白合成异常;(2)正常组:同期在本院接受体检且结果完全正常的成年人,无慢性疾病,三大常规、肝肾功能均处于健康水平。
排除标准:(1)有证据表明近期有活动或隐匿性出血,包括外伤手术、失血性疾病等以及合并血液系统疾病等;(2)过去4周有输血史;(3)已开始行肾脏替代治疗如血透、腹透或肾移植患者。
2 实验步骤、方法
(1)慢性肾脏病患者的地贫筛查:对本院住院的慢性肾脏病贫血患者采血行常规检测、Hb分析检测筛选出地中海贫血患者。
(2)地贫基因分型。筛选出的血红蛋白珠蛋白肽链合成异常者进行单管四重PCR/琼脂糖凝胶技术、膜反向杂交法测定地贫DNA,区分α、β地贫基因类型。
(3)试验分组。CKD组、CKD-α地贫组、CKD-β地贫组、正常对照组。
(4)铁代谢检测。所有入组人员在早上空腹抽取四份静脉血样分别送本院血液室测定RBC、Hb、Hct、hs-CRP,生化检验室测量BUN、CREA、ALB、SI,核医学室测量SF、TSAT、iPTH,采用ELISA方法测量血清中sTfR、Hepcidin的浓度。
3 统计学处理
将所有实验中的数据输入到SPSS17.0软件中,通过正态性方法检验数据是否符合正态性条件,将正态数据描述成均数±标准差(±s)表示形式,采用独立样本t检验分析(CKD组)、(CKD-α地贫组)、(CKD-β地贫组)及(正常组)中Hepcidin、sTfR、SI、TSAT、SF之间的差别,否则采用非参数检验。采用Person或者Spearman相关性分析Hepcidin与CKD及CKD合并地中海贫血患者的其他临床资料之间的相关性。
4 结果
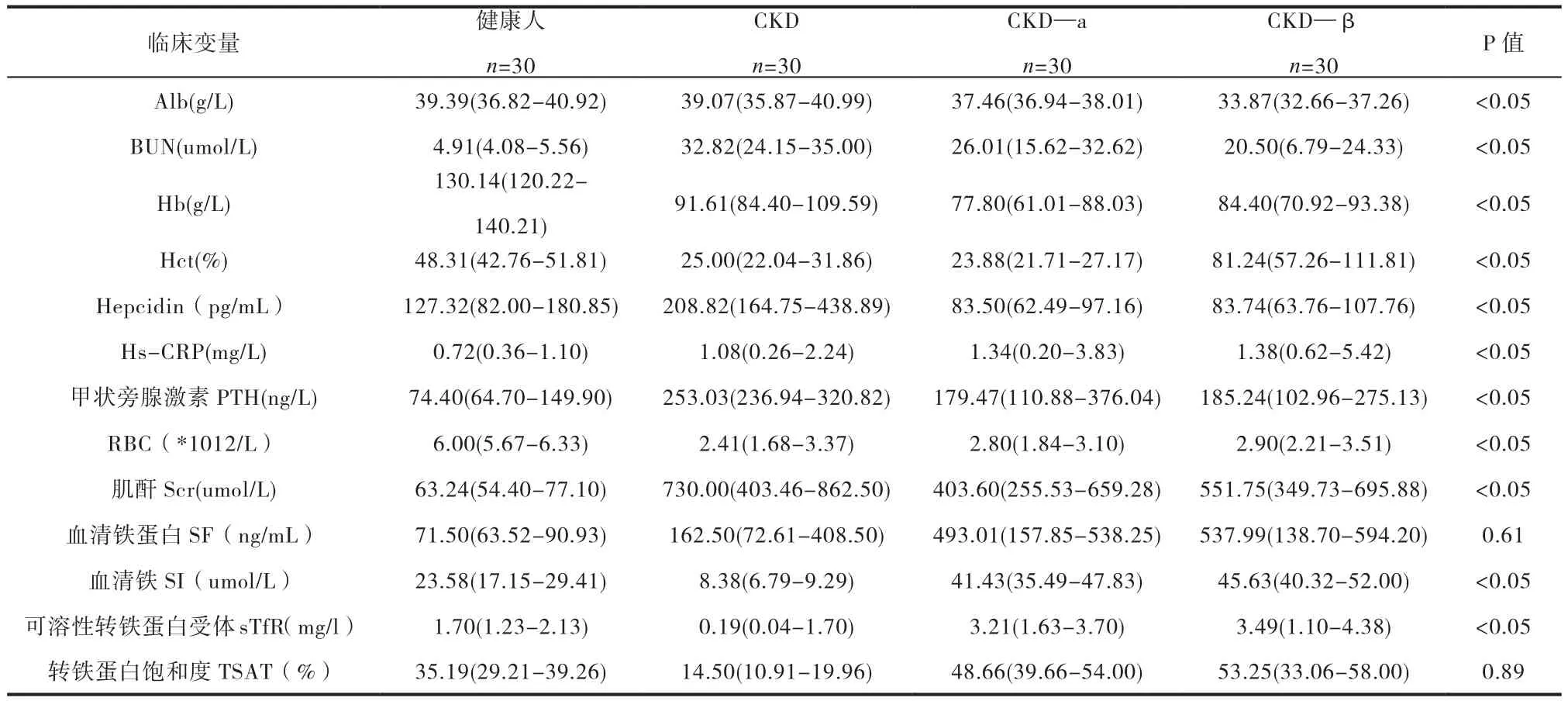
表1 正常人,CKD,CKD-α,CKD-β四组临床指标的比较
5 讨论
CKD贫血合并地中海贫血患者并发症多、铁代谢紊乱。Hepcidin表达水平与铁代谢、缺氧、炎症、输血、促红素EPO等密切联系。我们本次研究主要是探讨慢性肾脏病贫血合并不同类型地中海贫血患者体内铁代谢情况、Hepcidin表达水平及其两者之间的相关性。
肾性贫血的特点是正细胞、正色素性贫血。病因在很大程度上是由于缺乏EPO、红细胞寿命的缩短、骨髓造血功能抑制和其他因素影响造血功能以及铁代谢紊乱而导致贫血[1]。肾性贫血铁代谢紊乱主要表现为血清铁降低,铁蛋白水平正常或升高。其中铁蛋白的水平与铁缺乏、铁储存和体内的炎性病症有关。这可能是由于在慢性肾脏病贫血EPO水平下降引起的铁的利用消耗障碍,使得铁负荷过大,而炎症激活巨噬细胞,过量摄入铁的,导致储存铁增加[2]。地中海贫血慢性溶血,导致血红蛋白释放大量的铁,另一方面由于贫血导致肠道代偿性吸收铁过多,慢性肾脏病合并地中海贫血的贫血机制、铁代谢情况复杂,地贫患者通常表现为铁负荷过载、而肾性贫血则多表现为铁负荷不足。
Hepcidin与机体铁水平之间是负相关。Hepcidin主要通过与细胞膜表面的FPN1结合发挥作用。Hepcidin小粘膜套管和单核细胞/巨噬细胞外部的FPN1细胞结合在一起,导致后者被溶酶体吸收,铁离子没有足够的FPN1可以结合,小肠细胞中的铁元素无法输出,不断地积累,最终随着细胞的脱落排出去,铁元素的吸收量因此降低,巨噬细胞无法正常地释放铁元素,从而降低血清铁的水平[3-5]。通过本课题研究发现,Hepcidin浓度和SF浓度是同向变化的,也就是说当SF浓度有所提高时,Hepcidin的浓度也会一并提高,这和前人的研究结论是相符的[6]。国外Ashby DR等做过课题表明,与正常对照组比较,Hepcidin在肾功能不全患者体内的浓度会升高[7]这说明肾功能的下降,Hepcidin排泄能力下降,引起体内浓度上升。国外Beshlawwy等的研究的结论也跟我们类似β地贫组Hepcidin水平比α地贫组要高,但差异无统计学意义[8]。在我们的结论中提示,CKD组的Hepcidin要高于β地贫组(P<0.05),差异有显著的统计学意义,Kattamis等的研究提出重型地贫患者机体Hepcidin水平比中间型低的主要是因为重型地贫需要反复输血[9]。

表2 CKD三组中Hepcidin表达水平与其他指标相关性
[1] Cullis JO.Diagnosis and management of anaemia of chronic disease:currentstatus[J].Br J Haematoh, 2011,154(3);289-300.
[2] 郭慧娟,尚晓规.慢性肾衰铁参数与贫血的关系[J].中国医药报,2009,5(36):84-85.
[3] Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing it internalization[J].Science, 2004, 306(5704):2090-2093.
[4] Domenico D, Ward DM, Kaplan J.Hepcidin regulation: ironing out the details[J]. J ClinInvest, 2007,117(7):1755-1758.
[5] De Domenico Ivana, Ward Diane Mc Vey, Langelier Charles, et aI.The molecular Mechanism of hepcidin-mediated ferroportin downregulation[J]. Mol Biol Cell, 2007,18(7):2569-2578.
[6] 张妍,周晓玲,陈孟华.终末期肾脏病患者血清中Hepcidin的水平变化及其与铁代谢的关系[J].中国血液净化, 2011,10(7):371-375.
[7] Ashby DR,Gale DP,Busbridge M,et al,Plasma hepcidin levels are elevated but responsive to erythropoietin therapy in renal disease[J].Kidney Int,2009,75(9):976-981.
[8] Liu Q,Davidoff O,Niss K,et al.Hypoxia-inducible factor regulates Hepcidin via erythropoietin-induced erythropoiesis[J].J Clin Invest,2012,122(12):4635-44.
[9] Ashby DRj,Gale DP, Busbridge M,et al.Erythropoietin administration in humans causes amared and prolonged reduction in circulating hepcidin [J].Haematologica,2010,95(3):505-8.

