杉木Cu/Zn-SOD基因克隆、序列特征及组织特异性表达
饶丽莎,许珊珊*,黄田盛,理 挪,左丹丹,曹光球,林思祖
(1.福建农林大学 林学院,福建 福州 350002;2.国家林业局 杉木工程技术研究中心,福建 福州 350002)
杉木(Cunninghamialanceolata)是我国南方特有的商品用材树种[1]。主要分布在长江流域、秦岭以南地区,在杉木主产区夏季高温少雨,冬季寒冷干燥,极端低温和干旱现象频发。因此,杉木在生长过程中大多会面临各种恶劣环境(洪涝,干旱,铝毒害,盐碱胁迫等),容易引起杉木体内活性氧代谢失衡,导致其体内活性氧大量积累造成氧化损伤,最终使植物生长受抑。逆境胁迫下,为保护细胞免受活性氧的伤害,植物在长期进化过程中,建立了一套酶促和非酶促系统组成的抗氧化体系。超氧化物歧化酶(superoxidedismutase,SOD)是一种抗氧化剂,是植物体内清除自由基的重要成分。在清除植物体内超氧阴离子自由基,减轻其对细胞的损伤,维持细胞膜的结构和功能中起着十分关键的作用[2]。研究表明,超氧化物歧化酶主要存在于需氧生物的各类器官中,比如细菌、原生生物和动植物体内,根据金属辅因子的不同可将超氧化物歧化酶分为3类,即Cu/Zn-SOD、Mn-SOD和Fe-SOD[3]。Cu/Zn-SOD是超氧化物歧化酶结构的第一族,占SOD的86%,高等植物中的Cu/Zn-SOD其大都存在于细胞溶胶和叶绿体中,在逆境中避免细胞与组织受到过量活性氧的损伤[4]。Ronald[5]等在1987年首次成功克隆出了玉米(Zeamays)的SOD2基因,随后在木薯(Manihotesculenta)[6]、丹参(Salviamiltiorrhiza)[7]、油菜(Brassicanapus)[8]、莲(Nymphaea)[9]、烟草(Nicotianatabacum)[10]、水稻(Oryzasativa)[11]、拟南芥(Arabidopsisthaliana)[12]、甘蔗(Saccharumofficinarum)[13]等植物中克隆获得Cu/Zn-SOD基因。同时运用分子生物学技术将Cu/Zn-SOD基因转化到烟草(NicotianatabacumL.)中,结果显示Cu/Zn-SOD基因有效地提高烟草对盐胁迫的耐受性[14]。B.D.McKersie[15]和Du[16]等将SOD基因分别转入到苜蓿(MedicagoSativa)和玉米中,转基因植株在逆境胁迫下的抗氧化能力均有明显提高。目前,杉木关于超氧化物歧化酶的研究主要集中在逆境胁迫下酶活性的变化上,而对其基因层面的研究较少。因此,研究杉木受逆境胁迫的相关基因,并对其进行克隆和表达分析,了解杉木在逆境胁迫下的耐受能力和抗逆分子机制,对克服逆境造成的农林业的损害具有重要意义。本文以杉木组培苗为材料,根据杉木转录组数据库设计特异性引物,运用RT-PCR获得杉木Cu/Zn-SOD基因,利用生物信息学方法对其氨基酸组成、理化性质、亲疏水性、亚细胞定位、二级/三级结构、磷酸化结构等进行了预测和分析,为进一步探究杉木Cu/Zn-SOD基因在逆境胁迫中的功能及抗逆育种的分子机制提供理论依据。
1 材料与方法
1.1 植物材料
以国家林业局杉木工程技术研究中心组培室的020号组培苗作为试验材料,继代在MS培养基中,待生长数月后整株取样用于克隆分析。取成熟的杉木组培苗的根、茎和叶,用于组织特异性表达。取样后迅速用液氮速冻,-80℃保存备用。
1.2 总RNA的提取及cDNA第1链的合成
取0.1 g杉木组培苗加入液氮迅速研磨至粉末状,采用天根公司的多糖多酚植物总RNA提取试剂盒提取总RNA。利用紫外分光光度计和1%琼脂糖凝胶电检测RNA的质量。利用天根公司的TIANScript cDNA第1链合成试剂盒进行RNA反转录得到相应cDNA。
1.3 杉木Cu/Zn-SOD的克隆及生物信息学分析
根据杉木转录组数据库设计特异性引物F1(5′-ATGGGTTCACTCAAGGCTGTTGCTG-3′)和R1(5′-TCAACCTTGAAGACCTATGACCCCG-3′),进行RT-PCR特异性扩增目的片段。利用1.2反转录得到的cDNA模板,采用50μ反应体系全式金公司的2×TransTaq-T PCR SuperMix试剂盒进行克隆。反应条件为95℃ 2 min;95℃ 15 s,60℃ 30 s,40个循环;72℃ 10 min。用1.0%的琼脂糖凝胶电泳检测,回收目的条带,连接PM18T载体上,转化到大肠杆菌DH5α中筛选阳性克隆,送华大公司测序。
通过NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)在线软件对Cu/Zn-SOD基因进行开放阅读框预测;通过NCBI和Phytozome11.0数据库获得Cu/Zn-SOD蛋白相似序列,采用Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo/)数据库在线进行氨基酸多序列比对;并用MEGA5.0软件中的Neighbor-joining(临位相连法)构建蛋白氨基酸序列的系统发育树。采用ExPASy-ProtParam tool软件在线(http://web.expasy.org/protparam/)进行杉木Cu/Zn-SOD蛋白质理化性质分析和亲疏水性;用GORIV(http://npsa-pbil.ibcp.fr/)和SWISSMODEL(http://swissmodel.expasy.org/)进行蛋白二级三级结构预测;用Psort(http://psort.hgc.jp/form.html)进行亚细胞定位预测;通过软件SignalIP4.1Server在线(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽;用NetPhos 2.0 Sever(http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸化结构预测;利用Profun2.2Sever(http://www.cbs.dtu.dk/services/ProtFun/)进行蛋白功能预测[17-18]。
1.4 杉木Cu/Zn-SOD组织特异性表达分析
试验以杉木Actin为内参基因,设计引物F1:5′-CAGCAACTGGGATGATATGG-3′,R1:5′-ATTTCGCTTTCAGCAGTGGT-3′;扩增杉木Cu/Zn-SOD基因设计引物F2:5′-ATTATAGGACGAGCTGTGGTTG-3′,R2:5′-AGTCTTCCGCCAGCATTT-3′。qPCR反应采用TaKaRa生物公司的SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒,在ABI7500荧光定量PCR仪上进行试验。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环。
2 结果与分析
2.1 杉木Cu/Zn-SOD基因的克隆
提取整株杉木组培苗总RNA并用紫外分光光度计测得A260/A280比值均在1.8~2.0,电泳检测得28、18 s和5 s条带清晰可见(图1),说明提取的RNA质量较好,可进行反转录。以反转cDNA为模板,进行PCR扩增,获得1条约461 bp的条带(图2)。

注:1.DL5000; 2.杉木总RNA。
2.2 杉木Cu/Zn-SOD同源性比较和系统进化树构建
利用ORF Finder在线分析所得基因序列,结果表明该基因包含1个312 bp的开放阅读框,编码104个氨基酸(图3)。利用DNAMAN软件分析Cu/Zn-SOD序列(图4),与桉树(Eucalyptusrobusta)、番茄(Lycopersiconesculentum)、甘薯(Dioscoreaesculenta)、南极草(Antarcticgrass)、拟南芥(Arabidopsisthaliana)、五色梅(Lantanacamara)、小麦(Triticumaestivum)、杨梅(Myricarubra)、杨树(Populus)、油菜(Brassicanapus)、玉米、獐茅(Angiospermae)比对同源性总体为88.6%,序列一致性分别为77.12%、76.47%、77.78%、74.51%、76.47%、75.16%、72.55%、71.90%、79.08%、75.16%、77.12%、78.43%。通过构建杉木和12个其他植物的Cu/Zn-SOD进化树(图5),发现杉木的Cu/Zn-SOD与南极草、小麦、玉米、獐茅聚为一类。结果表明杉木Cu/Zn-SOD基因核苷酸序列在进化过程中保守程度较好。

注:1.DL5000; 2.3.Cu/Zn-SOD基因RT-PCR产物。
2.3 杉木Cu/Zn-SOD编码蛋白质理化性质及疏水性
利用ExPasy在线软件预测Cu/Zn-SOD氨基酸序列的理化性质,结果表明,Cu/Zn-SOD基因的蛋白质分子式为C653H1045N197O219S4,总原子数2118,理论等电点为5.61,脂肪系数为77.06,分子量为15.287 91 kD。由18种组成氨基酸,含量由大到小分别是甘氨酸(Gly)19.0%、缬氨酸(Val)9.2%、天冬氨酸(Asp)7.2%、丙氨酸(Ala)7.2%、亮氨酸(Leu)7.2%、苏氨酸(Thr)7.2%、丝氨酸(Ser)6.5%、组氨酸(His)5.9%、脯氨酸(Pro)5.2%、赖氨酸(Lys)4.6%、异亮氨酸(Ile)3.9%、谷氨酸(Glu)3.9%、谷氨酰胺(Gln)3.3%、天冬酰胺(Asn)3.3%、精氨酸(Arg)2.0%、苯丙氨酸(Phe)2.0%、半胱氨酸(Cys)1.3%、蛋氨酸(Met)1.3%。其中Gly的含量与蛋白质肽链的折叠和形成发夹结构有关,研究表明杉木Cu/Zn-SOD的Gly含量最高,与其他物种Cu/Zn-SOD的Gly含量一致[19]。其中有17个负电荷氨基酸残基(Asp+Glu),正电荷氨基酸残基(Arg+Lys)为10个。不稳定指数为14.54,该蛋白为稳定蛋白。在280 nm下的消光系数为125,主要是因为该基因的色氨酸(Trp)和酪氨酸(0Tyr)含量为0.0%,蛋白质的半衰期为30 h,和大部分蛋白一样,酵母体内>20 h,大肠杆菌体内>10 h。

注:下划线表示开放阅读框。

注:A:杉木;B:桉树;C:番茄;D:甘薯;E:南极草;F:拟南芥;G:五色梅;H:小麦;I:杨梅;J:杨树;K:油菜;M:玉米;N:獐茅。表5同。

图5 杉木Cu/Zn-SOD与其他植物Cu/Zn-SOD氨基酸系统发育树
在线预测Cu/Zn-SOD蛋白的疏水曲线(图6),可知Cu/Zn-SOD蛋白在第148个氨基酸处最高值为2.078,疏水性最强;在第79个氨基酸处的最低值为-2.644,亲水性最强。总平均疏水指数为-0.259,为亲水性蛋白。
2.4 杉木Cu/Zn-SOD功能结构域分析及亚细胞定位
利用NCBI在线预测Cu/Zn-SOD蛋白功能结构域发现该氨基酸序列属于Cu-ZnSOD蛋白家族(图7)。Cu/Zn-SOD与金属原子相结合的位点十分保守,Cu离子的结合位点为第45、47、62和第119位;Zn离子的结合位点为第62、70、79和第82位,在所有报道的Cu/Zn-SOD序列中是非常保守的[20-22]。根据Psort在线软件预测亚细胞定位可知蛋白Cu/Zn-SOD定位在细胞质的概率最大为43.5%,其次是细胞核为30.4%、细胞核为26.1%。细胞质定位信号区域预测为GKEGVSGVVQFTQEGDGPTTVSAKVSGL。

图6 杉木Cu/Zn-SOD蛋白的疏水性预测
2.5 杉木Cu/Zn-SOD蛋白二级和三级结构预测
根据GORIV在线软件预测Cu/Zn-SOD蛋白二级结构由延伸链(Ee)和无规则卷曲(Cc)组成。其中Ee占39.87%,Cc占60.13%(图8)。蛋白质的空间结构决定着该基因的功能,其中无规则卷曲是蛋白质分子功能实施和构象的重要区域。在Cu/Zn-SOD蛋白二级结构中,无规则卷曲占取比例最大。Cu/Zn-SOD的三维结构与二级结构的预测结构一致(图9),无规则卷曲所占比例最大为41%。
2.6 杉木Cu/Zn-SOD蛋白信号肽和磷酸化结构预测
蛋白在信号肽的指引下可在细胞内输运信号,预测和分析蛋白信号肽对了解杉木Cu/Zn-SOD蛋白质细胞定位及结构域的分选有重要意义。根据软件预测表明(图10),整个氨基酸肽链上没有信号肽的存在,可预测该蛋白属于非分泌蛋白。预测在第18号氨基酸时为信号肽剪切位点,其C值、Y值均达到最大,分别为0.182、0.167,第8号氨基酸S值最大为0.185。

图7 杉木Cu/Zn-SOD基因编码蛋白的功能结构域

注:紫色为无规则卷曲;红色为延伸链。
利用NetPhos Sever在线软件对杉木Cu/Zn-SOD蛋白进行磷酸化结构预测,结果显示(图11),丝氨酸(Ser)和苏氨酸(Thr)可能发生磷酸化,其中Ser可能发生磷酸化的位点有10个,分别在第2、16、32、36、59、98、102、107、111、134位氨基酸,发生概率:0.754、0.743、0.811、0.605、0.928、0.995、0.461、0.581、0.546、0.454;Thr可能发生磷酸化的位点有11个,分别在第10、22、29、30、53、54、60、94、100、136、137位氨基酸,发生概率:0.966、0.562、0.557、0.655、0.470、0.453、0.488、0.461、0.468、0.459、0.445。苏氨酸磷酸化位点多于丝氨酸且概率也高,由此可推测Thr磷酸化位点可能具有调控杉木Cu/Zn-SOD蛋白构象变化的作用。

图9 杉木Cu/Zn-SOD蛋白三级结构预测结果
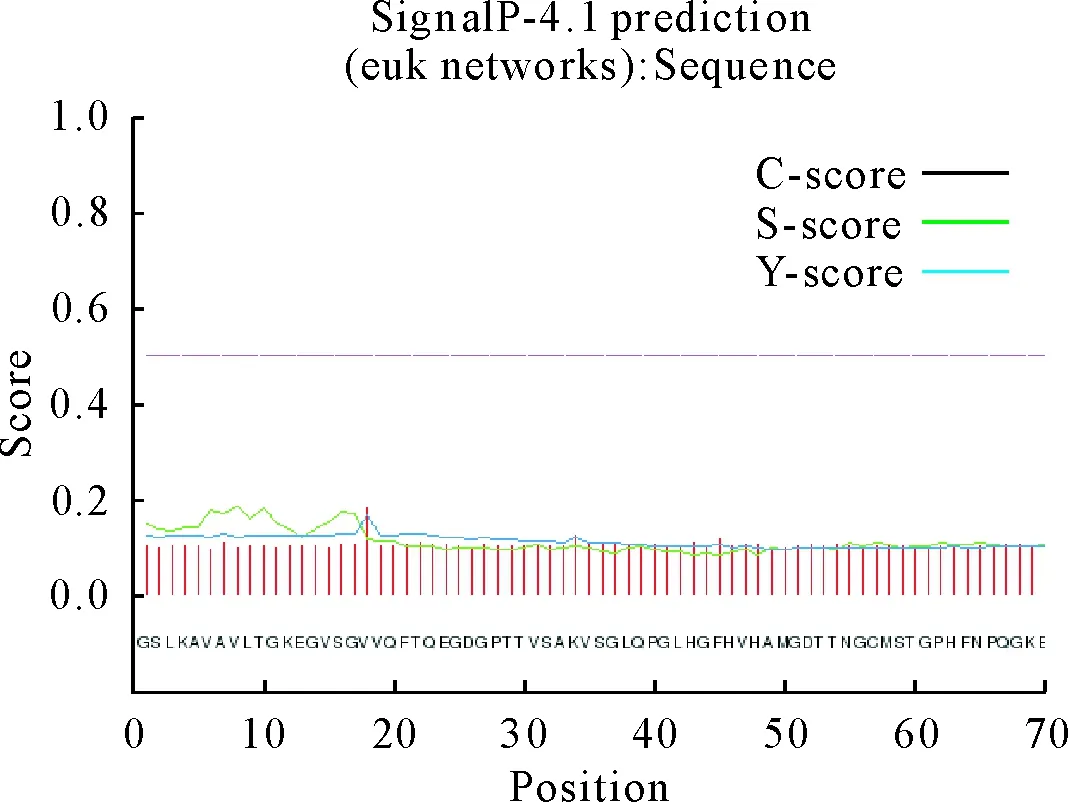
图10 杉木Cu/Zn-SOD蛋白信号肽预测

图11 杉木Cu/Zn-SOD蛋白磷酸化结构预测
2.7 杉木Cu/Zn-SOD蛋白跨膜结构预测及蛋白功能预测
根据TMHMM在线软件预测杉木Cu/Zn SOD蛋白跨膜区域(图12),能具体了解蛋白质的功能和结构等。预测总概率为0.073 41,可知该蛋白为非跨膜蛋白。利用Protfun在线软件预测杉木Cu/Zn SOD蛋白功能(表1),可知该蛋白的细胞膜、辅因子合成、翻译蛋白、转运蛋白结合、脂肪酸代谢等发挥着功能。其中具有优势功能的是辅因子合成、转运蛋白结合、翻译蛋白、嘌呤和嘧啶、脂肪酸代谢,所占优势分别为2.917、1.885、1.614、1.362、1.308,而复制和转录最低为0.075。
2.8 杉木Cu/Zn-SOD组织特异性表达分析
通过对杉木各部位进行real time-PCR分析,结果表明Cu/Zn-SOD基因在杉木的根、茎、叶中均有表达,且表达量存在显著差异(图13)。将根中的Cu/Zn-SOD基因相对表达量作为1,茎中的表达量则为根的2.76倍,叶片中的表达量为根的1.41倍。由此可知杉木Cu/Zn-SOD基因在茎部位的相对表达量最高,叶其次,根的相对表达量最低。
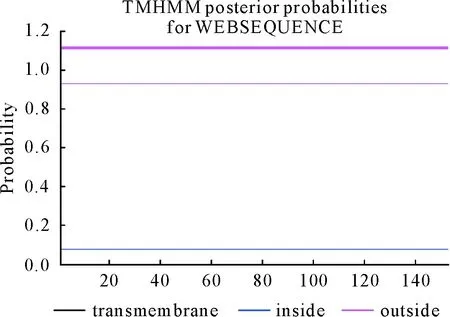
图12 杉木Cu/Zn SOD蛋白跨膜结构预测

FunctionalcategoryProbOddsAmino_acid_biosynthesis0.0110.5Biosynthesis_of_cofactors0.212.917Cell_envelope0.0330.541Cellular_processes0.030.411Central_intermediary_metabolism0.0480.762Energy_metabolism0.0350.389Fatty_acid_metabolism0.0171.308Purines_and_pyrimidines0.3311.362Regulatory_functions0.0340.211Replication_and_transcription0.020.075Translation0.0711.614Transport_and_binding=>0.7731.885

图13 杉木Cu/Zn-SOD组织特异性表达分析
3 结论与讨论
在自然环境下,植物在生长过程中产生和清除的细胞氧自由基始终保持着动态平衡,超氧化物歧化酶(SOD)具有清除自由基、维持活性氧代谢平衡的作用。当受到外界胁迫时,Cu/ZnSOD可消除H2O2导致的氧化伤害,由此表明Cu/ZnSOD在植物抗逆抗氧化伤害中具有重要作用[23,19]。Cu/ZnSOD基因的表达可影响SOD活性的变化[24],研究显示豌豆Cu/ZnSOD转化烟草后SOD活性提高了数倍[25],番茄中的叶绿体Cu/ZnSOD基因转入进烟草后与对照相比耐低温胁迫能力增强[26]。姚冉等人通过分子生物学手段从一株地热芽孢杆菌中克隆得到Cu/ZnSOD基因并转化到烟草中,结果表明,与野生型植株相比,Cu/Zn-SOD转基因烟草对盐胁迫的耐性得到显著提升[14]。本研究采用RT-PCR技术克隆获得杉木Cu/ZnSOD基因,对其进行功能结构域分析得知,Cu/ZnSOD具有Cu/Zn superoxide家族特有的典型特征序列,属于Cu/ZnSOD家族。序列分析表明,该基因具有完整的编码框,所编码的蛋白与其他植物具有很高的同源性,达88.6%,杉木Cu/ZnSOD的后9个氨基酸为VCGVIGLQG,其他物种Cu/Zn SOD的后9个氨基酸ACGIIGLQC,相比是非常保守的区域。此外,利用生物信息学软件分析杉木Cu/ZnSOD基因,结果表明克隆得到的杉木Cu/ZnSOD为胞质Cu/Zn SOD,是非跨膜亲水性稳定非分泌蛋白,与前人研究的乌桕(Sapiumsebiferum)[27]、哈密瓜(Cucumismelovar.saccharinus)[28]、甘蔗(Saccharumofficinarum)[12]、水稻(Oryzasativa)[19]、丹参(Salviamiltiorrhiza)[6]、杨梅(Myricarubra)[21]、丝瓜(Luffacylindrica)[29]、小麦(Triticumaestivum)[30]等Cu/ZnSOD跨膜结构域的预测结果类似。为进一步研究杉木Cu/ZnSOD基因在逆境中的表达和功能以及转基因等提供依据。
前人研究结果表明Cu/Zn SOD主要定位于植物绿色组织中,本研究中通过RT-PCR分析Cu/ZnSOD基因在杉木组织中的表达分析,发现Cu/ZnSOD基因在杉木根、茎、叶中均有显著表达,并具有表达部位的特异性,相对表达量在茎中最高、叶片次之,根中最少,由此验证了前人的结果。在甘蔗中,Cu/ZnSOD的组织表达特异性结果显示,在茎叶的相对表达量显著高于根的相对表达量[13]。在东方山羊豆Cu/ZnSOD基因相对表达量在叶中最多,茎中表达量居中,根中表达量最少[20]。而关于杉木Cu/ZnSOD基因的研究还处于早期,该基因在逆境胁迫中如何发挥调控作用仍不清楚,因此对于杉木Cu/ZnSOD基因的功能还需进一步研究。
参考文献:
[1] 郑仁华,施季森,翁玉榛.福建省杉木育种战略研究[J].林业科技开发,2008,22 (2):1-6.
[2] KIM K Y,SANG Y L,etal.Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc- and manganese-superoxide dismutases in disk abalone,Haliotisdiscus discus[J].Fish & Shellfish Immunology,2007,23(5):1043-1059.
[3] OGAWA K,KANEMATSU S,ADADA K.Intra and extra-cellularlocalization of cytosolic Cu / Zn-superoxide dismutase in spinachleaf and hypocotyls[J].Plant Cell Physiol,1996,37(6):790-799.
[4] CHEN H Y,LIU W Y .The molecular evolution of superoxide dismutase based on its distribution and structure[J].Prog Biochem Biophys,1996,23(5):408-413.
[5] RONALD E C,JOSEPH A W,JOHN G S.Cloning of cDNA for maize superoxide dismutase 2 (SOD2)[J].ProcNatiAcad SciUSA,1987,84:179-183.
[6] LEE H S,KIM K Y,YOU S H,etal.Molecular characteriza-tion and expression of a cDNA encoding copper/zinc super-oxide dismutase from cultured cells of cassava (ManihotesculentaCrantz) [J].Molecular Genetics and Genomics,1999,262:807-814.
[7] 纪砚耘,化文平,王喆之.丹参铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆与生物信息学分析[J].陕西师范大学学报,2011,39(3):56-61.
JI Y Y,HUA W P,WANG J Z.Cloning and bioinformatics analysis ofCu/Zn-SODgene from Salvia miltiorrhiza Bunge[J].Journal of Shanxi Normal University:Natural Science Edition,2011,39(3):56-61.(in Chinese)
[8] 杨鸯鸯,李云,丁勇,等.甘蓝型油菜Cu/Zn-SOD和FeSOD基因的克隆及菌核病菌诱导表达[J].作物学报,2009,35(1):71-78.
YANG Y Y,LI Y,YU Y,etal.Cloning of Cu/Zn-Superoxide dismutase of brassica napus and its induced expression by sclerotinia sclerotiorum[J].Acta Agronomica Sinica,2009,35(1):71-78.(in Chinese)
[9] 朱虹琳,董臣,刁英,等.莲铜锌超氧化物歧化酶cDNA的克隆和序列分析[J].武汉大学学报:理学版,2006,52(4):475-480.
[10] BOWLER C,ALLIOTTE T M,DE LOOSE M,MONTAGU M D,INZE D.Theinduction of manganese superoxide dismutase in response to stress in Nicotiana plumbaginifolia[J].The EMBO Journal,1989,8(1):31-38.
[11] KAMINAKA H,MORITA S,TOKUMOTO M,etal.Molecular cloning and characterization of a cDNA for aniron-superoxide dismutase in rice (OryzasativaL.) [J].Bioscience,Biotechnology,Biochemistry,1999,63(2):302-308.
[12] KLIEBENSTEIN D J,DIETRICH R A,MARTIN A C,etal.LSD1 regulates salicylic acid induction of copper zinc superoxidedismutase in Arabidopsis thaliana[J].Molecular Plant Microbe Interactions,1999,12(11):1022-1026.
[13] 王盛,张保青等.甘蔗Cu/Zn-SOD的克隆和表达分析[J].中国农业科学,2013,46(15):3277-3284.
WANG S,ZHANG B Q,etal.Molecular cloning of sugarcane Cu/Zn Superoxide dismutase(Cu/Zn-SOD) and its expression analysis[J].Scientia Agricultura Sinica,2013,46(15):3277-3284.(in Chinese)
[14] 姚冉,李轶女,张志芳,等.Cu/Zn-SOD基因植物表达载体的构建及其在烟草中的表达[J].生物技术通报,2012(11):78-82.
YAO R,LI Y N,ZHANG Z F,etal.Construction of plant expression vector of Cu/Zn-SOD gene and its expression in tobacco[J].Biotechnology Bulletin,2012(11):78-82.(in Chinese)
[15] MCKERSIE B D,MURNAGHAN J,JONES K S,etal.Ironsuperoxide dismutase expression in transgenic alfalfa increases winter survival without a detectable increase in photosynthetic oxidative stress tolerance[J].American Society of Plant Physiologist,2000,122(4):1427-1438.
[16] DU J,ZHU Z,LI W C.Over-expression of exotic superoxide dismutase gene MnSOD and increase in stress resistance in maize[J].Journal of Plant Physiology and Molecular Biology,2006,32(1):57-63.
[17] 张磊,叶志玮,赵晨曦,等.沙柳SpsLAZY1a和SpsLAZY1b基因克隆及生物信息学分析[J].西北林学院学报,2017,32(1):98-105.
ZHANG L,YE Z W,ZHAO C X,etal.Cloning and bioinformatics analsisi ofSpsLAZY1aandSpsLAZY1bgenes inSalixpsammophila[J].Journal of Northwest Forestry University,2017,32(1):98-105.(in Chinese)
[18] 马玉花,冶贵生,冯志鹏.柴达木盆地梭梭CMO基因的克隆及其蛋白结构预测[J].西北林学院学报,2016,31(2):115-119.
MA W H,ZHI G S,FENG Z P.Gene analysis,protein prediction of CMO of haloxylon ammodendron in Qaidam Basin[J].Journal of Northwest Forestry University,2016,31(2):115-119.(in Chinese)
[19] 王峰,王宏斌,王金发.水稻细胞铜锌超氧化物歧化酶基因的序列和表达分析[J].热带亚热带植物学报,2007,15(2):101-106.
WANG F,WANG H B,WANG J F.Sequence and expression analysis of cytoplasmic copper/zinc superoxide dismutase gene in rice[J].Journal of Tropical and Subtropical Botany,2007,15(2):101-106.(in Chinese)
[20] SHIN S Y,LEE H S,KWON S Y ,etal.Molecular characterization of a cDNA encoding copper/zinc superoxide dismutase from cultured cells of Manihot esculenta[J].Plant Physiology and Biochemisty,2005,43(1):55-60.
[21] 王芳,董乐,戴聪杰,等.杨梅Cu/Zn超氧化物歧化酶基因(MrSOD1)cDNA的克隆及表达分析[J].中国农学通报,2010,26(22):27-33.
WANG F,DONG L,DAI C J,LIN R,etal.Molecular cloning and expression analysis of Cu/Zn superoxide dismutase gene(MrSOD1) cDNA fromMyricarubra[J].Chinese Agricultural Science Bulletin,2010,26(22):27-33.(in Chinese)
[22] 李玉坤,王学敏,高洪文,等.东方山羊豆Cu/ZnSOD基因的克隆及表达分析[J].遗传,2012,34(1):95-101.
LI Y K,WANG X M,GAO H W,etal.Cloning and expression analysis ofCu/ZnSODgene fromGalegaorientalisL.[J].Hereditas(Beijing),2012,34(1):95-101.(in Chinese)
[23] 陈鸿鹏,谭晓凤.超氧化物歧化酶(SOD)研究综述[J].经济林研究,2007,25(1):59-65.
CHENG H P,TAN X F.Literature review of researches on superoxide dismutase[J].Nonwood Forest Research,2007,25(1):59-65.(in Chinese)
[24] 郭春兰,张露.油茶SOD基因片段克隆及序列分析[J].草业科学,2012,29(3):417-421.
GUO C L,ZHANG L.Cloning and sequence analysis of SOD gene ofCamelliaoleifera[J].Pratacul Tural Science,2012,29(3):417-421.(in Chinese)
[25] GUPTA A S,HEINEN J L,HOLADAY A S,etal.IncreasedResistance to oxidative stress in transgenic plantsthat overexpress chloroplastic Cu,Zn superoxide dismutase[J].Proc Natl Acad Sci USA,1993,90:1629-1633.
[26] 曲妍妍.番茄叶绿体LesAPX和Cu/Zn的克隆及功能分析[D].济南:山东农业大学,2008.
[27] 牛蓓,宋君,符佳.乌桕Cu/Zn超氧化物歧化酶基因克隆及耐盐性[J].四川师范大学学报:自然科学版,2016,39(5):743-749.
Niu B,SONG J,FU J.Cloning and salt-tolerance analysis ofSsCu/ZnSODgene from sapium sebiferum[J].Journal of Sichuan Normal University:Natural Science,2016,39(5):743-749.(in Chinese)
[28] 马伟荣,单春会,童军茂.哈密瓜铜锌超氧化物歧化酶(Cu/Zn-SOD)基因的克隆及生物信息学分析[J].生物工程,2014,35(13):181-189.
MA W R,SHAN C H,TONG J M.Cloning and bioinformatics analysis ofCu/Zn-SODgene from cantaloupe[J].Science and Technology of Food Industry,2014,35(13):181-189.(in Chinese)
[29] 朱海生,刘建汀,陈敏氡.丝瓜铜锌超氧化物歧化酶Cu/Zn-SOD基因家族的克隆与表达分析[J].中国农业科学,2017,50(17):3386-3399.
ZHU H S,LIU J T,CHENG M A.Cloning and expression analysis of copper and zinc superoxide dismutaseCu/Zn-SODgene family fromLuffacylindrical[J].Scientia Agricultura Sinica,2017,50(17):3386-3399.(in Chinese)
[30] 孙双燕,李东方,张团.小麦SOD基因的电子克隆及生物信息学分析[J].河南科技学院学报:自然科学版,2014,42(4):7-10.
SUN S Y,LI D F,ZHANG T.Genes in silico cloning and bioinformatics analysis ofSODin common wheat[J].Journal of Henan Institute of Science and Technology:Natural Sciences Edition,2014,42(4):7-10.(in Chinese)

