血清HMGB-1及PCT对食管癌患者手术后感染病情的评估效果研究
齐晓轩 黄建伟 高克峰 高 青 张凯悦
牡丹江医学院附属红旗医院,黑龙江牡丹江 157000
食管癌是最常见的恶性肿瘤之一,主要发生于食管上皮组织,包括食管鳞状细胞癌和食管鳞癌两种病理类型。近年来,我国食管癌发病率呈逐年上升趋势,位居所有肿瘤发病率的第五位,且存在发病年龄年轻化的趋势[1]。根治性手术切除是目前食管癌患者的主要治疗方式,但术后医院感染发生率仍居高不下,是导致食管癌术后死亡的主要原因之一[2]。如何准确评估术后感染严重程度是摆在当前急需解决的问题之一。临床上常采用急性生理与慢性健康状况(APACHEⅡ)评分系统评估病情程度,但由于其评定需要一定的时机,导致其无法快速评估病情进展程度[3]。为了寻找食管癌患者手术后感染病情评估的快速指标,本研究探讨血清高迁移率族蛋白-1(high mobility group protein-1,HMGB-1)及降钙素原(procalcitonin,PCT)对食管癌患者手术后感染病情的评估效果,现报道如下。
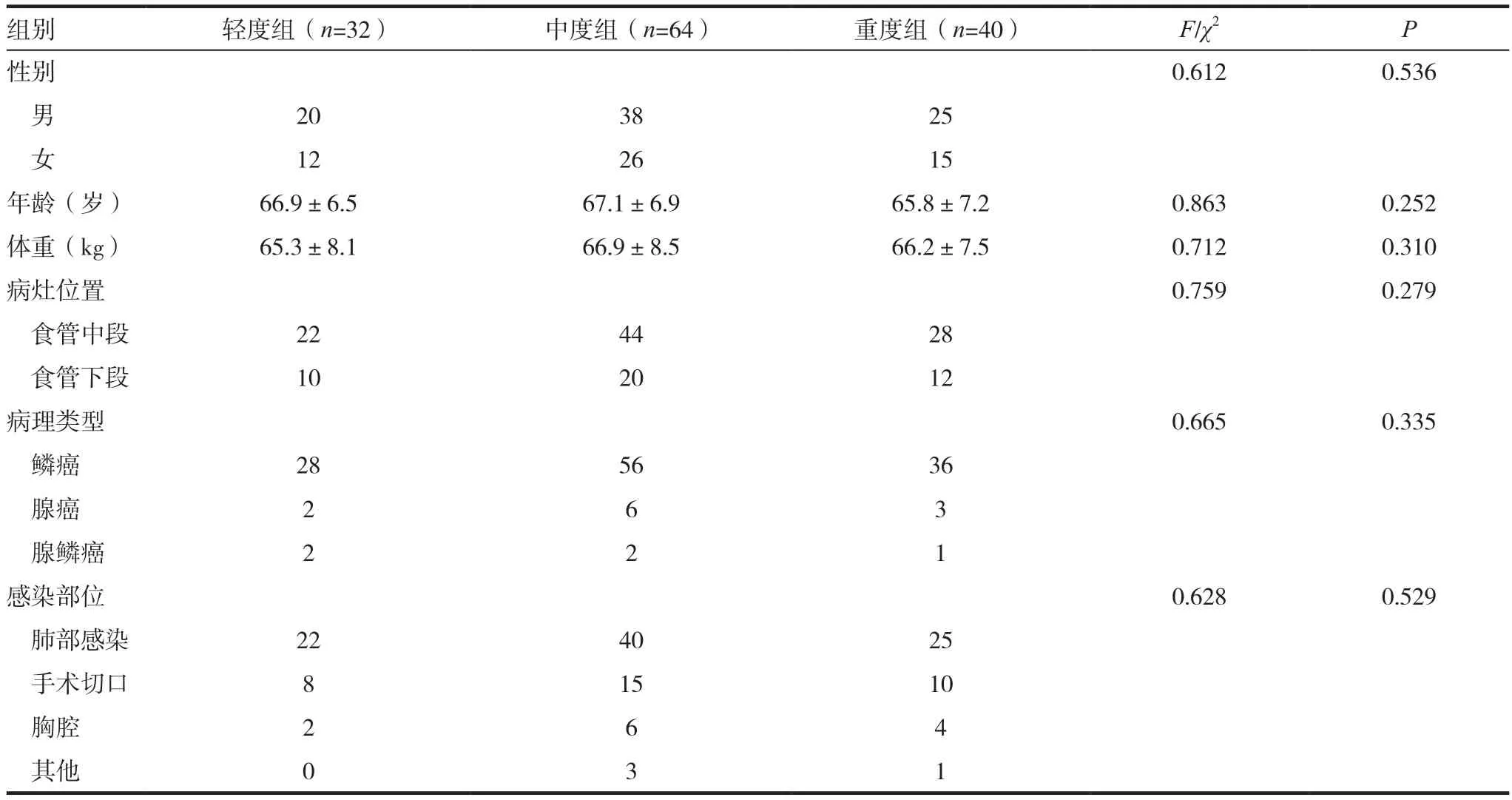
表1 三组患者一般资料
1 资料与方法
1.1 一般资料
选取我院2017年2月~2018年5月收治的行根治性手术切除治疗后发生医院感染的食管癌患者136例为研究对象。依据APACHEⅡ评分评估病情程度,分为轻度组(APACHEⅡ评分10~29分,n=32)、中度组(APACHEⅡ评分30~49分,n=64)和重度组(APACHEⅡ评分50~71分,n=40)。3组患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 纳入标准及排除标准
纳入标准:病理结果证实为食管癌;完成根治性手术切除治疗;术后感染符合《医院感染诊断标准》[4];知情同意。排除标准:存在获得免疫缺陷综合征、系统性红斑狼疮等;术前合并消化系统、心血管系统、泌尿系统等部位感染;长期应用糖皮质激素和(或)免疫抑制剂者;妊娠或哺乳期妇女。
1.3 研究方法
患者入院后24h和感染确诊后24h内,采集静脉血5mL,离心获得血清,以ELISA法检测降钙素原(PCT),试剂盒为武汉明德生物科技股份有限公司提供;以双抗体夹心法检测高迁移率族蛋白-1(HMGB-1),试剂盒为上海康朗生物科技有限公司提供。
1.4 统计学方法
采用SPSS22.0统计学软件进行数据分析。正态计量数据用()表示,计数资料采用[n(%)]表示;两组独立,正态,方差齐资料组间比较采用t检验,多组比较采用方差分析;样本率的比较采用χ2检验。相关性分析采用Spearman直线相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 感染前后血清HMGB-1和PCT水平
136例食管癌患者感染后血清HMGB-1和PCT分别为(22.89±8.31)μg/L 和(3.96±1.02)μg/L,均高于感染前,差异有统计学意义(P<0.05)。见表2。
表2 136例食管癌患者感染前后血清 HMGB-1和PCT水平(±s ,μg/L)
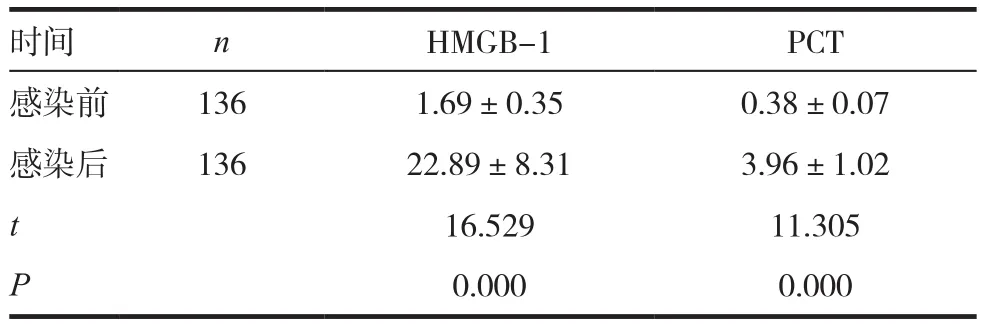
表2 136例食管癌患者感染前后血清 HMGB-1和PCT水平(±s ,μg/L)
时间 n HMGB-1 PCT感染前 136 1.69±0.35 0.38±0.07感染后 136 22.89±8.31 3.96±1.02 t 16.529 11.305 P 0.000 0.000
2.2 不同病情患者血清HMGB-1和PCT水平
轻度组、中度组和重度组患者血清HMGB-1和PCT水平比较存在显著性差异(P<0.05),中度组和重度组高于轻度组,且重度组高于中度组(P<0.05)。见表3。
表3 不同病情患者血清HMGB-1和PCT水平(±s ,μg/L)

表3 不同病情患者血清HMGB-1和PCT水平(±s ,μg/L)
注:与轻度组比较,*P<0.05;与中度组比较,▲P<0.05
组别 轻度组(n=32) 中度组(n=64) 重度组(n=40) F P HMGB-1 11.36±3.25 20.26±5.81* 29.75±9.38*▲ 15.235 0.000 PCT 2.55±0.85 3.87±0.98* 4.46±1.35*▲ 10.753 0.000
2.3 相关性分析
Spearman直线相关性分析显示,感染后血清HMGB-1(r=0.681)和 PCT(r=0.692)水平与APACHEⅡ评分均呈明显正相关性(P<0.05)。见图1和图2。
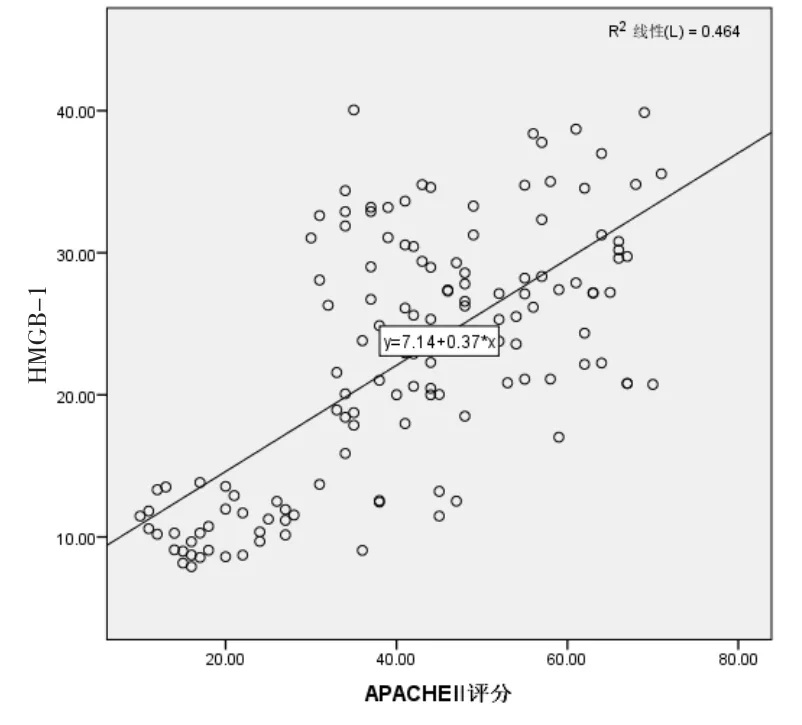
图1 血清HMGB-1水平与APACHEⅡ评分的相关性分析
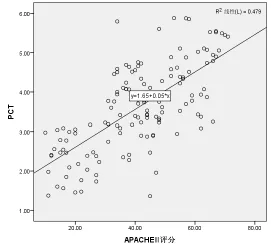
图2 血清PCT水平与APACHEⅡ评分的相关性分析
3 讨论
目前,医学界对早、中期食管癌患者普遍采用以手术为主,辅以放疗和化疗的综合治疗方法;对晚期食管癌患者则采用以化疗、放疗为主,结合手术的综合治疗[5-6]。对于存在食管切除适应证的食管癌患者,外科手术切除食管,术中区域淋巴结清扫并重建消化道依旧是目前经典外科手术治疗方法。目前常用手术方式有经腹右胸(Ivor-Lewis)、开胸(左侧开胸)(TTE)、颈右胸腹三切口食管癌切除术、食管内置管术、经食管裂孔食管癌切除术、胃或空肠造口术、食管内翻拔脱术、胃食管分流术等姑息性手术[7-8]。
PCT是一种无激素活性的糖蛋白,一般情况下,PCT主要由甲状腺C细胞产生,健康人血清中PCT的含量极少,当机体受到严重感染时,其他的器官和组织也可分泌PCT[9]。与其他细胞因子不同,PCT的诱导受到严格的调节,在此过程中细胞间的接触发挥十分重要的作用,在高浓度感染因素等刺激机体后使粘附单核细胞分泌PCT,而血液中的单核细胞几乎不分泌PCT,这种严格的调节使得PCT成为一种具有高特异性的感染性标志物,其血清水平与疾病的严重程度表现出良好的相关性[10-11]。当发生严重细菌感染时,血清中PCT浓度增高,而其值在病毒感染或非感染性的炎症反应不增加或仅轻中度的增加[12]。本研究结果显示,食管癌术后感染患者血清PCT水平明显上升,且轻度组、中度组和重度组患者血清PCT水平比较差异有统计学意义(P<0.05),中度组和重度组高于轻度组,且重度组高于中度组(P<0.05),提示血清PCT水平对食管癌患者术后感染具有一定的预测价值,且与病情相关,这与多数文献[13-14]报道结果一致。
HMGB-1是一种高度保守核蛋白和炎症免疫分子,广泛分布在肺、肝、脑等细胞质和细胞核中,在细胞的坏死和凋亡过程中具有重要调节作用[15]。在炎性反应早期,坏死细胞在内毒素、肿瘤坏死因子和白细胞介素等刺激下合成并释放HMGB-1,从而诱导中性粒细胞趋化,造成内皮细胞通透性增加,加剧组织局部水肿[16]。此外,HMGB-1也可作为炎性介质发挥信号传导和信号放大作用,参与机体感染和血栓形成过程[17-18]。有研究发现,外科手术感染患者血清 HMGB-1水平明显上升,且与病情严重程度呈正相关关系[19-20]。本研究结果显示,食管癌术后感染患者血清HMGB-1水平明显上升,且轻度组、中度组和重度组患者血清HMGB-1水平比较差异有统计学意义(P<0.05),中度组和重度组高于轻度组,且重度组高于中度组(P<0.05),提示血清HMGB-1水平对食管癌患者术后感染具有一定的预测价值,有助于评估感染严重程度。
综上所述,检测血清HMGB-1和PCT水平可有效评估食管术后感染患者感染程度,对于指导临床治疗,争取最佳的治疗时机,具有十分重要的作用。由于本研究样本数量有限,且为单中心研究,该研究结论尚需进一步论证分析。

