苦马豆素对胶质瘤细胞U87凋亡及HSP90/AKT通路的影响
童军卫,刘补兴,胡小铭,李 烨,刘正敏,蔡清风*
0 引言
胶质瘤(Glioma)是源自神经上皮的恶性肿瘤,是颅内发病率和致死率最高的恶性肿瘤,其发病机制尚不清楚[1]。目前,手术、放疗、化疗是恶性肿瘤治疗的主要手段,然而胶质瘤生长迅速,呈浸润性生长,手术治疗难以切除癌变组织,而且放疗和化疗药物毒副作用大,容易产生耐药性。因此,采用安全有效的药物治疗胶质瘤已经成为研究的热点问题。近年来,植物来源的药物已经广泛应用于肿瘤的治疗中。苦马豆素(Swainsonine,SW)是澳洲学者Colegate从灰苦马豆(Swainsonacanescens)分离得到的主要提取成分,苦马豆素作为抗癌天然小分子药物,被广泛应用于食道癌、胃癌和肝癌的基础研究中[2-4]。研究表明,苦马豆素能够抑制肿瘤细胞生长转移、诱导细胞凋亡,同时还能提高机体免疫力,增强对肿瘤细胞的抵抗能力[5]。然而苦马豆素对胶质瘤细胞U87凋亡及其相关作用机制方面的研究尚未见报道。本研究旨在利用人胶质瘤细胞系U87,阐明苦马豆素对胶质瘤细胞U87凋亡及HSP90/AKT通路的影响,以探究苦马豆素抗肿瘤作用的潜在分子机制,为胶质瘤靶向药物的开发及临床治疗提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 人口胶质瘤细胞U87由第四军医大学唐都医院神经外科提供。
1.1.2 主要试剂及仪器 苦马豆素购自陕西杨陵大正生物技术有限公司。RNA提取试剂盒和反转录试剂盒购自天根生化科技有限公司;TaqDNA聚合酶购自NEB公司;鼠抗人caspase 3多克隆抗体、鼠抗人HSP90多克隆抗体和鼠抗人AKT多克隆抗体购自武汉博士德生物工程有限公司;BD-FAC Scan流式细胞仪购自美国BD公司;3K15超低温离心机购自德国Sigma公司;SW-CJ-2D2G2F2FD双人净化工作台购自苏州苏净;引物序列由苏州金唯智生物科技有限公司合成。
1.2 方法
1.2.1 细胞培养及分组 将购买的U87细胞解冻复苏,按1×106/mL接种于DMEM(dulbecco′s modified eagle medium)培养基中[10%胎牛血清(FBS,Life Technologies),100 U/mL青霉素和100 mg/mL链霉素],置于37 ℃ 5%CO2的潮湿培养箱中培养5 d。全量更换DMEM培养基,调整细胞数目为1×106/mL接种于24孔细胞培养板(100 μL/孔),分别加入苦马豆素使无血清培养基中苦马豆素的含量分别为0、4、8、12 μg/mL,依次命名为对照组、苦马豆素低剂量组、苦马豆素中剂量组、苦马豆素高剂量组,每组重复6孔。培养48 h。
1.2.2 U87细胞形态变化比较 培养48 h后弃去培养液,将各组细胞用磷酸盐缓冲盐水(PBS)洗涤2~3次后,加入0.125%胰蛋白酶消化2~3 min,加入75%乙醇固定细胞,置于4 ℃下过夜,次日弃去乙醇后,用PBS漂洗细胞2~3次。加入0.5 mL胶质纤维酸性蛋白,于倒置显微镜下观察细胞形态。
1.2.3 流式细胞术检测细胞凋亡 培养结束后,用PBS洗涤细胞2~3次后,用胰蛋白酶消化细胞2~3 min,加入75%乙醇于4 ℃下过夜固定细胞,用PBS漂洗细胞,置于超低温离心机2 000 r/min离心10 min,弃去上清,此过程重复2~3次;加入10 μL RNA酶在37 ℃下孵育30 min,用10 μL PI进行染色,然后在黑暗中4 ℃孵育30 min。使用BD-FAC Scan流式细胞仪进行数据采集和分析。使用ModFit LT软件进行凋亡细胞百分比计算。
1.2.4 qRT-PCR检测caspase 3、HSP90、AKT基因表达情况 离心收集各组U87细胞,用RNA提取试剂盒提取总RNA,用反转录试剂盒将RNA反转呈cDNA。然后根据NCBI上提交caspase 3、HSP90、AKT的cDNA序列设计引物。caspase 3:上游引物F:5′-GGAAGCGAATCAATGGACTC-3′,下游引物R:5′-CTCAGAAGCACACAAACAAAA-3′;HSP90:上游引物F:5′-GGAATTGGAATGACCAAGGC-3′,下游引物R:5′-AGCAGAATGTGACTCGAGCA-3′;AKT:上游引物F:5′-CGGCAGGACCGAGC-3′,下游引物R:5′-TTGAAGAATTTGGAGGGAAGG-3′,进行qRT-PCR,同时以GAPDH为内参。PCR的反应体系为:5X缓冲液10 μL,TaqDNA聚合酶1 μL,上游引物F 2 μL,下游引物R 2 μL,10 mmol dNTP mix 1 μL,cDNA 1 μL,ddH2O 33 μL;PCR的反应条件为:预变性:95 ℃ 5 min,变性:95 ℃ 30 s,延伸:63 ℃ 15 s(caspase 3、HSP90、AKT和GAPDH),40个循环,延伸时读取光密度(D)值。采用最大二阶导数法(2-△△Ct)对数据进行统计。△△Ct=(实验组目的基因Ct平均值-实验组内参基因Ct平均值)-(对照组目的基因Ct平均值-对照组内参基因Ct平均值)。
1.2.5 Western blot检测caspase 3、HSP90、AKT蛋白表达情况 培养48 h后收集细胞,按每1×106个细胞加入0.5 mL细胞裂解液[150 mmoL/L NaCl,1.0% NP-40,0.5%脱氧胆酸钠,0.1% SDS,50 mmoL/L Tris(pH 8.0)]提取细胞总蛋白,以GAPDH为内参,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),每孔上样体积20 μL,电泳结束后,半干转膜仪转膜50 min,分别滴加鼠抗人caspase 3、HSP90、AKT多克隆抗体,置于4 ℃下过夜,滴加二抗,37 ℃放置1 h。加入ECL发光剂进行显影,利用自动凝胶成像系统采集图像。

2 结果
2.1 U87细胞形态变化比较 培养48 h后,对照组U87细胞形态多样,大小不一,胞体上有突起,向周围延伸,且染色质均匀分布,结果见图1a;苦马豆素组细胞的数量明显减少,细胞稀疏生长,细胞和细胞核体积明显缩小,细胞质浓缩,细胞内染色质固缩,有的细胞出现凋亡小体;且随着苦马豆素剂量的增加,U87细胞形态变化越明显,结果见图1b~图1d。

图1 苦马豆素对U87细胞形态的影响
2.2 流式细胞术检测细胞凋亡 胶质瘤细胞U87经不同浓度苦马豆素(4、8、12 μg/mL)处理后,苦马豆素中剂量组和苦马豆素高剂量组细胞凋亡率明显高于对照组,差异有统计学意义(P<0.05),且随着苦马豆素剂量增加,U87细胞的凋亡率增加,呈现剂量依赖性,结果见图2。

图2 苦马豆素对U87细胞凋亡的影响
注:与对照组比较,*P<0.05;与苦马豆素低剂量组比较,#P<0.05;与苦马豆素中剂量组比较,△P<0.05
2.3 qRT-PCR检测caspase 3、HSP90、AKT基因表达情况 胶质瘤细胞U87经不同浓度苦马豆素(4、8、12 μg/mL)处理后,苦马豆素中剂量组和苦马豆素高剂量组caspase 3 mRNA的表达水平明显高于对照组,差异有统计学意义(P<0.05),且随着苦马豆素剂量增加,caspase 3 mRNA的表达水平显著提高,呈现剂量依赖性,结果见图3。
胶质瘤细胞U87经不同浓度苦马豆素(4、8、12 μg/mL)处理后,苦马豆素中剂量组和苦马豆素高剂量组HSP90 mRNA、AKT mRNA的表达水平明显低于对照组,差异有统计学意义(P<0.05),且随着苦马豆素剂量增加,HSP90 mRNA、AKT mRNA的表达水平显著降低,呈现剂量依赖性,结果见图4。
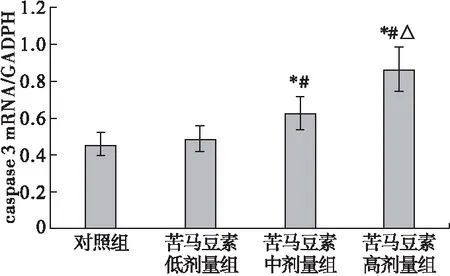
图3 qRT-PCR检测caspase 3基因表达情况
注:与对照组比较,*P<0.05;与苦马豆素低剂量组比较,#P< 0.05;与苦马豆素中剂量组比较,△P<0.05

图4 qRT-PCR检测HSP90、AKT基因表达情况
注:与对照组比较,*P<0.05;与苦马豆素低剂量组比较,#P< 0.05;与苦马豆素中剂量组比较,△P<0.05
2.4 Western blot检测caspase 3、HSP90、AKT蛋白表达情况 胶质瘤细胞U87经不同浓度苦马豆素(4、8、12 μg/mL)处理后,苦马豆素中剂量组和苦马豆素高剂量组caspase 3蛋白的表达水平明显高于对照组,差异有统计学意义(P<0.05),且随着苦马豆素剂量增加,caspase 3蛋白的表达水平显著提高,呈现剂量依赖性,结果见图5。
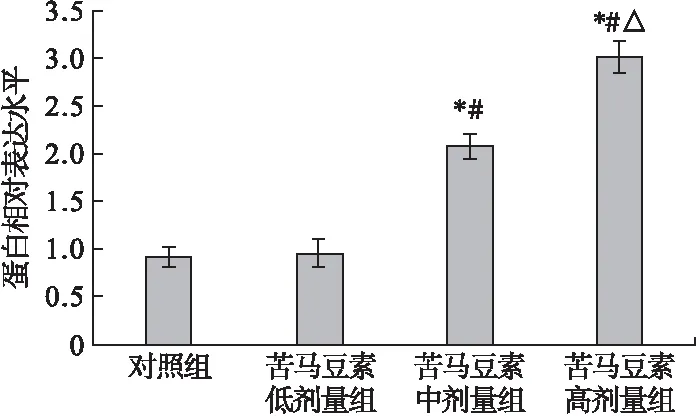
图5 Western blot检测caspase 3蛋白表达情况
注:与对照组比较,*P<0.05;与苦马豆素低剂量组比较,#P< 0.05;与苦马豆素中剂量组比较,△P<0.05
胶质瘤细胞U87经不同浓度苦马豆素(4、8、12 μg/mL)处理后,苦马豆素中剂量组和苦马豆素高剂量组HSP90、AKT蛋白的表达水平明显低于对照组,差异有统计学意义(P<0.05),且随着苦马豆素剂量增加,HSP90、AKT蛋白的表达水平显著降低,呈现剂量依赖性,结果见图6。
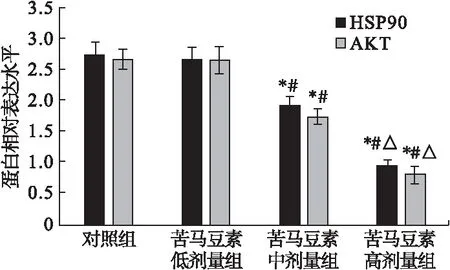
图6 Western blot检测HSP90、AKT蛋白表达情况
注:与对照组比较,*P<0.05;与苦马豆素低剂量组比较,#P< 0.05;与苦马豆素中剂量组比较,△P<0.05
3 讨论
苦马豆素是从植物中提取的一种吲哚里西啶生物碱,具有突出的抗肿瘤作用。研究表明,苦马豆素通过抑制肿瘤细胞表面糖蛋白的表达,进而抑制肿瘤细胞的生长和转移,诱导癌细胞凋亡[6-7]。Dennis[8]研究表明,苦马豆素能够抑制结肠肿瘤的生长。Seftor等[9]研究表明,苦马豆素可以抑制肿瘤细胞Ⅳ型胶原酶的表达,阻止肿瘤细胞浸润、转移。吴达等[10]研究表明,低浓度的苦马豆素就可以诱导肿瘤细胞相关基因上调或下调表达,进而诱导肿瘤细胞凋亡,苦马豆素还可以通过诱导内质网凋亡途经实现人胃癌细胞SGC-7901、人食道癌Eca-109细胞、肝癌细胞等的凋亡[11]。You等[12]研究表明,苦马豆素能促进肝癌细胞HepG2凋亡,de-Freitas-Junior等[13]研究表明,苦马豆素能促进结肠癌HTC-116细胞凋亡。以上结果证实,苦马豆素能抑制肿瘤细胞的生长和转移、诱导癌细胞凋亡。本研究表明,苦马豆素会引起胶质瘤细胞U87形态的变化,诱导细胞凋亡,且随着苦马豆素剂量的增加,U87细胞的凋亡率显著增加,与上述研究结果一致。
半胱氨酸天冬氨酸蛋白水解酶(Cysteinyl aspartate specific proteinase,caspase)家族与细胞凋亡密切相关,细胞凋亡的关键是caspase被激活,当caspase的活性受到抑制时,就会引起肿瘤的发生[14-15]。caspase家族有16个成员,caspase 3是凋亡的主要参与成分。caspase 3能特异性切割DNA,使染色质凝聚、核酸酶激活,进而导致细胞凋亡。郑爱秋等[16]研究表明,caspase 3在癌组织中通过促进癌细胞凋亡而使恶性程度降低;Hay等[17-18]研究表明,重组蛋白IAP可以下调caspase 3或caspase 7的表达,阻止细胞凋亡;然而苦马豆素对胶质瘤细胞U87中caspase 3表达水平的影响尚未见报道。本研究表明,胶质瘤细胞U87经苦马豆素处理后,caspase 3表达水平升高,且随着苦马豆素剂量增加,caspase 3表达水平显著提高,呈剂量依赖性,进一步证实苦马豆素能够诱导胶质瘤细胞U87的凋亡。
热休克蛋白(Heat shock protein 90,HSP90)作为一种分子伴侣能够参与各种信号转导通路,如细胞生长、周期调控和细胞存活等,并与通路中的关键分子相互作用,通过与底物蛋白活性部位的结合,使其维持正常的功能[19]。近年研究表明,运用HSP90抑制剂,可以提高细胞的凋亡率,提示HSP90能够促进细胞存活、抑制细胞凋亡[20]。丝氨酸苏氨酸蛋白激酶(Serine threonine kinase,AKT)是原癌基因v-Akt的同源物,参与caspase 3的活化[21]。AKT能够参与许多细胞的信号转导通路,如:PI3K/AKT、DNA-PKcs/Akt、Epac/Akt等,这些信号通路与细胞的生长、细胞周期以及调控细胞凋亡等密切相关,且AKT是信号转导通路中的关键蛋白。AKT是HSP90的底物蛋白,研究表明,HSP90能够与AKT结合,阻止AKT的去磷酸化,保护AKT的活性功能不丧失[22]。Shaknovich等[23]研究表明,AKT的活化需要AKT与HSP90及伴侣分子Cdc37组成复合物,HSP90的伴侣功能对于维持该复合体的存在至关重要。Li等[24]研究表明,HSP90/Akt信号通路能够诱导脓毒症小鼠心肌细胞中caspase 3的活化,进而诱导心肌细胞的凋亡;Gong等[25]研究表明,海兔素通过抑制HSP90/Akt信号通路中相关蛋白(HSP90和Akt)的表达水平,进而诱导胶质瘤细胞GL26凋亡;Maria等[26]研究表明,用HSP90和Akt抑制剂靶向抑制信号通路PI3K/Akt/HSP90,可以促进人胃癌细胞凋亡。以上研究均提示,HSP90/Akt信号通路与细胞凋亡密切相关。虽然国内外对HSP90、AKT及HSP90/AKT信号通路方面均进行了初步研究,但是苦马豆素对于胶质瘤细胞HSP90/AKT信号通路的影响尚未见报道。本研究表明,苦马豆素能够抑制HSP90/AKT信号通路中HSP90和AKT蛋白的表达,促进胶质瘤细胞的凋亡,且随着苦马豆素剂量增加,胶质瘤细胞U87凋亡水平显著升高,呈剂量依赖性,推测苦马豆素促进胶质瘤细胞U87凋亡的机制是通过抑制HSP90/AKT信号通路的活性来实现的。
综上所述,苦马豆素能够抑制HSP90/AKT信号通路中HSP90和AKT蛋白的表达,促进胶质瘤细胞U87凋亡,为胶质瘤的临床治疗和胶质瘤靶向药物的开发提供一定的理论基础。
参考文献:
[1] 李三中.Notch信号途径在胶质瘤发病机制中的作用研究[D].第四军医大学,2013.
[2] 赵宝玉,陈绍淑,莫重辉,等.苦马豆素的提取分离及其抗肿瘤活性研究[J].毒理学杂志,2005,19(3):252.
[3] 孙纪元,朱妙章,王四旺,等.苦马豆素诱导人胃癌细胞SGC-7901凋亡作用机制的实验研究[J].中国新药杂志,2006,15(3):197-201.
[4] You N,Liu W,Wang T,et al.Swainsonine inhibits growth and potentiates the cytotoxic effect of paclitaxel in hepatocellular carcinoma in vitro and in vivo[J].Oncol Rep,2012,28(6):2091-2100.
[5] 刘巍,张晓彬,李雅,等.苦马豆素的抑瘤和免疫增强作用[J].西北药学杂志,2006,21(6):258-260.
[6] 路浩,王建军,孙莉莎,等.苦马豆素抗肿瘤作用研究进展[J].动物医学进展,2009,30(9):87-90.
[7] 刘炳亚,刘言箴,尹浩然,等.苦马豆素抑制胃癌生长及转移的实验研究[J].中华肿瘤杂志,1999,20(3):168-170.
[8] Dennis JW.Effects of swainsonine and polyinosinic:polycytidylic acid on murine tumor cell growth and metastasis[J].Cancer Res,1986,46(10):5131-5136.
[9] Seftor RE,Seftor EA,Grimes WJ,et al. Human melanoma cell invasion is inhibited in vitro by swainsonine and deoxymannojirimycin with a concomitant decrease in collagenase IV expression[J].Melanoma Res,1991,1(1):43-54.
[10]吴达.甘肃棘豆生物碱抗肝癌活性及其对荷瘤小鼠免疫功能影响的研究[D].西北农林科技大学,2010.
[11]李兆才.苦马豆素诱导A549细胞和Eca-109细胞凋亡的信号转导通路研究[D].西北农林科技大学,2012.
[12]You N,Liu W,Wang T,et al.Swainsonine inhibits growth and potentiates the cytotoxic effect of paclitaxel in hepatocellular carcinoma in vitro and in vivo[J].Oncol Rep,2012,28(6):2091-2100.
[13]de-Freitas-Junior JC,Bastos LG,Freire-Neto CA,et al.N-glycan biosynthesis inhibitors induce in vitro anticancer activity in colorectal cancer cells[J].J Cell Biochem,2012,113(9):2957-2966.
[14]陈彦灵,童坦君.细胞调亡是半胱天冬酶参与的复杂过程[J].生命的化学,2000,20(2):76-79.
[15]梁凤书.细胞凋亡与肝疾病[J].云南中医中药杂志,2001,22(1):41-42.
[16]郑爱秋,陈云波,徐经纬,等.Survivin和Caspase-3在人类大肠腺瘤及大肠癌中的表达以及与凋亡的关系[J].中国实验诊断学,2006,10(12):1402-1405.
[17]Hay BA,Wassarman DA,Rubin GM.Drosophila homologs of baculovirus inhibitor of apoptosis proteins function to block cell death[J].Cell,1995,83(7):1253-1262.
[18]Duckett CS,Nava VE,Gedrich RW,et al.A conserved family of cellular genes related to the baculovirus iap gene and encoding apoptosis inhibitors[J].EMBO J,1996,15(11):2685-2694.
[19]Chen JX,Meyrick B.Hypoxia increases Hsp90 binding to eNOS via PI3K-Akt in porcine coronary artery endothelium[J].Lab Invest,2004,84(2):182-190.
[20]Tamaki K,Otaka M,Takada M,et al.Evidence for enhanced cytoprotective function of HSP90-overexpressing small intestinal epithelial cells[J].Dig Dis Sci,2011,56(7):1954-1961.
[21]Datta SR,Dudek H,Tao X,et al.Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.
[22]Pim D,Massimi P,Dilworth SM,et al.Activation of the protein kinase B pathway by the HPV-16 E7 oncoprotein occurs through a mechanism involving interaction with PP2A[J].Oncogene,2005,24(53):7830-7838.
[23]Shaknovich R,Shue G,Kohtz DS.Conformational activation of a basic helix-loop-helix protein (MyoD1) by the C-terminal region of murine HSP90 (HSP84)[J].Mol Cell Biol,1992,12(11):5059-5068.
[24]Li X,Luo R,Jiang R,et al.The role of the Hsp90/Akt pathway in myocardial calpain-induced caspase-3 activation and apoptosis during sepsis[J].BMC Cardiovasc Disord,2013,13:8.
[25]Gong AJ,Gong LL,Yao WC,et al.Aplysin induces apoptosis in glioma cells through HSP90/AKT pathway[J].Exp Biol Med (Maywood),2015,240(5):639-644.
[26]Redlak MJ,Miller TA.Targeting PI3K/Akt/HSP90 signaling sensitizes gastric cancer cells to deoxycholate-induced apoptosis[J].Dig Dis Sci,2011,56(2):323-329.

