蒲地蓝消炎口服液黄芩苷与菊苣酸含量测定方法的优化
济川药业集团有限公司,江苏 泰兴 225440
蒲地蓝消炎口服液由蒲公英、苦地丁、板蓝根、黄芩等四味中药按相应比例配伍,经过现代提取工艺提取并配制而成的纯中药口服制剂,具有清热解毒,消肿利咽的功效,主要用于疖肿、腮腺炎、咽炎、扁桃体炎的治疗[1-2]。研究表明,蒲地蓝消炎口服液对小儿手足口病[3-4]、上呼吸道感染[5-6]也具有良好的临床治疗效果,有“天然抗生素”的美称。
黄芩苷为黄芩中的主要有效成分,具有抗菌、抗病毒、清除氧自由基、解热、镇静、调节免疫等作用[7-8];菊苣酸为方中君药蒲公英中的一种酚酸类化合物,具有抗菌、抗病毒、提高免疫力、抗炎、抗氧化等作用[9-11]。2015年版《中国药典》中分别采用两种方法对产品中的黄芩苷、菊苣酸的含量进行了测定,该方法由于检测耗时较长,不利于生产过程中对产品进行质量控制,研究欲建立一种同时测定黄芩苷和菊苣酸含量的测定方法,以缩短中间体检测时间,提高检测效率。
1 仪器与材料
1.1仪器20AT型液相色谱仪(日本岛津);XS205型电子分析天平(Mettler)。
1.2材料黄芩苷对照品(批号:110715-201016,含量以94%计)、菊苣酸对照品(批号:111752-200902,含量以99.9%计)均购于中国食品药品检定研究院;蒲地蓝消炎口服液(济川药业集团有限公司);乙腈、甲醇均为色谱纯,磷酸为分析纯,均购于国药集团化学试剂有限公司。
2 方法与结果
2.1溶液的制备
2.1.1对照品溶液的制备精密称取黄芩苷对照品48.18 mg,置25 mL量瓶中,加甲醇至刻度,摇匀,作为黄芩苷储配液;精密量取黄芩苷储配液8 mL、4 mL、2 mL、1 mL、0.5 mL,分别置10 mL量瓶中,用甲醇依次稀释成不同浓度的黄芩苷系列溶液,备用。精密称取菊苣酸对照品13.7 mg,置100 mL量瓶中,加乙腈-水(20∶80)至刻度,摇匀,作为菊苣酸储配液;精密量取菊苣酸储配液10 mL、7.5 mL、4 mL、2 mL、1 mL,分别置25 mL量瓶中,用乙腈-水(20∶80)依次稀释成不同浓度的菊苣酸系列溶液,备用。
2.1.2供试品溶液的制备精密量取蒲地蓝消炎口服液5 mL,置50 mL量瓶中,加乙腈-水(20∶80)稀释至刻度,摇匀,即得。
2.2色谱条件色谱柱:Agilent SB-Pheny1(75 mm×4.6 mm,3.5 μm);流动相:水-乙腈-甲醇-磷酸(75∶15∶10∶0.2);柱温:40 ℃;检测波长:326 nm;进样量:10 μL;流速为梯度洗脱见表1。

表1 梯度洗脱流速
2.3分离度试验精密量取供试品溶液10 μL,注入液相色谱仪,记录色谱图。菊苣酸、黄芩苷出峰时间及菊苣酸峰、黄芩苷峰与附近峰的分离度,典型色谱图如图1所示。菊苣酸出峰时间为4.468 min,与附近峰分离度为2.23;黄芩苷出峰时间为8.241 min,与附近峰分离度为1.94。
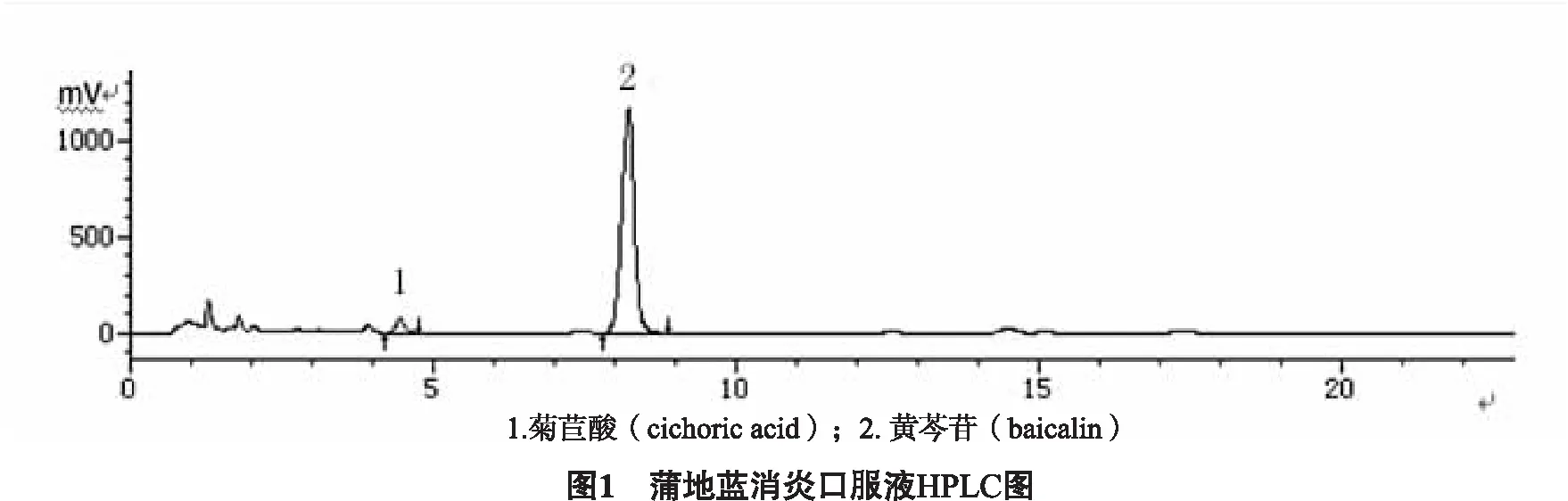
2.4线性关系考察分别精密吸取“2.1.1”项下黄芩苷、菊苣酸不同浓度的系列溶液各10 μL,注入液相色谱仪,按上述色谱条件进行测定,记录色谱图。以浓度对峰面积作图,黄芩苷、菊苣酸回归方程分别为:Y黄芩苷=17463X+22877(r=0.9999),Y菊苣酸=39724X+15518(r=0.9998),黄芩苷在90.58~1449.3 μg范围内,菊苣酸在5.475~54.75 μg范围内线性关系良好。
2.5精密度试验取同一批样品,按“2.1.2”项下方法制备供试品溶液,按“2.2”项色谱条件连续进样6次,记录峰面积,结果黄芩苷、菊苣酸峰面积的RSD分别为0.15%、0.14%,表明仪器精密度良好。
2.6溶液稳定性试验取同一批样品,按“2.1.2”项下方法制备供试品溶液,分别于0、1.5、3、6、9、12、18、24 h按“2.2”项色谱条件测定,记录峰面积。结果黄芩苷、菊苣酸峰面积的RSD分别为0.94%、0.84%。表明供试品溶液在24h内较稳定。
2.7重复性试验取同一批样品,按“2.1.2”项下方法平行制备6份供试品溶液,分别按“2.2”项色谱条件进行测定。结果黄芩苷、菊苣酸的平均含量分别为10.68 mg·mL-1、0.269 mg·mL-1,以含量结果计算RSD(n=6)分别为0.96%和1.1%,表明该方法重复性良好。
2.8加样回收率试验精密量取已知含量的蒲地蓝消炎口服液2.5 mL,共6份,置50 mL量瓶中,分别加入黄芩苷对照品约26.7 mg、菊苣酸对照品储备液(0.137 mg/mL)5 mL,按“2.1.2”项下的方法制备供试品溶液,按“2.2”项下色谱条件进行分析,计算回收率。结果黄芩苷、菊苣酸的平均回收率分别为99.72%、99.38%,RSD(n=6)分别为0.92%、0.99%。
2.9方法对比分别按照2015版《中国药典》蒲地蓝消炎口服液中蒲公英(菊苣酸)、黄芩(黄芩苷)检测方法、以及“2.1、2.2”项下分析方法对6批蒲地蓝消炎口服液中蒲公英(菊苣酸)、黄芩(黄芩苷)含量进行检测,结果见表2。

表2 药典方法和试验方法检测结果对比
3 讨论
分别采用紫外-可见分光光度计及二极管阵列检测器在210~400 nm分析对照品和供试品溶液,发现在326 nm处菊苣酸有最大吸收,而黄芩苷的两个最大吸收峰分别为278 nm和315 nm,由于黄芩苷在样品中含量较高,而菊苣酸在样品中含量偏低,参考相关文献[12-13],为提高菊苣酸的检测灵敏度,选择了326 nm波长处同时测定两种成分的含量。实验结果表明,在326 nm处测定黄芩苷与原方法选定的280 nm测定结果基本一致。
2015版《中国药典》对于蒲地蓝消炎口服液除了维持原有黄芩(黄芩苷)含量检测指标不变的基础上,增加了蒲地蓝消炎口服液中蒲公英(菊苣酸)含量测定,但菊苣酸药典方法的单针进样分析时间长达65 min。在蒲地蓝消炎口服液尤其是中间体(配制液)检测过程中,不计对照品,单批次4针检测时间为260 min,耗时较长,在一定程度上增加了产品的产出周期,而文中研究方法不仅将检测时间大大缩短,也实现了一种方法同时分析黄芩苷、菊苣酸含量的效果。运用本方法检测蒲地蓝消炎口服液中间体,不仅利于生产安排、消除生产瓶颈、降低分析成本、减少排污,同时也降低了配制液在等待检测过程中的污染风险,提高了产品过程中的控制力度。
综上,研究建立的HPLC法同时测定黄芩苷及菊苣酸的含量,方法可行,适用于蒲地蓝消炎口服液生产过程中的质量控制。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:1641-1642.
[2]蒋磊,孟祥松,李军,等.蒲地蓝消炎口服液质量控制方法的研究[J]. 齐鲁药事,2012,31(2):77-83.
[3]华颖,张申.蒲地蓝消炎口服液治疗手足口病临床观察[J].现代中西医结合杂志,2009,18(32):3965.
[4]赵慧娅,郝建华, 郭雯.蒲地蓝消炎口服液联合利巴韦林颗粒治疗手足口病[J].河南大学学报,2015,34(2):139-141.
[5]张小琴,李华, 陈万杰.蒲地蓝消炎口服液治疗急性上呼吸道感染114例[J].工企医刊,2013,26(6):464-465.
[6]许春香,阎一凡. 蒲地蓝消炎口服液治疗呼吸道感染疗效分析[J].中国基层医药,2014,21(1):114-115.
[7]雷芳.黄芩苷药理作用研究进展[J].中国药业,2010,19(15):87-90.
[8]辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22(6):647-659.
[9]Robinson W. L-chicoric acid, an inhibitor of HIV integrase, improves on the in vitro anti-HIV effect of zidovudine and a protease inhibitor (AGI350) [J]. Antiviral Res, 1998, 9(2): 101-106.
[10]闫晓慧,谈锋. 3种松果菊属植物的鉴别、活性成分及生物技术研究进展[J].中草药, 2006, 37(2): 300-304.
[11]King P J, Robinson W E. Resistance to the anti-human immunodeficiency virus typel (HIV-1) compound, L-chicoric acid results from a single mutation at amimo acid 140 of integrase [J]. J Virol, 1998(72): 8420-8426.
[12]张冬梅,桑媛,刘冰. HPLC法同时测定双黄连注射液中绿原酸及黄芩苷含量[J]. 药物分析杂志,2005,25(10) :1279-1280.
[13]刘刚,王海涛,赵淼,等. HPLC法测定双黄连口服液中绿原酸和黄芩苷的含量[J]. 解放军药学学报,2007,23(4) :299-301.

