MSCT诊断肺动脉闭锁伴室间隔缺损
侯 洁,肖俊睿,孙 玉,刘 畅,杨本强*
(1.锦州医科大学研究生院 中国人民解放军沈阳军区总医院研究生培养基地,辽宁 锦州 121000;2.中国人民解放军沈阳军区总医院放射诊断科,辽宁 沈阳 110016)
DOI:10.13929/j.1003-3289.201704028
肺动脉闭锁伴室间隔缺损(pulmonary atresia with ventricular septal defect, PA/VSD)是一种发绀型先天性心血管畸形,约占活产儿的4.2/10 000~10/10 000[1]。因PA/VSD病死率高,故早期诊断非常重要,且手术是唯一有效的治疗方法[2]。随着MSCT分辨力的提高,其可清晰显示心脏、大血管解剖位置关系及肺动脉发育情况等。本研究旨在探讨MSCT诊断PA/VSD的价值。
1 资料与方法
1.1 一般资料 收集2010年1月—2016年12月在中国人民解放军沈阳军区总医院接受治疗、经外科或心血管造影证实的PA/VSD患者81例,其中男45例,女36例,年龄3个月~40岁,中位年龄2岁。临床表现为不同程度发绀、气促、心脏杂音等。53例接受手术治疗,其中根治术3例、墨尔本分流术15例、改良B-T分流术19例,心内修复+跨瓣环右心室流出道补片+加宽术7例,心内修复+同种带瓣管道右心室-肺动脉连接术1例,Rastelli术(异种带心包带瓣牛静脉)1例,心内修复+右心室-肺动脉心外管道连接术3例,心内修复+右心室流出道重建术1例,1期单源化+心内修复术2例,单心室修复术-双向Glenn术1例。
1.2 仪器与方法 采用Philips Brilliance iCT 256层螺旋CT及GE CT750 HD能谱型CT扫描仪。3岁以下婴幼儿镇静后在平静呼吸下接受扫描,余患者屏气后接受扫描。采用前瞻性心电门控,管电压80~120 kV,管电流80~200 mAs,准直器128×0.625 mm,有效层厚0.9 mm,层间距0.45 mm,管球转速0.27 s/rot。增强扫描:经足背静脉或右侧肘静脉注入碘海醇(350 mgI/ml),成人注射剂量30~60 ml,速率3.5~5.0 ml/s;小儿注射剂量0.6~1.5 ml/kg体质量,速率0.5~3.0 ml/s。左心室CT值达100~150 HU时启动计时器,延迟7 s后开始扫描,以同等速率跟注5~20 ml生理盐水冲洗。扫描范围自胸廓入口至膈下5 cm,必要时加扫腹部。
经胸超声心动图(transthoracic echocardiography,TTE)检查采用Philips iE33型超声诊断仪,S7-2探头,频率2~7 MHz,患者取仰卧、左侧或右侧卧位,将探头置于胸骨左缘二、三肋间,对剑突下左心室长轴、大动脉短轴、心尖四腔等切面进行扫查。
1.3 分类标准 根据文献[3]将PA/VSD分为3型:①A型,未闭动脉导管(patent ductus arteriosus, PDA)供应肺动脉及所有肺段;A1型有肺动脉干、A2型无肺动脉干;②B型,小的肺动脉供应部分肺段,少数粗大主动脉及肺侧支循环动脉(major aortopulmonoary collateral arteries,MAPCAs)供应发育不全的肺动脉或直接供应肺段;③C型,MAPCAs供应所有肺段,无真正肺动脉。
根据来源,将MAPCAs分为3类[3-4]:①起源于支气管动脉;②起源于降主动脉,入肺供应至少一个肺叶或肺段,在肺内为肺动脉,肺外为体循环动脉;③间接起源于主动脉大分支,如内乳动脉、锁骨下动脉,在肺外与中心肺动脉连接。
1.4 图像分析 将CT图像传至GE AW 4.4工作站,进行MPR、MIP及VR等。由2名心脏影像诊断医师分析图像并诊断。评估指标包括[5]:①McGoon比值,为(左肺动脉直径+右肺动脉直径)/膈肌水平胸主动脉直径;②肺动脉指数(pulmonary arterial index, PAI),为(左肺动脉横截面积+右肺动脉横截面积)/体表面积;③全部新的肺动脉指数(total neo-pulmonary arterial index, TNPAI),为(左肺动脉横截面积+右肺动脉横截面积+MAPCAs横截面积)/体表面积;体表面积(m2)=0.006 1×身高(cm)+0.012 8×体质量(kg)-0.152 9。
1.5 统计学分析 采用SPSS 13.0统计分析软件。计量资料以±s表示,MSCT与手术评估指标比较采用独立样本t检验;计数资料以百分数表示,两种检查方法间的比较采用χ2检验或四格表Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
81例PA/VSD患者中,A型40例(40/81,49.38%),B型34例(34/81,41.98%),C型7例(7/81,8.64%)。MAPCAs 93支,起源于支气管动脉2支,起源于降主动脉72支,间接起源于主动脉弓大分支19支,其中起源于锁骨下动脉7支(4例起源于左锁骨下动脉、3例起源于右锁骨下动脉),起源于胸廓内动脉4支,起源于头臂干动脉2支,起源于右无名动脉3支,起源于冠状动脉3支(2例起源于右侧冠状动脉,1例起源于左回旋支)。见图1~3。
室间隔缺损位于膜部61例、肌部11例、动脉干下型7例、流出道型2例。40例A型患者,A1型23例,A2型17例,其中16例左右肺动脉有连接,1例左右肺动脉无连接、由双侧PDA供血。34例B型患者中,有肺动脉干6例,无肺动脉干25例,其中左右肺动脉连接12例、左右肺动脉无连接13例,左肺动脉缺如2例,右肺动脉缺如1例。7例C型患者均无肺动脉。
MSCT诊断PA/VSD分型的准确率为93.82%(76/81),高于TTE[59.26%(48/81);χ2=26.95,P<0.01)。MSCT诊断MAPCAs来源的准确率为100%(93/93),高于TTE[51.84%(51/93);χ2=54.25,P<0.01)。
53例接受手术治疗的PA/VSD中,MSCT检出心内畸形50处(50/53,94.34%),TTE检出53处(53/53,100%),二者差异无统计学意义(χ2=1.37,P=0.24);MSCT检出心脏-大血管连接异常66处(66/66,100%),TTE检出65处(65/66,98.48%),二者差异无统计学意义(P>0.05); MSCT检出心外大血管异常106处(106/106,100%),高于TTE[82.08%(87/106);χ2=20.87,P<0.01;表1]。MSCT显示左、右肺动静脉瘘各1例,左、右肺支气管起源变异各1例,左、右肺三叶1例,水平肝1例,无脾综合征1例。MSCT测量McGoon比值、PAI、TNPAI值与手术比较差异均无统计学意义(P均>0.05,表2)。
3 讨论
肺动脉瓣或肺动脉主干至肺动脉分叉处闭锁后,肺的血供主要依靠PDA和/或MAPCAs供应[3]。PDA供应肺最为常见[6],本组A型40例,占49.38%;B型和C型41例,均存在MAPCAs,其多起源于降主动脉,其中7例C型患者无真正肺动脉,均由MAPCAs供血,为PA/VSD最严重的畸形[7-9]。PA/VSD分型中处于交界型常见,本组7例存在粗大PDA,合并细小侧支,将其归为A型,因肺血供主要来源于PDA,肺血管发育良好,侧支血供微量;另外,3例患者PDA细小,肺动脉发育不全,MAPCAs为肺血供主要来源,将其归为B型。
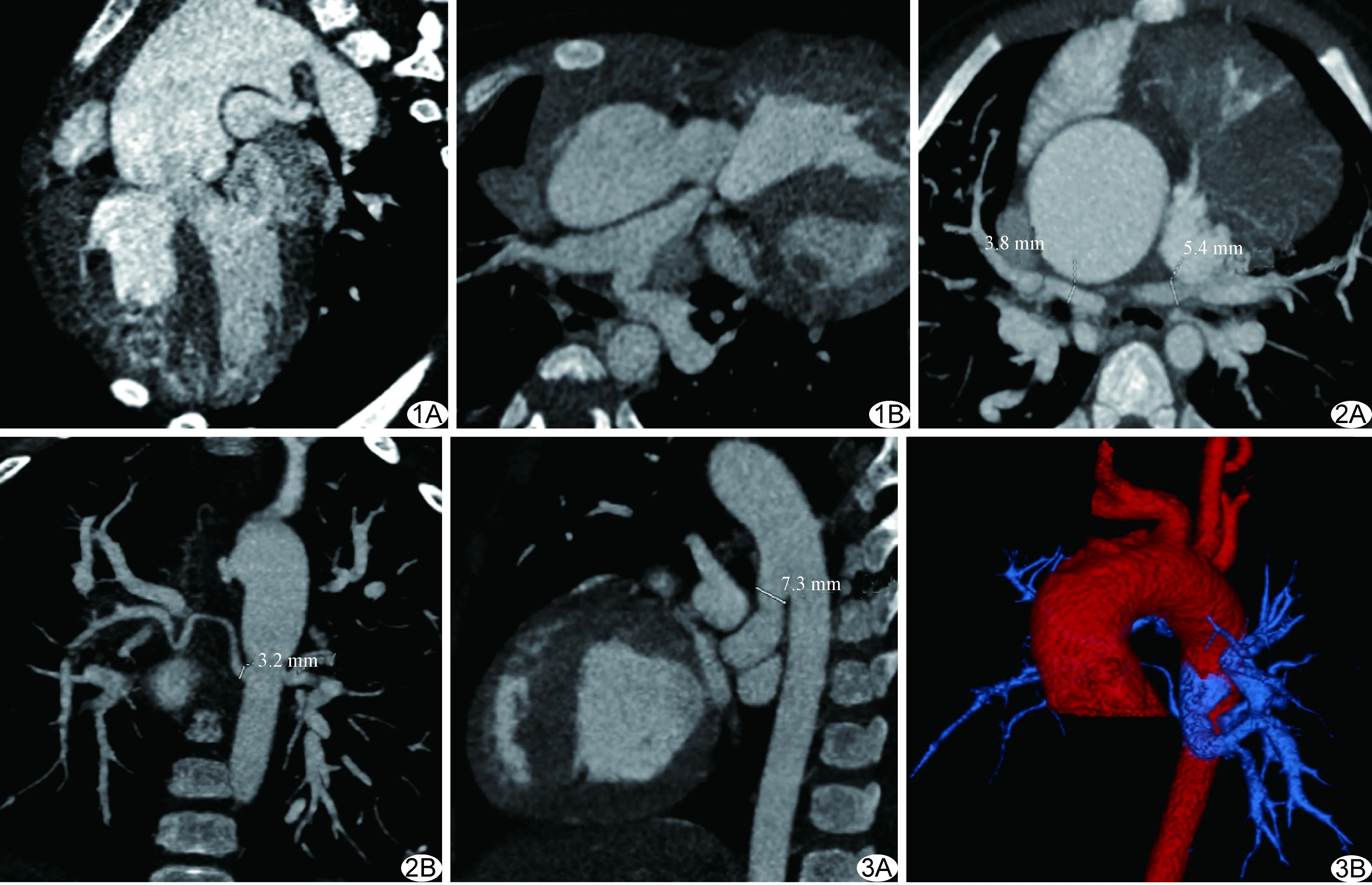
图1 患儿男,3岁,PA/VSD A型 A.斜矢状位图像可见VSD及PDA; B.轴位图像示肺动脉干近端闭锁,左右肺动脉发育良好 图2 患儿女,6个月,PA/VSD B型 A.轴位图像示左右肺动脉发育纤细,肺门水平左、右肺动脉直径分别为3.8 mm、5.4 mm; B.冠状位示降主动脉发出侧支直径3.2 mm 图3 患儿男,2岁,PA/VSD C型 A.矢状位图像示主动脉弓降部发出粗大侧支,直径7.3 mm; B.三维重建图像显示侧支情况

畸形种类MSCTTTE心脏异常(n=53) 房间隔缺损(n=12)1212 卵圆孔未闭(n=5)55 单心室(n=4)44 三房心(n=1)11 左旋心(n=3)33 右旋心(n=2)22 镜面右位心(n=3)33 右心室发育不良(n=2)22 共同心房(n=3)33 心房异构(n=5)55 三尖瓣异常(n=3)23 主动脉瓣异常(n=5)45 共同房室瓣(n=2)12 完全性房室隔缺损(n=3)33心脏-大血管连接异常(n=66) 主动脉骑跨(n=52)5252 大动脉转位(n=8)88 右心室双出口(n=1)11 左心室双入口(n=3)33 心室与大动脉连接处不一致(n=1)11 主动脉-右心室瘘(n=1)10心外大血管异常(n=106) 动脉导管未闭(n=40)4040 肺动脉狭窄(n=9)95 肺静脉异位连接(n=4)42 右位主动脉弓(n=19)1919 主动脉弓分支变异(n=3)31 主动脉异常起源(n=2)20 升主动脉扩张(n=2)22 迷走右锁骨下动脉(n=2)20 左头臂静脉异常(n=6)63 永存左上腔静脉(n=13)1311 双侧上腔静脉(n=2)22 冠状动脉发育变异(n=4)40
表2 MSCT所测数据与手术比较(±s)
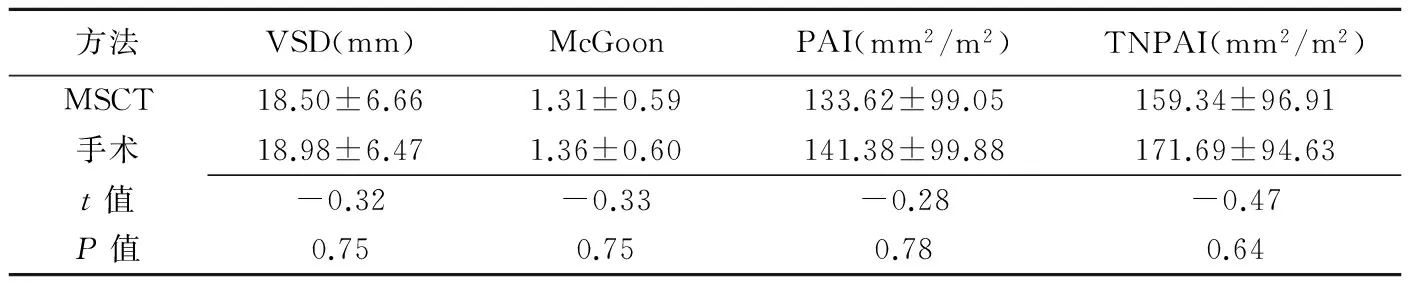
表2 MSCT所测数据与手术比较(±s)
方法VSD(mm)McGoonPAI(mm2/m2)TNPAI(mm2/m2)MSCT18.50±6.661.31±0.59133.62±99.05159.34±96.91手术18.98±6.471.36±0.60141.38±99.88171.69±94.63t值-0.32-0.33-0.28-0.47P值0.750.750.780.64
MSCT与TTE均可显示室间隔缺损及肺动脉,但TTE难以判断侧支血管起源,误漏诊较多。本组TTE将9例粗大的PDA误诊为MAPCAs,分型准确率明显低于MSCT,且MSCT可清晰显示MAPCAs起源、走行、数目、管径、是否存在狭窄等,较TTE有优越性。
本组显示MSCT和TTE对PA/VSD心内结构及伴发畸形的检出率均较高,且差异无统计学意义。但由于MSCT为断面静态成像,对瓣膜活动显示不佳,故本研究漏诊瓣膜畸形3例(1例为主动脉瓣轻度狭窄,1例为共同房室瓣,1例为三尖瓣关闭不全)。MSCT对心外大血管异常的检出率高于TTE,可能因TTE易受声窗限制和肺气干扰,且病变钙化造成强回声也影响畸形的检出[10]。此外,MSCT还可检出支气管异常起源、肺动静脉瘘、肺叶畸形等异常。
McGoon比值及PAI是目前常用于评价肺门近端血管的指标[5],可为患者选择一期矫治手术或姑息手术提供指导。McGoon比值>1.5,应考虑修补VSD;PAI≥150 mm2/m2,应考虑采用根治术。对于B型PA/VSD患者,需考虑侧支血管直径并根据TNPAI决定是否闭合VSD:当TNPAI≥200 mm2/m2,考虑暂不闭合VSD,行一期单源化、心内修复术和/或同种带瓣管道右心室-肺动脉连接;对不满足上述条件者可行体肺动脉分流术、右心室流出道重建或同期肺动脉融合术[11-12]。本研究显示MSCT测量McGoon比值、PAI、TNPAI值与手术测值差异无统计学意义,故MSCT准确率较高。
手术是PA/VSD的首选治疗方法,但患者个体差异大,故手术方案多样[3]。传统心血管造影是诊断PA/VSD的金标准,因有创、费用较高、并发症多而患者不易接受[13]。TTE诊断水平受操作者经验、技术的影响较大[14]。术前MSCT检查可为手术及术后评估提供影像学资料,且MSCT可同时诊断肺部炎症等病变,有助于手术前后对症治疗。但MSCT对心瓣膜病变的显示欠佳,不能提供血流动力学相关指标,难以对患者进行完整的心功能评估;另外心电门控扫描婴幼儿,辐射剂量过高[15],有待采用更低剂量、更快的创新型扫描方案。
综上所述,MSCT是确诊PA/VSD的快速、有效、无创方法,并可准确显示PA/VSD的心内、外异常结构及评估MAPCAs来源、走行、肺血管发育情况,心外大血管的解剖结构及冠状动脉变异,可作为PA/VSD术前检查手段之一。
[
]
[1] Kaskinen AK, Happonen JM, Mattila IP. Long-term outcome after treatment of pulmonary atresia with ventricular septal defect: Nationwide study of 109 patients born in 1970—2007. Eur J CardioThoracic Surg, 2016,49(5):1411-1418.
[2] 邓喜成,李守军.肺动脉闭锁合并室间隔缺损的外科治疗策略.中国胸心血管外科临床杂志,2010,17(1):50-54.
[3] 汪曾炜,刘维永,张宝仁.心脏外科学.北京:人民军医出版,2015,1219-1223.
[4] Gupta A, Odim J, Levi D, et al. Staged repair of pulmonary atresia with ventricular septal defect and major aortopulmonary collateral arteries: Experience with 104 patients. J Thorac Cardiovasc Surg, 2003,126(6):1746-1752.
[5] 殷磊,吕滨,韩磊,等.双源CT术前定量分析肺动脉闭锁患者固有肺动脉及体肺侧支.中国医学影像技术,2010,26(6):1084-1087.
[6] 颜立群,侯亚平,刘永,等.256层CT诊断肺动脉闭锁合并室间隔缺损的影像学分析.中国临床医学影像杂志,2013,24(11):768-771.
[7] Khositseth A, Siripornpitak S, Pornkul R. Pulmonary atresia and ventricular septal defect with collaterals to right lung associated with anomalous left pulmonary artery from the ascending aorta. Pediatr Radiol, 2010,40(1):72-76.
[8] Mainwaring RD, Reddy VM, Perry SB, et al. Late outcomes in patients undergoing aortopulmonary window for pulmonary atresia/stenosis and major aortopulmonary collaterals. Ann Thorac Surg, 2012,94(3):842-849.
[9] Liava'a M, Brizard CP, Konstantinov IE, et al. Pulmonary atresia, ventricular septal defect, and major aortopulmonary collaterals: Neonatal pulmonary artery rehabilitation without unifocalization. Ann Thorac Surg, 2012,93(1):185-191.
[10] 汪洁,王青,崔凤玉.双源CT在先天性心脏病诊断中的应用价值.山东大学学报:医学版,2009,47(4):87-90.
[11] Carotti A, Albanese SB, Minniti G, et al. Increasing experience with integrated approach to pulmonary atresia with ventricular septal defect and major aortopulmonary collateral arteries. Eur J Cardiothorac Surg, 2003,23(5):719-727.
[12] Benza RL, Gomberg-Maitland M, Frost AE, et al. Development of prognostic tools in pulmonary arterial hypertension: Lessons from modern day registries. Thromb Haemost, 2012,108(6):1049-1060.
[13] 张雪莲,王巧兮,马兵毅,等.多层螺旋 CT 在诊断法洛四联症中的应用.中国介入影像与治疗学,2006,3(6):425-427.
[14] 白燕,陈正光,王荣峰,等.多层螺旋CT诊断复杂型先天性心脏病.中国介入影像与治疗学,2009,6(6):509-512.
[15] 张健,杨明,莫绪明,等.不同管电压64层螺旋CT对儿童CTA图像质量和辐射剂量的影响.中国医学影像技术,2012,28(6): 1213-1217.

