生物聚合物纳米微粒对人肺癌细胞凋亡的作用
孙倩 杨丽君 周欢琴★
双氢青蒿素(DHA)是青蒿素的衍生物,是从天然药物青篙中提取的。DHA是一类临床奏效快,治愈率高且毒性低的抗疟疾药物,尤其对易耐药的脑型疟、恶性疟有效。研究表明,DHA对于各种肿瘤细胞系的癌症,还具有抗肿瘤活性,能促使肿瘤细胞凋亡[1-2]。然而,DHA治疗恶性肿瘤方面也存在一些问题,例如在溶液中或血液中溶解度差,生物利用度低,口服活性不佳,血浆半衰期短,从而导致在治疗过程中使用剂量和次数的增加[3-4]。可以通过制备DHA纳米微粒来增加DHA体外溶出度,延长释放时间,提高其生物利用率,解决DHA单独给药时存在的问题。在前期研究中,作者开发了静电场系统制备生物聚合物纳米颗粒的方法[5]。本实验采用的肺腺癌A549细胞是目前肺癌研究常用的一种肺腺癌细胞系,通过制备纳米微粒作为载体来包覆DHA,探讨DHA的生物聚合物纳米微粒的理化性质以及对人肺腺癌A549细胞凋亡作用的影响。
1 材料与方法
1.1 材料与仪器 人肺腺癌A549细胞株由台湾义守大学生物医学工程系提供,双氰青蒿素购自Sigma-Aldrich公司,其他化学试剂包括海藻酸钠、明胶、胎牛血清和二甲基亚砜等均购自Gibco生命科技有限公司。实验涉及的溶液均由去离子水配制。采用透射电镜(G2 20 S-Twin,Tecnai,USA)观察纳米微粒的形貌,测算纳米微粒的粒径;采用高效液相色谱仪(1100series,Agilent,USA)检测DHA浓度,使用C-18色谱柱(4.6×250mm,5μm),流动相为40%的乙腈和60%的去离子水,流速设定为1ml/min,柱温为35℃,检测波长为210nm。
1.2 纳米微粒的制备 (1)生物聚合物纳米微粒的制备:采用静电场系统制备四种生物聚合物纳米微粒(Chitosan-alginate,Chitosan-NaOH,Gelatin和 HA纳米微粒)。(2)包覆DHA的生物聚合物纳米微粒的制备:在996 μl的四种生物聚合物溶液中加入4 μl配制好的25mg/ml DHA溶液,使得DHA的最终浓度为100μg/ml,采用静电场系统制备包覆DHA的纳米微粒。
1.3 细胞活性测试 (1)纳米微粒的体积和种类的筛选:分别置放10μl、20μl、30μl和40μl四种未包覆DHA的纳米微粒与已培养1d的A549细胞共同培养1d后,加入20μl MTT,使用酶联免疫检测仪测定吸光值,筛选纳米微粒的体积和种类。(2)HA-DHA纳米微粒细胞活性测试:设置HA-DHA纳米微粒、DHA、HA纳米微粒和DMSO四个组别,分别与已培养1d的A549细胞培养1d、2d、3d后,加入MTT试剂检测其吸光值。
1.4 细胞凋亡测试 设置HA-DHA纳米微粒、DHA、HA纳米微粒和DMSO四个组别,与已培养1d的A549细胞爬片共同培养2d后,按照Annexin V-FITC/PI细胞凋亡检测试剂盒提供的方法进行染色并在荧光显微镜下观察细胞状态。
1.5 统计学方法 采用SPSS17.0统计软件。计量资料以(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 透射电子显微镜(TEM) 图通过TEM观测其形貌,图1分别是Chitosan-Alginate、Chitosan-NaOH、Gelatin和HA四种纳米微粒的TEM图。Chitosan-Alginate,Gelatin和HA纳米微粒分布均匀,大小均一且球形规律;Chitosan-NaOH粒径大小均一性较差。图2是生物聚合物包覆DHA形成的纳米微粒TEM图。Chitosan-Alginate-DHA和 Chitosan-NaOH-DHA纳米微粒分布均匀且大小均一;Gelatin-DHA和HADHA纳米微粒则出现了颗粒团聚现象。表1为四种纳米微粒包裹前后的粒径大小。Chitosan纳米微粒在包覆DHA前后粒径大小并无明显区别,粒径大小都在3~10nm之间,而HA和Gelatin在包覆DHA前后粒径大小相差较多,Gelatin和HA 纳米微粒粒径分别为(4.3±0.98)nm和(17.7±5.5)nm;包覆DHA后,粒径分别变为(39.4±6.9)nm和(29.5±9.8)nm。
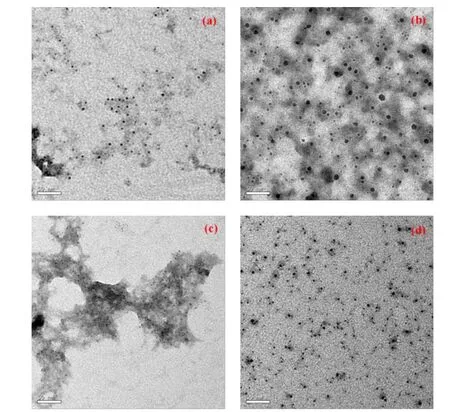
图1 四种生物聚合物纳米微粒的TEM图[(a)Chitosan纳米微粒(交联剂为Alginate);(b)Chitosan纳米微粒(交联剂为NaOH);(c)Gelatin纳米微粒;(d)HA纳米微粒]
表1 四种纳米微粒包裹前后的粒径大小(±s)
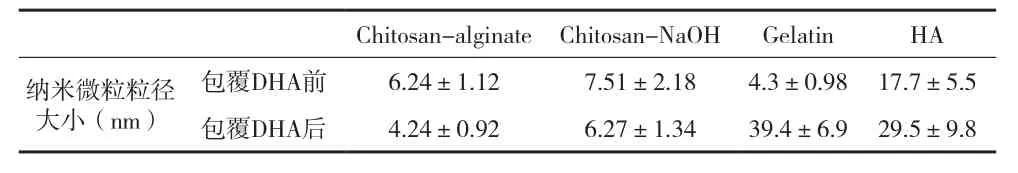
表1 四种纳米微粒包裹前后的粒径大小(±s)
Chitosan-alginate Chitosan-NaOH Gelatin HA纳米微粒粒径大小(nm)包覆DHA前 6.24±1.12 7.51±2.18 4.3±0.98 17.7±5.5包覆DHA后 4.24±0.92 6.27±1.34 39.4±6.9 29.5±9.8
2.2 包覆率测试 DHA的含量可由HPLC测定,根据建立的标准曲线可以计算实验中DHA的含量。表2是不同的生物聚合物纳米微粒对DHA包覆率。四种纳米微粒的包覆率的大小顺序为:HA-DHA(35%)>Chitosan-NaOH-DHA(21%)>Chitosan-Alginate-DHA(18%)>Gelatin-DHA(13%)。
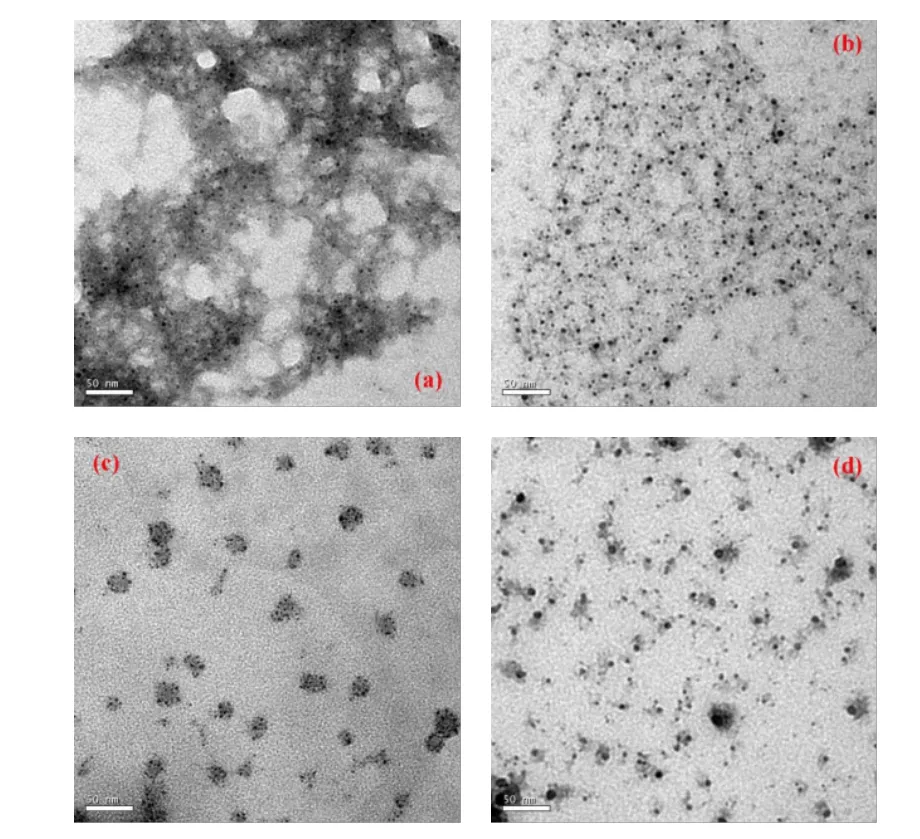
图2 包裹DHA的纳米微粒的TEM图[(a)Chitosa- Alginate-DHA;(b)Chitosan-NaOH-DHA;(c)Gelatin-DHA纳米微粒;(d)HA-DHA纳米微粒]
表2 纳米微粒包覆DHA的包覆效率(±s)

表2 纳米微粒包覆DHA的包覆效率(±s)
包覆DHA纳米微粒组 包覆率(%)Chitosan-alginate-DHA 18.227±1.262 Chitosan-NaOH-DHA 20.904±1.275 Gelatin-DHA 12.915±2.410 HA-DHA 35.320±5.827
2.3 细胞活性检测 (1)纳米微粒放置浓度筛选:纳米微粒包覆DHA的抗癌药性是通过将包覆DHA的纳米微粒与人肺腺癌A549细胞共同培养,加入MTT试剂后通过酶标仪检测其OD值来反应DHA对A549细胞的毒杀作用。实验中通过加入不同体积的纳米微粒悬浮液(10μl,20μl,30μl和 40μl)与 A549 细胞共同培养,来检测四种纳米微粒对人类细胞无毒杀作用。加入10 μl两组Chitosan纳米微粒悬浮液与A549细胞共培养时,与对照组比较,A549细胞的存活率明显降低;经统计学分析其与比较控制组相比差异有统计学意义(P<0.01)。20μl的Gelatin纳米微粒悬浮液即可引起细胞活性降低;而HA纳米微粒在加入40 μl时才会导致细胞凋亡,经统计学分析其与比较控制组相比差异有统计学意义(P<0.05)。因此,选择加入10 μl体积的HA纳米微粒悬浮液与细胞作用进行以下实验。(2)包覆DHA纳米微粒的细胞活性测试:选择HA纳米微粒进行细胞活性测试,DHA对照组的浓度是最小致细胞凋亡的浓度为10μg/ml。与A549细胞作用后,HA-DHA纳米微粒明显降低了A549细胞活性,而且随着培养时间的增加,A549细胞活性的降低程度越大。HA-DHA纳米微粒比直接加入DHA更有效地引起细胞凋亡,经统计学分析差异有统计学意义(P<0.01)。
2.4 细胞凋亡测试 为了研究纳米微粒包覆DHA前后对人肺腺癌A549细胞的凋亡作用,将细胞处理作用2d后,将细胞爬片进行Annexin V-FITC染色以及PI染色,在光学显微镜和荧光显微镜下进行观察。DHA与A549细胞共培养2d后,出现细胞收缩、伪足萎缩、细胞膜皱缩、细胞从爬片上脱落的现象,这是细胞凋亡的典型形态学改变。在细胞中加入HA-DHA纳米微粒共培养时也出现了细胞凋亡现象,在荧光显微镜下可观察到绿色和红色荧光信号,表明细胞出现了早期凋亡和死亡。然而HA纳米微粒组细胞仍与控制组保持相似的细胞结构,并且细胞良好地贴覆在玻片上。染色结果证实了DHA和HA-DHA对A549细胞的凋亡作用,绿色的荧光信号表示细胞早期凋亡,红色的荧光信号表示细胞晚期凋亡或者死亡。
3 讨论
DHA是ART的一个衍生产物,对人类癌症细胞表现出抑制作用。已有研究表明DHA能够诱导人肺腺癌A549细胞凋亡[6],本研究采用生物聚合物纳米微粒,将DHA包覆于其中,从而改善DHA应用上的弊端。选用的Chitosan,Gelatin,HA作为纳米微粒的主要材料,是因为其具有良好的生物相容性,生物降解性和水溶性,在制备过程中不需要加入任何有机溶剂,从而够改善DHA在水相中难以溶解均匀分布的特点。
本研究结果显示,包覆DHA后,Chitosan-Alginate-DHA和Chitosan-NaOH-DHA纳米微粒分布均匀且大小均一,未出现颗粒团聚现象,推测是纳米微粒具备双极性的特征:Chitosan带正电荷,而Alginate带负电荷,NaOH在酸性条件下有较多的氢氧根。在这种双极性的条件下,生物聚合物溶液的乳化作用较强,即能有效地分散油溶性DHA,但由于受到配制条件的限制而呈酸性,与细胞共培养时,降低了细胞活性导致细胞死亡。Gelatin-DHA和HA-DHA纳米微粒由于DHA属于油溶性药物,与水溶性Gelatin和HA的连接性不强,出现了颗粒团聚现象。MTT细胞活性测试和荧光染色结果显示,HA-DHA纳米微粒中比单纯加入DHA更能增强DHA的生物利用度和A549细胞凋亡的作用。
细胞膜是防止细胞外物质自由进入细胞的屏障,其主要通过细胞内吞[7]作用包括胞饮作用、细胞吞噬作用与外界物质交流。内吞作用有四个基本机制:网格蛋白介导的内吞作用,小穴蛋白介导的内吞作用,不依赖网格蛋白和小穴蛋白的内吞作用,巨胞饮[8],纳米微粒也是经由细胞内吞途径进入细胞内,此次研究中并未探讨DHA进入A549细胞的方式。
综上所述,纳米微粒包覆DHA的方式比单纯加入DHA更能诱导A549细胞进入凋亡的途径。
[1] Tan WF,Shen F,Luo XJ,et al.Artemisinin inhibits in vitro and in vivo invasion and metastasis of human hepatocellular carcinoma cells.Phytomedicine,2011,18(2-3):158-162.
[2] Oda D,Habte T,Yamachika E.Artemisinin:an alternative treatment for oral cancer.Oral Surgery,Oral Medicine,Oral Pathology,Oral Radiology,and Endodontology,2004,98(2):204.
[3] He Q,Sheikh MS,Huang Y,et al.Dihydroartemisinin upregulates death receptor 5 expression and cooperates with TRAIL to induce apoptosis in human prostate cancer cells.Cancer Biology & Therapy,2010,9(10):819-824.
[4] Kong R,Cheng ZX,Wang YW,et al.Dihydroartemisinin enhances Apo2L/TRAIL-mediated apoptosis in pancreatic cancer cells via ROS-mediated up-regulation of death receptor 5.Plos One, 2012,7(5):e37222.
[5] Chen H,Sun B,Pan SH,et al.Study on anticancer effect of dihydroartemisinin on pancreatic cancer.Zhonghua Wai Ke Za Zhi[Chinese journal of surgery],2009,47(13):1002-1005.
[6] 陈卫强,戚好文,吴昌归,等.双氰青蒿素抗人肺腺癌A549细胞生长的实验研究.中国肺癌杂志,2005,8(2):85-88.
[7] 范真真,陈虹,黄秉仁.细胞内吞的研究进展.生命的化学,2014,34(4):492-499.
[8] Harush-Frenkel O,Oshrat N,Simon B,et al.Targeting of nanoparticles to the clathrin-mediated endocytic pathway.Biochemical and Biophysical Research Communications,2007,353(1):26-32.

