基于功能化银纳米粒子的表面增强拉曼法检测水体中As3+
(大连大学环境与化学工程学院,大连 116622)
目前,我国最严重的重金属水污染包括镉、汞、铅和砷污染。砷可以通过呼吸道、消化道及皮肤进入人体,对各系统造成不同程度的损伤[1]。砷有无机砷和有机砷两种形式,其毒性以无机砷最为显著[2],在天然水体中,无机砷是主要的存在形式,多年来,世界不同地区的地下水受到不同程度的砷污染[3,4]。饮用含砷的水,会发生急性或慢性中毒,重金属砷会在人体的肝、肾、肺、子宫、胎盘、骨骼、肌肉等部位蓄积,与细胞中的酶系统结合,抑制体内许多酶的活性甚至使其失去活性,造成机体代谢障碍[5]。发展重金属检测技术对于控制环境污染、保护人体健康具有十分重要的现实意义。
目前用于重金属检测的方法有很多,常用的方法主要有原子光谱法、紫外-可见分光光度法、比色法、质谱法和电化学分析法等。这些检测技术大多存在耗费耗时、依赖大型仪器、需要专业的技术人员,并且对某些重金属离子的检测不灵敏等问题,因此,发展简单、快速、灵敏度高的重金属检测技术是十分必要的。
自从1974年英国科学家Fleishmann等人首次在粗糙的微纳米结构的银电极表面发现增强的吡啶拉曼信号[6],1977年Van Duyne 和Creighton等人证实这一现象[7]并正式命名为表面增强拉曼散射(surfface-enhanced Raman scattering,简称SERS)以后,由于其具有简单、快速、灵敏度高的优点,被迅速应用于分析检测。由于SERS效应是发生在粗糙金属表面上的孔洞或者间隙中的非常局域性的物理现象,对金属本身的介电常数和金属表面的形貌有着特别的要求,因此基底的制备成为这项技术发展的热点[8]。随着近年来纳米技术的诞生[9]及发展,将纳米金、银颗粒具有表面等离子体共振的性质应用于光谱检测[10],可发展基于金属纳米结构的表面增强拉曼光谱方法,由于其可获得大量的样品分子结构信息,可使探测灵敏度进一步提高,在分析科学中得到了越来越多的应用。Carron等利用铬黑T作为SERS指示剂对重金属离子进行了测定[11],通过对不同离子的拉曼光谱进行比较,得知离子半径的不同能够导致拉曼图谱的变化不同。基于这一原理实现了对不同离子的选择性测定,该方法对铅离子检测的最低检出限为270μg/L,对铜离子检测的最低检出限为85μg/L。Henrique E. Toma[12]课题组利用在有NaCl存在的条件下,金纳米粒子能够使修饰在其表面的2,4,6-trimercapto-1,3,5-triazine (2,4,6-三巯基-1,3,5-三氮杂苯)分子的拉曼信号显著增强,而2,4,6-trimercapto-1,3,5-triazine与Hg2+和Cd2+的结合方式不同,从而引起的拉曼图谱的变化不同,进而实现了对Hg2+和Cd2+的选择性和灵敏性检测。刘世勇[13]课题组利用设计合成的离子配体聚合物和拉曼报告分子共同修饰在金纳米粒子的表面形成SERS探针,Cd2+通过与离子配体作用导致纳米粒子发生团聚进而使拉曼报告分子的拉曼信号增强,实现了对Cd2+的灵敏性测定。付秀丽[14]等基于抗聚集的4-巯基吡啶(4-MPY)功能化银纳米粒子以及聚阳离子鱼精蛋白的SERS技术间接实现了对胰蛋白酶的检测。本研究中基于功能化银纳米粒子的表面增强拉曼法实现对水体中As3+的检测。
1 实验部分
1.1 仪器与试剂
DXR激光共焦显微拉曼光谱仪:RFS100(美国Thermo Scientific公司),含显微镜、5mW的氦氖二极管泵浦激光源;透射电子显微镜:JEM-1230(日本JEOL公司); Zeta电位纳米粒度仪:Zetasizer Nano ZS-90(英国Malvern公司);超纯水系统:CASCADE-BIO(美国Pall 公司)。
谷胱甘肽(GSH,99%)、4-巯基吡啶(4-MPY,95%)(美国Sigma-Aldrich 公司), As3+标准溶液(北京SCP科学有限公司),盐酸羟胺(NH2OH·HCl)(天津市科密欧化学试剂有限公司),硝酸银(AgNO3,99.8%)、氯金酸(HAuCl4·3H2O)、硼氢化钠(NaBH4)、氢氧化钠(NaOH,96%)、柠檬酸钠(上海国药集团化学试剂有限公司),实验所用水均为超纯水。
1.2 纳米粒子的制备
(1)盐酸羟胺为还原剂的银纳米粒子的制备
盐酸羟胺为还原剂的银纳米粒子是根据室温条件下利用盐酸羟胺还原硝酸银的方法并作必要的修改后合成的。制备方法如下:首先将1 mL的3×10-1mol/L氢氧化钠(NaOH)水溶液加入89 mL的1.67×10-2mol/L盐酸羟胺(NH2OH·HCl)水溶液中,使之pH值保持在碱性范围内,在搅拌条件下将10 mL的1.11 mmol/L硝酸银(AgNO3)水溶液滴加到上述混合液中,1 min滴加完成,继续搅拌30 min,得到的黄色液体为纳米银颗粒,室温下储存待用。
(2)柠檬酸钠为还原剂的银纳米粒子的制备
柠檬酸根稳定的银纳米粒子是根据文献报道的方法合成的[15]。将1.06 mL 0.10 mol/LAgNO3加入到100 mL 45°C的二次水中,磁力搅拌下迅速加热至沸腾;加入2 mL 1%的柠檬酸钠,在沸腾状态下反应45 min。所得溶液在室温下冷却待用。
(3)硼氢化钠为还原剂的银纳米粒子的制备
硼氢化钠为还原剂的银纳米粒子是根据文献报道的方法并作必要的修改后合成的。首先将0.25 mL 0.1mol/LAgNO3和0.25 mL 0.1 mol/L柠檬酸钠在搅拌条件下加入到100 mL 二次水中,然后将6 mL 5 mmol/LNaBH4加入到上述混合溶液中,继续搅拌1 h后静置,室温下储存待用。
(4)金/银核壳纳米粒子 (Au@Ag NPs)的制备
金/银核壳纳米粒子是按照Natan的方法,即在有金种存在下用柠檬酸钠还原Ag+的方法并稍加修改后合成的。
种子溶液的制备:用柠檬酸钠还原氯金酸的方法法制备13 nm粒径的金纳米粒子作为种子。具体过程如下:首先将100 mL 1 mmol/L的HAuCl4溶液加入三口烧瓶中加热至回流,然后将10 mL 38.8 mmol/L的柠檬酸钠迅速倒入HAuCl4溶液中,继续回流,溶液逐渐由淡黄色变为酒红色,反应约15 min后,停止加热继续搅拌冷却至室温。
金/银核壳纳米粒子的形成:将10 mL 13 nm的金纳米粒子种子溶液稀释到100 mL并加入三口烧瓶中重新加热至回流,然后在剧烈搅拌下加入1 mL 38.8 mmol/L的柠檬酸钠溶液,再加入5 mL 0.01 mol/L的AgNO3溶液,继续回流反应1 h。反应完成后,冷却至室温并在4 °C条件下避光保存。
1.3 纳米粒子的功能化
在搅拌条件下将10 μL的100 μmol/L的谷胱甘肽水溶液和10 μL的400 μmol/L的4-巯基吡啶水溶液同时加入到2 mL纳米溶胶中,继续搅拌30 min,即得谷胱甘肽和4-巯基吡啶同时功能化的纳米粒子。
2 结果与讨论
2.1 检测原理
GSH/4-MPY功能化的AgNPs检测水体中As3+的原理如图1所示,GSH分子含有活泼的巯基-SH ,通过Ag-S化学键功能化到AgNPs表面[16,17]。一般来说,拉曼信号分子4-巯基吡啶主要通过3种不同的方式与银纳米粒子结合,即通过的硫(S)或氮(N)原子的孤对电子,或通过芳香族的π电子。Ag-S键的结合是4-巯基吡啶与银纳米粒子化学吸附的主要结合方式,Ag-N键的相互作用在吸附过程中起次要作用[18]。当溶液中As3+与GSH/4-MPY功能化的AgNPs相遇,由于As3+对GSH配体有很强的亲和力,每一个As3+离子可通过As-O化学键结合3个GSH功能化的AgNPs,导致银纳米颗粒发生聚集,产生许多拉曼活性位点(即热点hot spots),从而使吸附在银纳米粒子表面的4-巯基吡啶的拉曼信号显著增强,间接达到了对As3+检测的目的。
如图2所示,新制备的AgNPs能够很好的处于单分散状态(图2a),这是由于其表面由大量带负电荷的羟胺氯离子保护着,防止了AgNPs发生聚集。通过调整加入的GSH和4-MPY的浓度,银纳米胶体的颜色仍保持明亮的黄色(图2b),表明GSH/4-MPY功能化的AgNPs仍然处于单分散状态。当溶液中存在As3+时,由于As-O化学键的形成而使银纳米颗粒发生聚集,结果是GSH/4-MPY功能化的AgNPs的表面等离子体共振光谱发生了红移,溶液的颜色加深(图2c)。由此得出,谷胱甘肽和4-巯基吡啶同时功能化的银纳米颗粒对As3+溶液具有一定的响应,这些响应可以通过裸眼观察。

图1 基于AgNPs的As3+检测的结构示意图 a) .GSH功能化的AgNPs ;b). 4-MPY功能化的AgNPs

图2 基于GSH/4-MPY功能化的AgNPs的As3+的SERS检测示意图、TEM及胶体颜色图 (a).未功能化的AgNPs ;(b). GSH/4-MPY功能化的AgNPs ;(c).加入200μg/L As3+的GSH/4-MPY功能化的AgNPs溶液。
2.2 实验条件优化
(1)纳米粒子制备方法的选择
分别用盐酸羟胺、柠檬酸钠、硼氢化钠作为还原剂制备纳米银粒子(AgNPs),其中,盐酸羟胺法用不同的药品加入顺序制备两组,一组为硝酸银加入到盐酸羟胺中,一组为盐酸羟胺加入到硝酸银中。另外制备一组在有金种存在下用柠檬酸钠还原Ag+制备的金/银核壳纳米粒子(Au@Ag NPs)。以上各组在相同条件下分别修饰500 nmol/L谷胱甘肽(GSH)和2 μmol/L4-巯基吡啶(4-MPY),搅拌30 min后各取90 μL,加入10 μL 2 mg/L的As3+,进行拉曼检测,每组平行测定3次,选择1098 cm-1处特征峰做比较,从图3中可以看出,用盐酸羟胺作为还原剂,将硝酸银加入到盐酸羟胺中制备的AgNPs效果最好。
吸收峰由高到低分别为盐酸羟胺法a(硝酸银加入到盐酸羟胺中)、盐酸羟胺法b(盐酸羟胺加入到硝酸银中)、Au@Ag NPs、柠檬酸钠法、硼氢化钠法。
(2)硝酸银加入速度的选择
10.44 mg盐酸羟胺溶解在89 mL二次水中,加入1 mL 0.30mol/L的NaOH,在磁力搅拌下,将10 mL 0.01mol/L硝酸银溶液用注射泵调节不同速度加入到上述混合液中,速度分别为120、60、40、30、24 mm/min,相对应的完成加入的时间分别为0.5、1、1.5、2、2.5 min,另外一组为硝酸银快速倒入盐酸羟胺混合液中。以上6组分别搅拌30 min,静置30 min后修饰500 nmol/L GSH和2 μmol/L 4-MPY,搅拌30 min后各取90 μL,加入10 μL 2 mg/L的As3+,进行拉曼检测,每组平行测定3次。如表1所示,1.5 min组As3+浓度最高。

图3 不同方法合成纳米粒子功能化后检测As3+的拉曼信号强度
表1完成时间对纳米银检测As3+浓度的影响

完成时间(min)05115225快速As3+浓度(μg/L)532539803575469527
(3)合成纳米银搅拌时间的选择
将硝酸银在1 min内加入到盐酸羟胺与NaOH的混合液中,在相同转速下分别搅拌30 min、45 min、60 min,静置30 min后修饰500 nmol/L GSH和2 μmol/L 4-MPY,搅拌30 min后进行拉曼检测,每组平行测定3次。将以上各组修饰的AgNPs溶液各取90 μL,加入10 μL 2 mg/L的As3+,进行拉曼检测,每组平行测定3次。综合考虑加入As3+前后的拉曼强度,选择搅拌30 min为最佳条件(图4)。


图4 搅拌时间对纳米银检测As3+信号强度影响A.200μg/L As3+时信号强度;B.不加As3+时信号强度。
(4)纳米银粒子的稳定性
对纳米银溶胶在6天内进行连续测定,每次均进行功能化然后对As3+检测。在第4天时,肉眼可见少许黑色颗粒析出,第6天无拉曼检测信号(图5)。
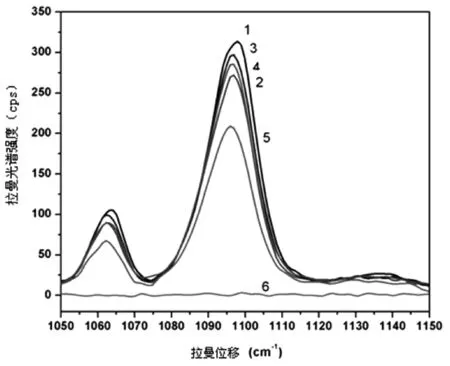
图5 连续6天用功能化纳米银检测As3+的信号强度曲线1~6分别为第1~6天拉曼响应曲线
(5)4-巯基吡啶的溶剂对As3+探针的性能的影响
4-巯基吡啶作为拉曼信号分子修饰到纳米银颗粒上,在SERS检测中起着非常重要的作用,用不同溶剂溶解4-巯基吡啶,对于As3+的测定具有一定影响。实验中考察了分别用甲醇、乙醇、水溶解的4-巯基吡啶修饰的AgNPs对水中As3+检测的SERS信号强度,如图6所示,用乙醇作为溶剂时SERS信号最强。

图6 4-MPY的溶剂(水、甲醇、乙醇)对拉曼信号强度的影响其它实验条件为500 nmol/L的GSH和200μg/L的As3+
(6)4-巯基吡啶浓度的对As3+探针的性能的影响
实验中还考察了4-巯基吡啶的浓度对SERS 信号强度的影响,测试了3个不同浓度的4-MPY(1.0μmol/L, 2.0 μmol/L, 2.5 μmol/L ),其相应的SERS光谱强度如图7所示。从图7中可以看出2.0 μmol/L的4-MPY产生最大的拉曼信号。

图7 6 4-MPY的浓度对拉曼信号强度的影响浓度:1.0 μmol/L~2.5 μmol/L, 其它实验条件为500 nmol/L的GSH和500μg/L的As3+
2.3 检测As3+的灵敏度和线性范围
在最佳实验条件下,将不同浓度(0.01~3 mg/L)的As3+溶液分别加入到GSH/4-MPY同时功能化的AgNPs溶液中与其反应,对SERS谱图进行记录,以确定本研究方法的灵敏度。如图7所示,4-巯基吡啶呈现出许多特征峰,如位于710、1011、1062、1098、1224和1579 cm-1处的特征峰。其中,处于1098 cm-1的拉曼特征峰是对应于苯环呼吸振动/C-S伸缩模式,表明4-MPY是通过S原子功能化到AgNPs表面。从图8中可以看出,所有的拉曼特征峰强度都会随As3+浓度的增加而增强,而1098 cm-1处拉曼特征峰最为显著,其强度对As3+离子浓度最敏感。因此,选择1098 cm-1处拉曼强度的变化来表示As3+引起的GSH/4-MPY功能化的AgNPs的聚集程度,从而作为定量分析As3+浓度的依据。如图9、图10所示,1098 cm-1处的拉曼强度与As3+的浓度在1~300μg/L范围内成良好的线性关系(相关系数R=0.9987),基于3 倍的信噪比计算得出最低检测限为0.34μg/L。这一结果远远低于世界卫生组织(WHO)关于饮用水中As3+浓度不应高于10μg/L的规定。

图8 As3+存在时GSH/4-MPY功能化的AgNPs的拉曼光谱

图9 加入不同浓度(1~300μg/L)As3+溶液时GSH/4-MPY功能化AgNPs的SERS光谱

图10 1098 cm-1波数处相应于不同浓度As3+ 拉曼峰强度图插图为1~300μg/L的线性曲线(R2=0.9934), 误差棒代表3次独立实验的标准偏差
3 结论
研究了一种基于谷胱甘肽和4-巯基吡啶功能化的银纳米粒子的快速检测水体中As3+离子的SERS方法。通过利用As3+与谷胱甘肽的结合作用及银纳米粒子对拉曼报告分子4-巯基吡啶显著的SERS增强效果,本方法表现出了优良的分析性能,如高的灵敏度(0.34μg/L)和宽的线性范围 (1~300μg/L),有望在现场检测中得以应用。
[1]Wang S, Mulligan C N. Occurrence of arsenic contamination in Canada: Sources, behavior and distribution. Sci Total Environ, 2006,366: 701-721.
[2]Yokel R A, Lasley S M, Dorman D C. The Speciation of Metals in Mammals Influences Their Toxicokinetics and Toxicodynamics and Therefore Human Health Risk Assessment. Journal of Toxicology and Environmental Health, Part B: Crit Rev, 2006, 9: 63-85.
[3]Mohan D, Pittman C U. Arsenic removal from water/wastewater using adsorbents—A critical review. Journal of Hazardous Materials, 2007,142: 1-53.
[4]Jain C K, Ali I. Arsenic: occurrence, toxicity and speciation techniques.Water Res, 2000, 34(17): 4304-4312.
[5] 戴树桂.环境化学.北京:高等教育出版社,1997:18.
[6]Fleischmann M, Hendra P J, McQuillan A J. Raman spectra of pyridine adsorbed at a silver electrode. Chem Phys Lett, 1974, 26: 163-166.
[7]Albrecht M G, Creighton J A. Anomalously intese Raman spectra of pyridine at a silver electrode. J Am Chem Soc, 1977, 99: 5215-5217.
[8]Grabar K C, Freeman R G, Natan M J. Self-assembled metal colloid monolayers: An approach to SERS substrates. Science, 1995, 267: 1629-1632.
[9] 余海湖, 周灵德, 姜德生. 纳米材料与自组装技术. 新技术·新方法, 2002, 24(4) : 216-218.
[10]Ghosh S K, Pal T. Interparticle coupling effect on the surface Plasmon resonance of gold nanoparticles: from theory to applications. Chem Rev, 2007, 107: 4797-4862. .
[11]Carron K, Mullen K, Lanouette M, et al. Selective-ultratrace detection of metal ions with SERS. Appl Spectrosc, 1991, 45: 420-423.
[12]Zamarion V M, Timm R A, Araki K, et al. Ultrasensitive SERS nanoprobes for hazardous metal ions based on trimercaptotriazine-modified gold nanoparticles. Inorg Chem, 2008, 47: 2934-2936.
[13]Yin J, Wu T, Song J B, et al. SERS-active nanoparticles for sensitive and selective detection of cadmium ion (Cd2+). Chem Mater, 2011, 23: 4756-4764.
[14]Chen L X, Fu X L, Li J H. Ultrasensitive 1 surface-enhanced Raman scattering detection of trypsin based on anti-aggregation of 4-mercaptopyridine-functionalized silver nanoparticles: an optical sensing platform toward proteases. Nanoscale, 2013, 5: 5905-5911.
[15]Lee P C, Meisel D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols. J Phys Chem, 1982, 86: 3391-3395.
[16]Chen Z, He Y J, Luo S L, et al. Label-free colorimetric assay for biological thiols based on ssDNA/silver nanoparticle system by salt amplification. Analyst, 2010, 135: 1066-1069.
[17]Mo L X, Liu D Z, Li W, et al. Effects of dodecylamine and dodecanethiol on the conductive properties of nano-Ag films. Applied Surface Science, 2011, 257(13): 5746-5753.

