ABL沉默对DOX和TRAIL诱导结肠癌细胞HT29凋亡的影响
李雨雨, 金由辛, 徐中娟, 张书忙, 索广力
(1.上海大学生命科学学院,上海200444;
2.中国科学院苏州纳米技术与纳米仿生研究所,江苏苏州215123)
Abelson(ABL)家族为非受体酪氨酸激酶(包括ABL1和ABL2),参与细胞增殖、存活等多种细胞进程,并在炎症反应、癌症及其他病变中起调节作用[1].ABL最初被认为能治疗白血病[2],为肿瘤治疗提供新的方法.但近期研究表明,结肠癌、乳腺癌、肺癌等实体瘤中ABL激酶的高表达和活化会引起细胞极性、侵袭、生长的改变[3-4].目前,美国食品和药品管理局(Food and Drug Administration,FDA)批准的抑制ABL激酶的药物包括伊马替尼和达沙替尼,已经用于实体瘤的检测[5].然而,由于实体瘤中信号通路激活后的复杂性以及耐药性的出现,这些抑制剂很可能具有多个靶细胞位点.因此,增强ABL抑制剂的特异性或与其他抗癌药物联合用药以降低耐药性显得尤为重要.
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)能够通过结合肿瘤细胞中高表达的受体DR4,DR5来选择性诱导肿瘤细胞凋亡,对正常细胞没有毒性[6],已成为新型抗肿瘤药物.然而,部分恶性肿瘤细胞降低了对TRAIL的敏感性甚至完全耐受[7].因此,联合一些放化疗药物如顺铂(cisplatin)、阿霉素(doxorubicin,DOX)、5-氟尿嘧啶(5-f l uorouracil)等增强TRAIL诱导肿瘤细胞凋亡的敏感性已成为新的研究热点[8].另外,TRAIL能够联合放化疗药物或小分子抑制剂(如PI3K,HSP90等)诱导结肠癌细胞凋亡[9-11].本工作证实了DOX能增强HT29细胞对TRAIL的敏感性,发现ABL的基因沉默能够抑制HT29细胞的增殖,但同时也能抑制细胞对TRAIL的敏感性,并且会减弱DOX增强TRAIL敏感性的作用.
1 材料与方法
1.1 细胞培养
人结肠癌HT29细胞和人肾上皮细胞293T购自美国模式培养物集存库(American type culture collection,ATCC),均用含10%胎牛血清(Sigma公司)和1%青霉素-链霉素的DMEM(Dulbecco’s modif i ed Eagle medium)培养基(Gibico公司)于含5%CO2,37◦C培养箱内培养.常规消化及传代,取对数生长期细胞用于后续实验.
1.2 试剂
TRAIL购于美国Peprotech公司,阿霉素和嘌呤霉素均购于Sigma公司.兔抗人抗体β-actin,ABL,PARP1,cleaved-caspase3和兔二抗IgG均购于Cell Signaling公司.转染试剂GeneTran TMⅢ(BIOMIGA)购于上海妙骏生物科技有限公司.细胞计数试剂盒8(cell count kit8,CCK8)和二辛可宁酸(bicinchonininc acid,BCA)蛋白定量试剂盒均购于碧云天生物技术有限公司.
1.3 方法
1.3.1 稳转细胞系的构建
构建ABL knockdown和过表达的慢病毒载体,其中shRNA有效序列为5’-GCAGTCATGAAAGAGATCAAACTC-3’,以空载体plko.1-non-target作为对照.重组质粒与辅助包装载体(PSPAX2和PMD2.G)共转染293 T细胞,空载体与辅助包装载体共转染293 T细胞作为对照,48 h后离心收集病毒上清.将病毒与生长培养基1∶1(摩尔比)混合后侵染结肠癌HT29细胞,24 h后换取新鲜培养基并用摩尔浓度为1µg/mL的puromycin进行持续筛选培养.1周左右可获得稳定转染的细胞克隆,然后进行扩大培养.将稳定转染plko.1-non-target和plko.1-ABL-shRNA质粒的HT29细胞分别命名为HT29-NT和HT29-ABL-Kd;将稳定转染小鼠ABL过表达质粒的HT29-ABL-Kd细胞命名为HT29-rescue;将未转染质粒的空白细胞命名为HT29-parental.最后用Western blot检测转染前后各组细胞中ABL的表达水平.
1.3.2 CCK8检测细胞增殖和药物毒性
细胞增殖检测:将细胞按照每孔2 000个接种于96孔板,培养4 h,待所有细胞贴壁后,进行第一次CCK8检测,设为0 h,分别在之后的24,30,48,60,72 h加入CCK8溶液,37◦C孵育2 h.用酶标仪于450 nm处检测各孔吸光值.进行数据分析时,将不同时间培养的细胞的吸光值标准化为第一次(0 h)检测吸光值.
药物毒性检测:将每孔8 000个细胞接种于96孔板,培养24 h后,分别加入不同摩尔浓度的DOX(0,0.1,0.2,0.5,1.0,2.0,4.0,6.0,8.0,10.0µg/mL)和TRAIL(0,1,5,10,20,50,100,200,500,1 000 ng/mL),继续培养24 h.更换新鲜培养液,加入CCK8溶液,于450 nm处测定吸光值.进行数据分析时,将不同摩尔浓度药物处理获得的吸光值标准化为浓度是0的吸光值.
1.3.3 Western blot检测ABL蛋白及凋亡相关蛋白的表达水平
细胞加药处理24 h后,裂解细胞,提取总蛋白,用BCA蛋白定量试剂盒进行蛋白定量.10%或12%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)后转膜,使蛋白转移至聚偏氟乙烯(polyvinylidene f l uoride,PVDF)膜上.转膜完成后,用三乙醇胺缓冲盐水(triethanolamine buあered saline,TBS)溶液配制含5%脱脂奶粉的封闭液,孵育2 h.然后加入β-actin,ABL,PARP1,cleaved-caspase3一抗孵育过夜,三羟甲基氨基甲烷盐酸吐温缓冲液(Tris buあered saline with Tween,TBST)洗膜后,再孵育辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔二抗.用增强化学发光(enhanced chemiluminecence,ECL)试剂盒显影,拍照.
1.3.4 流式细胞仪检测细胞凋亡
取对数生长期细胞3×105接种于6孔板,24 h后单独或联合加入亚毒性剂量的TRAIL 100 ng/mL和0.5µg/mL的阿霉素,继续培养24 h.磷酸盐缓冲液(phosphate buあer saline,PBS)洗两遍,胰酶消化,收集细胞,加入AnnexinⅤ染色.用流式细胞仪检测细胞凋亡情况,并统计细胞凋亡率.
2 结果与分析
2.1 ABL沉默稳转细胞株的构建及其对结肠癌HT29细胞增殖的影响
Western blot检测结果显示,与对照细胞HT29-NT相比,ABL knockdown细胞HT29-ABL-Kd中ABL蛋白表达量被显著下调(大于70%)(见图1(a)),说明转染plko.1-ABL-shRNA质粒后,该重组质粒能够有效沉默结肠癌HT29细胞中的ABL基因,成功构建了ABL沉默的稳转细胞株HT29-ABL-Kd.用CCK8检测ABL沉默对HT29细胞增殖活性的影响,结果显示ABL沉默能够明显抑制HT29细胞的增殖,在30,48,60,72 h,HT29-ABL-Kd的细胞增殖显著低于HT29-NT对照组(见图1(b),其中**表示P<0.01).
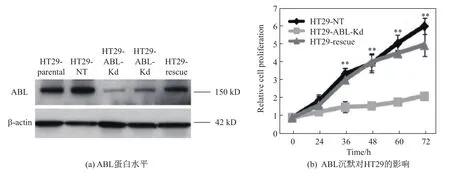
图1 不同转染后的结肠癌细胞中ABL蛋白水平和ABL沉默对HT29细胞增殖的影响Fig.1 Levels of ABL in diあerent transformed colorectal cancer cells and the eあects of ABL silencing on cell proliferation
2.2 DOX,TRAIL对结肠癌HT29细胞活性的影响
不同摩尔浓度DOX,TRAIL对HT29细胞活性影响的检测结果如图2所示,其中*表示与对照组相比P<0.05,**表示P<0.01.由图可见,DOX对HT29细胞的抑制作用具有浓度依赖性,即随着药物浓度的增加,HT29-ABL-Kd细胞与对照组细胞的存活率均呈下降趋势(见图2(a)).所得的DOX诱导HT29细胞调亡的亚毒性剂量0.5µg/mL可用于后续实验.TRAIL对HT29细胞的抑制作用也具有浓度依赖性,然而高浓度TRAIL对HT29-ABL-Kd细胞的抑制作用明显低于对照组(见图2(b)).TRAIL诱导HT29细胞凋亡的亚毒性剂量50或100 ng/mL可用于后续实验.结果表明,ABL沉默对阿霉素诱导结肠癌HT29细胞凋亡基本没有影响,但会抑制TRAIL对结肠癌细胞凋亡的影响.
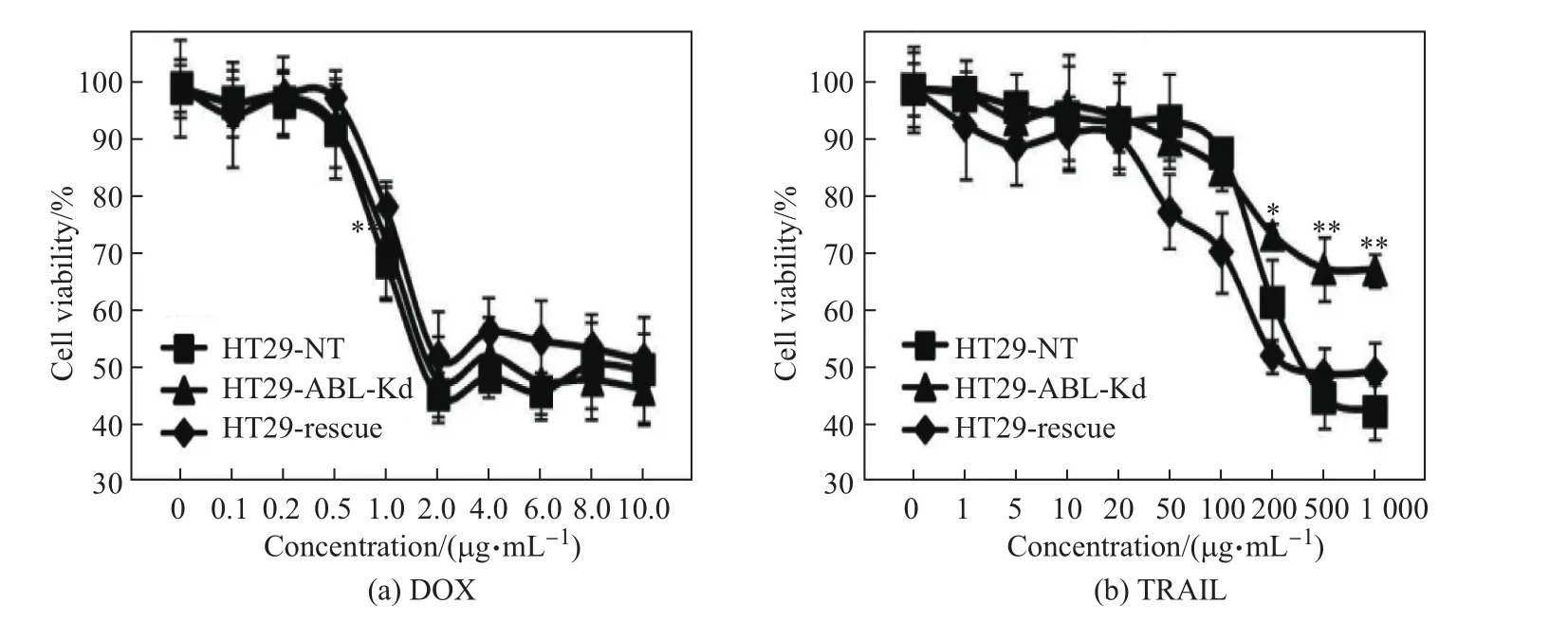
图2 不同摩尔浓度DOX,TRAIL对HT29细胞活性的影响Fig.2 Inhibitive eあects of HT29 cells viability after treated with various concentrations of DOX or TRAIL
2.3 ABL沉默对TRAIL和DOX诱导凋亡的影响
亚毒性剂量的TRAIL,DOX单独及联合作用于HT29-ABL-Kd细胞和对照组细胞时,均会发生细胞凋亡,并且联合作用的细胞凋亡率明显高于单独作用时.另外,ABL沉默对TRAIL诱导的凋亡并没有明显影响,对DOX诱导的凋亡有促进作用,并且对TRAIL和DOX联合诱导的凋亡有明显抑制作用(见图3,其中**表示P<0.01).可见,结肠癌HT29细胞中ABL的沉默会抑制TRAIL和DOX联合促进细胞凋亡的作用.
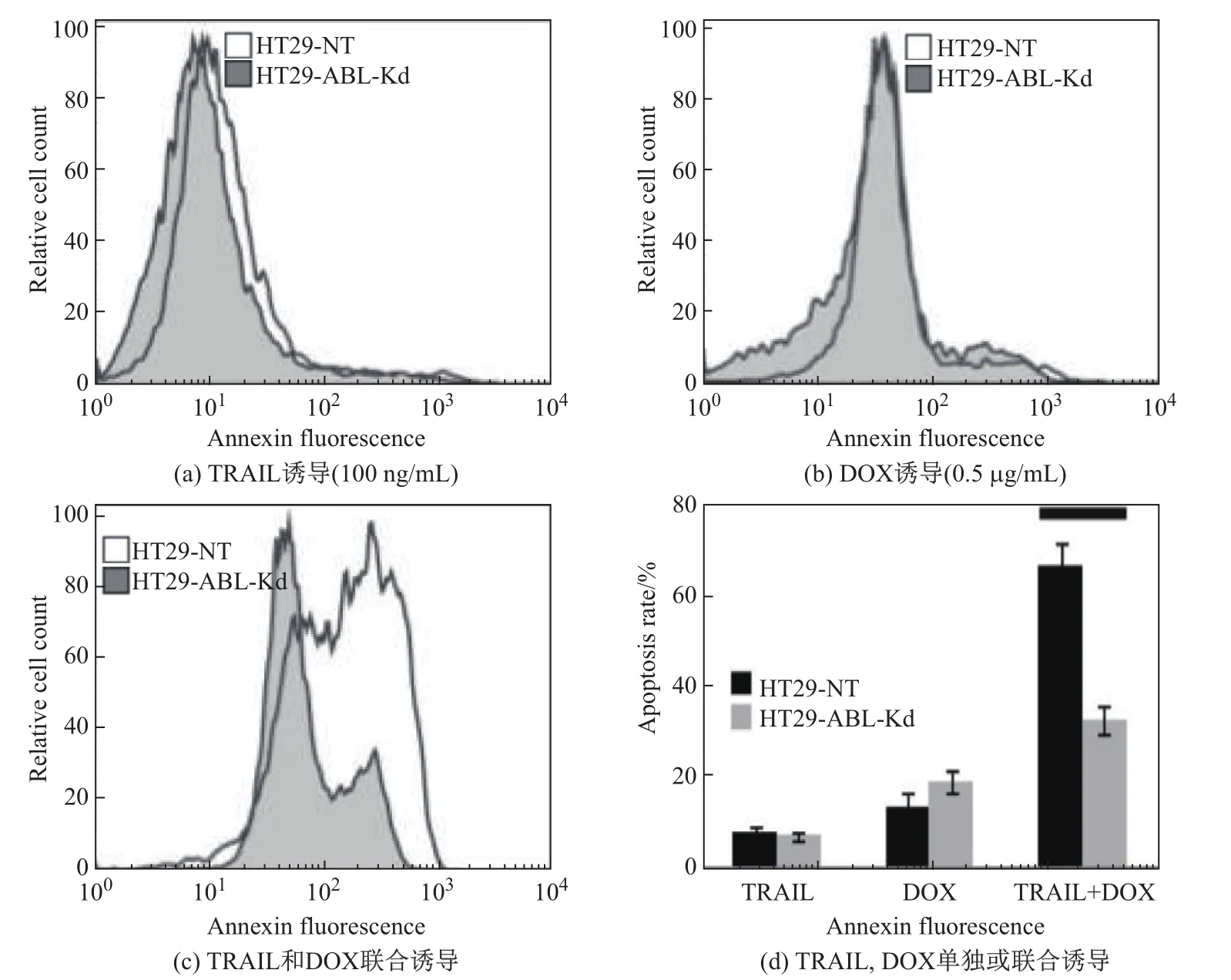
图3 流式细胞术检测ABL沉默对TRAIL,DOX单独和联合诱导HT29细胞凋亡率的影响Fig.3 Eあects of ABL silencing on the apoptosis rates of TRAIL,DOX alone or co-induced HT29 cell apoptosis detected by f l ow cytometry
2.4 ABL沉默对TRAIL和DOX诱导细胞凋亡相关蛋白表达水平的影响
50或100ng/mL的TRAIL单独作用于HT29-ABL-Kd和对照组细胞时,PARP1和caspase3会发生剪切,cleaved PARP1(86 kD)和cleaved-caspase3(19和17 kD)表达量增加.实验结果表明,单独使用TRAIL能够促进HT29-ABL-Kd细胞和对照组细胞的凋亡.0.5µg/mL的DOX单独作用于HT29-ABL-Kd细胞和对照组细胞时,cleaved PARP1表达量增加,说明DOX也可促进细胞凋亡.联合使用0.5µg/mL的DOX与50或100 ng/mL的TRAIL可以使cleaved PARP1和cleaved-caspase3的表达量均增加且高于单独作用时(见图4(b)).相应用药的细胞经流式分析的凋亡率与上述结果一致(见图4(a)).图4(a)和(b)中的ct代表未转染任何载体的HT29细胞,Kd代表HT29-ABL-Kd细胞.以上结果表明,联合使用0.5µg/mL的阿霉素和100 ng/mL的TRAIL可以有效促进结肠癌HT29细胞的凋亡,而ABL沉默会抑制DOX和TRAIL诱导的细胞凋亡.
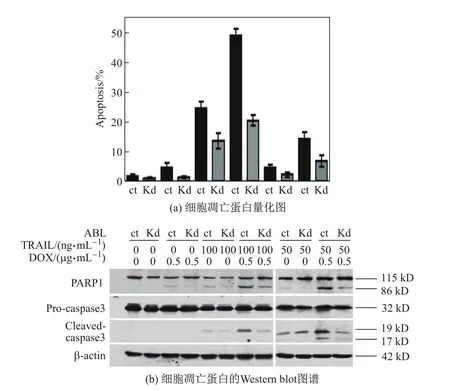
图4 HT29细胞凋亡蛋白量化图和Western blot图谱Fig.4 Apoptosis protein quantif i cation map and Western blot of HT29 cell
3 讨论
ABL最初被认定为是能够引发白血病的癌基因,目前一些小分子抑制剂如伊马替尼能有效治疗恶性肿瘤.前期研究发现,ABL沉默能够显著抑制结肠癌细胞的增殖.TRAIL能够诱导结肠癌细胞的凋亡,如HGS-ETR1(mapatumumab)已进入Ⅱ期临床试验阶段[12].但是,多种肿瘤细胞对TRAIL具有耐受性,这可能与TRAIL受体的下调、抗凋亡蛋白的增加等因素相关.有研究表明,联合一些放化疗药物增加TRAIL的敏感性已成为抗肿瘤的新方法.TRAIL联合5-氟尿嘧啶、奥沙利铂等化疗药物可以增强TRAIL诱导结肠癌细胞发生凋亡[13-14].DOX是一种能够有效治疗乳腺癌、肝癌的化疗药物,而针对结肠癌的相关研究还很少[15-16],TRAIL,DOX联合ABL沉默共同抗肿瘤的研究则更少.因此,本课题将TRAIL,DOX联合作用于结肠癌HT29细胞,结果发现DOX能够显著提高TRAIL诱导HT29细胞凋亡的能力,这可能与DOX能增强死亡受体DR5的表达来增强TRAIL的敏感性有关.另外,也可能与一些凋亡相关蛋白caspase-3及caspase-8的表达相关,其具体潜在的机制还需要进一步深入研究.本工作还将ABL基因沉默联合TRAIL,DOX共同作用于HT29细胞.结果表明,ABL基因沉默对DOX诱导细胞凋亡基本没有影响,但会抑制TRAIL和TRAIL联合DOX诱导的细胞凋亡,这可能是由于ABL沉默后对结肠癌细胞凋亡通路的影响与TRAIL对其凋亡通路的影响不一致所引发的.另外,在ABL沉默的细胞HT29-ABL-Kd中恢复ABL的表达,则TRAIL,TRAIL联合DOX对HT29-rescue细胞活性和细胞凋亡的抑制作用也会减弱.
综上所述,TRAIL,DOX联合用药可以有效杀伤结肠癌HT29细胞.虽然ABL沉默能抑制HT29细胞的增殖,但在结肠癌HT29细胞中抑制ABL的表达并不能促进DOX和TRAIL协同诱导细胞凋亡,反而会减弱DOX和TRAIL联合用药的作用.因此,TRAIL和DOX不能与抑制ABL激酶活性的药物共同作用于结肠癌细胞.这一研究成果为TRAIL联合用药治疗结肠癌提供了理论指导.
参考文献:
[1]KHATRI A,WANG J,PENDERGAST A M.Multifunctional Abl kinases in health and disease[J].J Cell Sci,2016,129(1):9-16.
[2]CHEVALIER C,CANNET A,DESCAMPS S,et al.ABL tyrosine kinase inhibition variable eあects on the invasive properties of diあerent triple negative breast cancer cell lines[J].PLoS One,2015,10(3):e0118854.
[3]WANG J,PENDERGAST A M.The emerging role of ABL kinases in solid tumors[J].Trends Cancer,2015,1(2):110-123.
[4]HUANG D Y,CHAO Y,TAI M H,et al.STI571 reduces TRAIL-induced apoptosis in colon cancer cells:c-Abl activation by the death receptor leads to stress kinase-dependent cell death[J].J Biomed Sci,2012,19(1):35.
[5]GREUBER E K,SMITH-PEARSON P,WANG J,et al.Role of ABL family kinases in cancer:from leukaemia to solid tumours[J].Nature Reviews Cancer,2013,13(8):559-571.
[6]DO M T,NA M K,KIM H G,et al.Ilimaquinone induces death receptor expression and sensitizes human colon cancer cells to TRAIL-induced apoptosis through activation of ROS-ERK/p38 MAPK-CHOP signaling pathways[J].Food and Chemical Toxicology,2014,71:51-59.
[7]KIM H B,KIM M J,LEE S H,et al.Amurensin G,a novel SIRT1 inhibitor,sensitizes TRAIL-resistant human leukemic K562 cells to TRAIL-induced apoptosis[J].Biochemical Pharmacology,2012,84(3):402-410.
[8]SRIDEVI P,NHIAYI M K,SETTEN R L,et al.Persistent inhibition of ABL tyrosine kinase causes enhanced apoptotic response to TRAIL and disrupts the pro-apoptotic eあect of chloroquine[J].PLoS One,2013,8(10):e77495.
[9]BYEON H J,LEE C,LEE S,et al.Doxorubicin-bound albumin nanoparticles containing a TRAIL protein for targeted treatment of colon cancer[J].Pharmaceutical Research,2016,33(3):615-626.
[10]COUSIN F J,JOUAN-LANHOUET S,TH´ERET N,et al.The probioticPropionibacterium freudenreichiias a new adjuvant for TRAIL-based therapy in colorectal cancer[J].Oncotarget,2016,7(6):7161-7178.
[11]SATURNO G,VALENTI M,BRANDON A D H,et al.Combining TRAIL with PI3 kinase or HSP90 inhibitors enhances apoptosis in colorectal cancer cells via suppression of survival signaling[J].Oncotarget,2013,4(8):1185-1198.
[12]丁燕飞,成小姣,朱黎明,等.XAFl增强TRAIL诱导人结肠癌细胞株HCTl16凋亡的实验研究[J].胃肠学,2013,18(4):211-215.
[13]谭明华,曹杰,王辉,等.TRAIL联合奥沙利铂对结肠癌细胞株SW480凋亡的影响[J].广东医学,2008(1):34-36.
[14]AKPINAR B,BRACHT E V,REIJNDERS D,et al.5-Fluorouracil-induced RNA stress engages a TRAIL-DISC-dependent apoptosis axis facilitated by p53[J].Oncotarget,2015,6(41):43679-43697.
[15]ISLAMIAN J P,AGHAEE F,FARAJOLLAHI A,et al.Combined treatment with 2-deoxy-D-glucose and doxorubicin enhances the in vitro eきciency of breast cancer radiotherapy[J].Asian Pacif i c Journal of Cancer Prevention,2014,16(18):8431-8438.
[16]ZHU X F,LI W,MA J Y,et al.Knockdown of heme oxygenase-1 promotes apoptosis and autophagy and enhances the cytotoxicity of doxorubicin in breast cancer cells[J].Oncology Letters,2015,10(5):2974-2980.本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn

