镉对大型溞心率和摄食能力的影响
郭鹄飞,张雪萍,孙 晨,黄志杰,王 兰,王 茜
(山西大学生命科学学院,山西太原 030006)
镉是一种具有较强毒性和蓄积性的环境污染物[1],尤其是工业活动产生相当数量的镉通过废气、废水、废渣排入环境,造成污染。研究表明,水体中的镉抑制了鱼类胚胎发育和体长增长[2],造成枝角类活动受限甚至死亡[3],并引起虾蟹类氧化应激[4-5]。同时,可通过生物富集和营养转移过程积累在生物体中,干扰机体正常的生理活动,最终危及食物链较高位置的生物体[6]。镉对动物的损伤器官包括消化系统、心脏等[7]。因此,镉污染已引起社会的普遍关注。
大型溞有类似于哺乳动物的肌原性心脏组织[8],还表现出与人类心率相似的特点;心率变化能够反映污染物对水生动物能量代谢的影响和血液循环系统污染物的程度[9]。大型溞的摄食率和滤水率作为摄食行为的标志可以很好地反映水环境的污染状况。摄食能力的变化将会对体细胞生长和个体繁殖产生干扰,进而影响到种群数量,甚至对整个水域生态系统的物质循环与能量流动产生较大的影响[10]。因此,大型溞心率和摄食能力的研究对水产养殖和水域生态环境有着重要意义。
本试验选取对水环境中污染物敏感的标准试验动物大型溞[11]作为研究对象,研究了大型溞在不同浓度镉暴露后的心率、摄食率和滤水率的变化,旨在为水域生态环境研究和工业废水排放标准提供理论依据。
1 材料和方法
1.1 试验材料
试验所用的大型溞已经在标准条件下培养了2 a以上,其敏感度达到GB/T 13266—91[12]的要求。水温控制在(20±1)℃,光暗比为 16 h∶8 h,pH 值7.2,溶氧量 7 mg/L。普通小球藻(Chlorella vulgaris)藻种购自中国科学院淡水藻种库,利用BG-11培养基在恒温光照培养箱中培养,温度为(25±1)℃,光照条件为3 000 lx,光暗比为12 h∶12 h,每隔2 h振摇一次,暗期则静置。试验时取一定量的小球藻,将藻液离心收集,按比例稀释到所需浓度。
1.2 试验设计
根据国家地表水环境质量标准[13],Ⅴ类水质的镉浓度标准限值的1倍,5倍,9倍设置1个空白对照及3个质量浓度组(Cd2+质量浓度分别为0.01,0.05,0.09mg/L)。试验前选取大小一致的含卵大型溞100只放入2L的烧杯中培养,18h后取走母溞,24h时选择个体大小基本一致的120只幼溞(1日龄)。每个试验组添加相同数量的小球藻和10只大型溞;同时设置对照组(加入相同数量的小球藻但不加大型溞)。小球藻的初始密度为5×105个/mL,在光照培养箱培养,温度(20±1)℃。在镉处理2,6,9,12 h时分别测定大型溞的心率、摄食率和滤水率。每个浓度组设3个平行,重复3次。
1.3 测定项目及方法
1.3.1 心率的测定 从各试验组中随机挑取成活的大型溞(以15 s内大型溞包括触角能够活动为准)10只,通过显微镜观察,用秒表计数统计心率(次 /min)[14]。
1.3.2 摄食率与滤水率的测定 利用光密度法测定小球藻密度。参考高亚辉等[15]的方法,计算滤水率(F)和摄食率(G)。
式中,F为滤水率(mL/(只·h)),即单个大型溞每小时过滤的食物溶液体积;G为摄食率(个/(只·h)),即单个大型溞每小时摄入的藻细胞数量;V为食物溶液体积(mL);N为大型溞的数量(只);C0为起始小球藻浓度(个/mL);Ct为对照组中最终小球藻浓度(个/mL);Ctf为试验组中剩余食物浓度(个 /mL);t为摄食时间(h)。
1.4 数据处理
利用SPSS 17.0统计软件对试验数据进行单因素方差分析(One-Way ANOVA),试验结果以平均值±标准差表示。*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2 结果与分析
2.1 镉胁迫对大型溞心率的影响
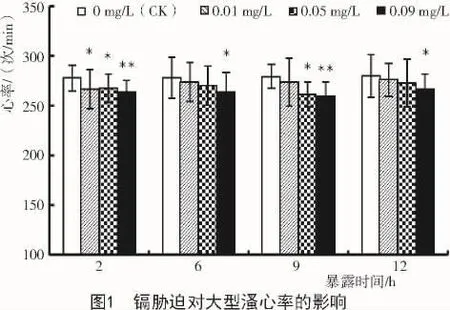
从图1可以看出,大型溞的心率随着镉浓度的增加呈下降趋势。镉处理2 h,质量浓度为0.01,0.05 mg/L时,大型溞的心率显著低于对照组(P<0.05);质量浓度为0.09 mg/L时,与对照组相比,大型溞的心率极显著降低(P<0.01)。镉处理6 h,质量浓度为0.09 mg/L时,大型溞的心率显著低于对照组(P<0.05),其他浓度组与对照组间无明显差异。镉处理9 h时,质量浓度为0.05 mg/L时,大型溞的心率显著低于对照组(P<0.05);质量浓度为0.09 mg/L时,大型溞的心率极显著低于对照组。镉处理12 h,镉质量浓度为0.09 mg/L时,大型溞的心率显著低于对照组(P<0.05),其他浓度组与对照组无显著性差异。
2.2 镉胁迫对大型溞摄食率和滤水率的影响
从图2可以看出,大型溞的摄食率随着镉浓度的升高呈下降趋势。镉处理2,6 h时,镉处理组大型溞的摄食率与对照组相比无显著性差异;镉处理9 h,质量浓度为0.05,0.09 mg/L时,大型溞的摄食率极显著低于对照组(P<0.01)。镉处理12 h,质量浓度为0.05 mg/L时,大型溞的摄食率较对照组显著降低(P<0.05);质量浓度为0.09 mg/L时,摄食率极显著低于对照组(P<0.01)。此外,镉处理时间为6,9,12 h时,摄食率与心率存在相关性,相关系数分别达 0.974 1,0.972 6 和 0.976 6(表 1)。
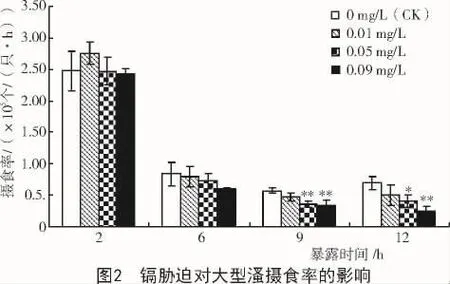
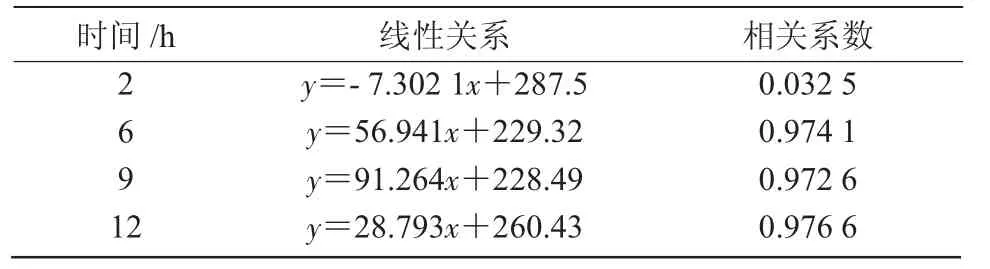
表1 镉胁迫下大型溞摄食率与心率的相关性分析
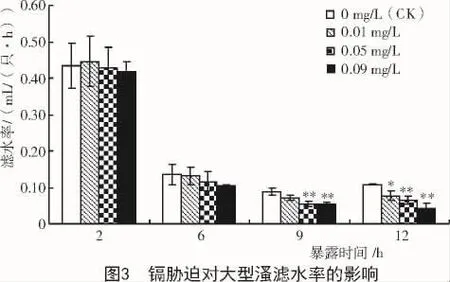
从图3可以看出,镉胁迫后大型溞滤水率的变化与摄食率的变化趋势相似,滤水率随着镉质量浓度的升高也呈现下降的趋势。镉处理2,6 h时,镉处理组大型溞的滤水率与对照组相比无显著性差异;镉处理9 h,质量浓度为0.05,0.09 mg/L时,大型溞的滤水率与对照组相比极显著降低(P<0.01);镉处理12 h,质量浓度为0.01 mg/L时,大型溞的滤水率显著低对照组(P<0.05);质量浓度为0.05,0.09 mg/L时,大型溞的滤水率极显著低于对照组(P<0.01)。
3 讨论
在生态毒理学研究中,心率的变化是机体对污染物早期的应激反应之一,心率常用于评估某些化学品和药物的毒性。有文献报道,全氟辛烷磺酸胁迫下水溞心率紊乱[16];四氢嘧啶通过对水溞心肌收缩酶的氧化修饰,从而导致心率下降[17]。镉致斑马鱼发生氧化应激,诱导细胞凋亡和免疫毒性使得心率下降[18]。本试验中,大型溞的心率随着镉浓度的增加呈下降趋势,镉质量浓度为0.09 mg/L时,大型溞心率显著或极显著降低。这与前人的研究结果一致,可能是因为镉通过对心肌细胞钙离子通道的阻滞作用[19]或者是镉从细胞结合位点置换钙,并通过竞争机制来拮抗心脏中的钙依赖性反应。
摄食是获得个体生命活动所需营养物质和能量的基本行为[20],摄食能力(滤水率和摄食率)的变化可以很好地反映水环境的污染状况。据报道,毒物(农药)和纳米材料(如TiO2,纳米塑料和纳米C60)会影响水溞的摄食行为[21],造成摄食率和滤水率降低;其中,水溞暴露于C60后,C60会蓄积在水溞的体内,对消化道产生损伤。而镉离子可直接造成胃平滑肌收缩力降低[22]。此外,消化系统的绝大部分器官受迷走神经的支配[23],消化系统的功能失调,使得大型溞的摄食行为受到影响。本试验中,大型溞的滤水率与摄食率在镉胁迫后受到抑制;且镉浓度的增加抑制了心率,心率受到抑制意味着供应给细胞的氧气和营养减少。而骨骼肌需要氧气和营养物质用于运动[24],因此,水溞附肢运动的减少也会降低其摄食能力。所以,心率的紊乱会间接抑制水溞的摄食活动。这与本试验得出的心率与摄食率的变化之间的相关系数达0.974 1,0.972 6和0.976 6的结果相一致。
综上所述,镉可能通过毒害大型溞的循环系统、神经系统和消化系统抑制其心率及摄食能力。但其深入的机制还有待于进一步研究。
参考文献:
[1] ZHOU Y,JING W,DAHMS H U,et al.Oxidative damage,ultrastructural alterations and gene expressions of hemocytes in the freshwater crab Sinopotamon henanense,exposed to cadmium[J].Ecotoxicology&Environmental Safety,2017,138:130-138.
[2]鲁疆,王占洋,袁玉婷,等.氯化镉对斑马鱼胚胎的发育毒性[J].生态毒理学报,2013,8(3):381-388.
[3] SEMSARI S,MEGATELI S.Effect of cadmium toxicity on survival and phototactic behaviour of Daphnia magna[J].Environmental Technology,2007,28(7):799.
[4] XIAN J A,LI B,GUO H,et al.Haemocyte apoptosis of the tiger shrimp exposed to cadmium[J].Bulletin of Environmental Contamination&Toxicology,2013,92(5):525-528.
[5]陈红苗,许鹏,井维鑫,等.镉对河南华溪蟹副性腺组织的氧化性损伤作用[J].环境科学学报,2017,37(5):1999-2005.
[6]刘金虎.莱州湾多相介质重金属污染特征及其在食物链(网)的传递与生物放大作用[D].青岛:中国科学院研究生院(海洋研究所),2013.
[7]黄林.镉对南方鲇血液学指标和造血器官的影响 [D].重庆:西南大学,2010.
[8] CAMPBELL A K,WANN K T,MATTHEWS S B.Lactose causes heart arrhythmia in the water flea Daphnia pulex[J].Comparative Biochemistry&Physiology Part B Biochemistry&Molecular Biology,2004,139(2):225.
[9]VILLEGAS-NAVARRO A,ROSAS-L E,REYES J L.The heart of Daphnia magna:Effect of four cardioactive drugs[J].Comparative Biochemistry&Physiology Part C Toxicology&Pharmacology,2003,136(2):127-134.
[10] HARRIS K D,BARTLETT N J,LLOYD V K.Daphnia as an emerging epigenetic model organism[J].Genetics Research International,2012(2):147892.
[11]SEDAJ,PETRUSEKA.Daphnia as a model organismin limnology and aquatic biology:some aspects of its reproduction and development[J].Journal ofLimnology,2011,70(2):335-386.
[12]国家环境保护总局.水质、物质对溞类(大型溞)急性毒性测定方法 GB/T13266—91[S].北京:中国标准出版社,1991.
[13]国家环境保护总局.地表水环境质量标准 GB 3838—2002[S].北京:中国标准出版社,2002.
[14]王茜.苯酚对多刺裸腹溞生长繁殖代谢与氧化损伤的影响[D].太原:山西大学,2014.
[15]高亚辉,李松.瘦尾胸刺水蚤摄食率的观察实验[J].热带海洋学报,1990(3):59-65.
[16]LIANG R,HE J,SHI Y,et al.Effects of Perfluorooctane sulfonate on immobilization,heartbeat,reproductive and biochemical performance ofDaphnia magna[J].Chemosphere,2017,168:1613-1618.
[17] BOWNIK A,STEPNIEWSKA Z.Ectoine alleviates behavioural,physiological and biochemical changes in Daphnia magna,subjected to formaldehyde[J].Environmental Science&Pollution Research International,2015,22(20):15549-15562.
[18]殷健.重金属对斑马鱼的毒性效应及作用机制研究[D].北京:北京协和医学院,2014.
[19]李爱红,侯天德,程昉,等.镉对兔血压和离体主动脉平滑肌张力的影响 [J].中华劳动卫生职业病杂志,2006,24(11):666-668.
[20]罗艳蕊,李效宇,皇培培,等.不同碳链长度的离子液体对大型溞摄食行为的影响 [J].应用与环境生物学报,2008,14(3):383-387.
[21]LV X,HUANG B,ZHU X,et al.Mechanisms underlying the acute toxicity of fullerene to Daphnia magna:Energy acquisition restriction and oxidative stress[J].Water Research,2017,123:696.
[22] NISHIYAMA S,SAITO N,KONISHI Y,et al.Cardiotoxicity in magnesium-deficient rats fed cadmium[J].Journal of Nutritional Science&Vitaminology,1990,36(1):33.
[23]孙娜.大鼠迷走神经背核电刺激与小肠电活动的相关性的解析[D].天津:天津医科大学,2008.
[24]JEONG T Y,YOON D,KIMS,et al.Mode of action characterization for adverse effect of propranolol in Daphnia magna based on behavior and physiology monitoring and metabolite profiling[J].Environmental Pollution,2017,233(1):99.

