动态对比增强MRI对脊柱骨髓瘤和原发非霍奇金淋巴瘤的鉴别诊断
郎宁,张恩龙,苏敏英,袁慧书*
动态对比增强MRI对脊柱骨髓瘤和原发非霍奇金淋巴瘤的鉴别诊断
郎宁1,张恩龙2,苏敏英3,袁慧书1*
1.北京大学第三医院放射科,北京 100191; 2.北京大学国际医院放射科,北京 102206; 3.加利福尼亚大学欧文分校肿瘤功能成像中心,美国加利福尼亚 95101;
探讨动态对比增强MRI对脊柱浆细胞骨髓瘤(PCM)、骨的孤立性浆细胞瘤(SPB)和骨的原发性非霍奇金淋巴瘤(PNHLB)的鉴别诊断价值。对病理证实的11例PCM、12例SPB和13例PNHLB做动态对比增强MRI,比较各组信号强度-时间曲线类型、曲线最大上升线性斜率(Max Wash-in SE%)、曲线下降斜率(Wash-out SE%)及增强曲线下的初始面积(IAUC)等。11例PCM和12例SPB均为速降型曲线,1例PNHLB为速降型曲线,12例PNHLB为平台型曲线。PCM和SPB的Max Wash-in SE%、Wash-out SE%、IAUC差异均无统计学意义(>0.05)。其中,以Wash-out SE%、Max Wash-in SE%、IAUC分别为21.38%、148%、2.47作为诊断骨髓瘤(包括PCM和SPB)和PNHLB的阈值时,诊断敏感度、特异度分别为95.7%、84.6%;69.6%、69.2%;73.9%、76.9%。受试者工作特性(ROC)曲线分析Wash-out SE%、Max Wash-in SE%、IAUC诊断骨髓瘤的曲线下面积分别为0.886、0.763、0.756。动态对比增强MRI可为脊柱造血系统肿瘤的鉴别诊断提供参考。
多发性骨髓瘤;浆细胞瘤;淋巴瘤,非霍奇金;脊柱;磁共振成像;图像增强;诊断,鉴别
脊柱骨髓瘤和恶性淋巴瘤均是起源于骨的造血系统肿瘤,发病年龄和临床症状无特异性。MRI信号、软组织肿块形态等征象可以为两者的鉴别提供依据[1-2],但是如果表现不典型,则非常容易误诊,而两者治疗采用的化疗方案截然不同[3]。因此正确诊断对临床治疗方法的选择和预后判断尤为重要。本研究对两者的动态对比增强(dynamic contrast-enhanced,DCE)MRI特点进行初步研究,通过对信号强度-时间曲线及半定量参数进行分析,探讨其在两者鉴别诊断中的价值,为常规影像学难以鉴别的造血系统肿瘤提供一种简单、直观的鉴别方法。
1 资料与方法
1.1 研究对象 选取北京大学第三医院2009年3月—2016年4月经手术病理或穿刺活检证实的11例脊柱浆细胞骨髓瘤(plasma cell myeloma,PCM),其中男6例,女5例,平均年龄(56.7±8.5)岁;12例骨的孤立性浆细胞瘤(solitary plasmacytoma of bone,SPB),其中男5例,女7例,平均年龄(52.1±6.0)岁;13例骨的原发性非霍奇金淋巴瘤(primary non-Hodgkin lymphoma of bone,PNHLB),其中男8例,女5例,平均年龄(56.5±18.4)岁。回顾性分析患者的临床和影像学资料,所有患者在化疗和放疗前均进行脊柱或多部位的DCE-MRI检查,同时对患者进行穿刺活检或细胞学检查,并按PCM、SPB及PNHLB的诊断标准确诊[4-6]。
1.2 仪器与方法 采用Siemens Trio 3.0T 超导型MR扫描仪。采用常规快速自旋回波序列,包括横断面、矢状位T2WI、矢状位T2WI压脂序列。采用高压注射器以2 ml/s注射钆喷替酸葡甲胺,剂量为0.1 mmol/kg。Siemens DCE-MRI序列参数设置:FLASH 3D VIBE序列,TR 4.1 ms,TE 1.5 ms,反转角10°,分辨率256×192,视野250 mm×250 mm,共采集30个层块;采集时间10~14 s,共采集12组,总时长120~168 s。
1.3 图像分析 由2名放射科副主任医师独立对图像进行分析,于强化最明显区域手动勾勒出0.5~1.2 cm2的感兴趣区,避开囊性病变、钙化、坏死和出血等区域。随后采用Siemens Sygno Mean Curve软件获得信号强度-时间曲线,曲线分为以下3种类型,①速降型:1 min左右到达峰值,此后信号下降超过10%;②平台型:在1 min以后,信号强度变化水平保持在10%以内;③持续上升型:1 min后信号持续增加超过10%[7]。由于时间分辨率略有不同,各研究对象的DCE数据采集点并非完全一致。根据公式(1)~(4)计算曲线最大上升线性斜率(Max Wash-in SE%)、曲线下降斜率(Wash-out SE%)、增强曲线下的初始面积(initial area under curve,IAUC)。
Max Wash-in SE%=(SI2-SI1)/SIinitial×100% (1)
Wash-out SE%= [(SIpeak–SIlast)/SIinitial]×100% (2)
Wash-out SE%= [(SI67sec–SIlast)/SIinitial]×100% (3)
IAUC=(SIn1+SIn2+ SIn3+···+SInn)/n/SIinitial(4)
其中,中SI2和SI1代表信号强度-时间曲线上升信号增幅最大的两点的信号强度,SIinitial代表注药前信号强度(下同),SIpeak为曲线达到峰值时的信号强度,SIlast为采集结束时的信号强度;如果曲线在最初的60 s内未出现峰值,则采用公式(3),SI67sec代表第67秒信号强度,SIlast代表采集结束时的信号强度。公式(3)中IAUC计算则取注药后至67 s或67 s后最近一个采集时间点的平均信号增强程度[7-8],SIn1、SIn2、SIn3···SInn为注药后至67 s时或67 s后最近一个采集点的各时间点信号强度,n为信号采集次数。
1.4 统计学方法 采用SPSS 22.0软件,骨髓瘤(含PCM和SPB)和PNHLB不同的DCE曲线类型的差异采用Fisher确切概率法;PCM、SPB和PNHLB的DCE参数的差异比较采用单因素方差分析,方差不齐时,采用Dunnett3法,满足方差齐性时,采用Bonferroni法。利用受试者工作特性(ROC)曲线确定各DCE参数对骨髓瘤(含PCM和SPB)和PNHLB的最佳鉴别诊断阈值,并计算诊断的敏感度和特异度。<0.05表示差异有统计学意义。
2 结果
2.1 DCE曲线特征 PCM、SPB和PNHLB的增强曲线类型和曲线参数见表1及图1~3。11例PCM与12例SPB患者均为速降型曲线。13例PNHLB患者中,1例为速降型曲线,12例为平台型曲线。骨髓瘤(含PCM和SPB)和PNHLB的DCE曲线类型表现差异有统计学意义(<0.05)。

表1 PCM、SPB和PNHLB的DCE曲线类型和曲线参数
注:*含PCM和SPB

图1 男,53岁,PCM。T1WI矢状位,T12、L2、L5椎体骨质破坏,病变呈低信号(A);T2WI脂肪抑制矢状位,病变呈高信号(B);T1WI增强扫描,病变明显强化(C);病变的信号强度-时间曲线呈速降型(D)
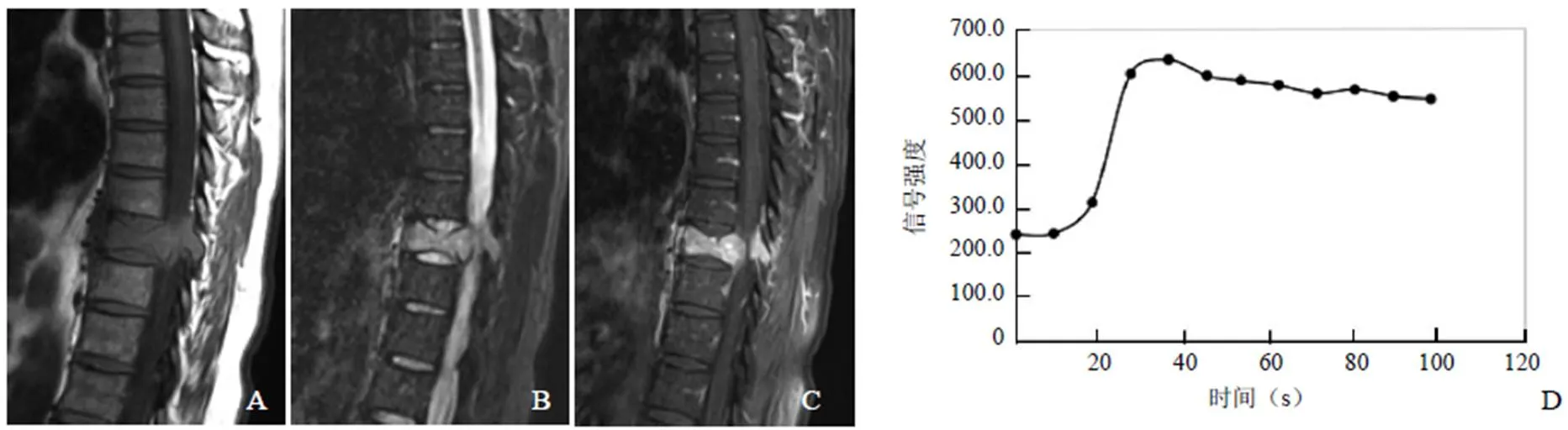
图2 男,48岁,SPB。T1WI矢状位,T9椎体骨质破坏,局部见软组织肿块影,椎体变扁(A);T2WI脂肪抑制矢状位,病变呈高信号(B);T1WI增强扫描,病变明显强化(C);病变的信号强度-时间曲线呈速降型(D)
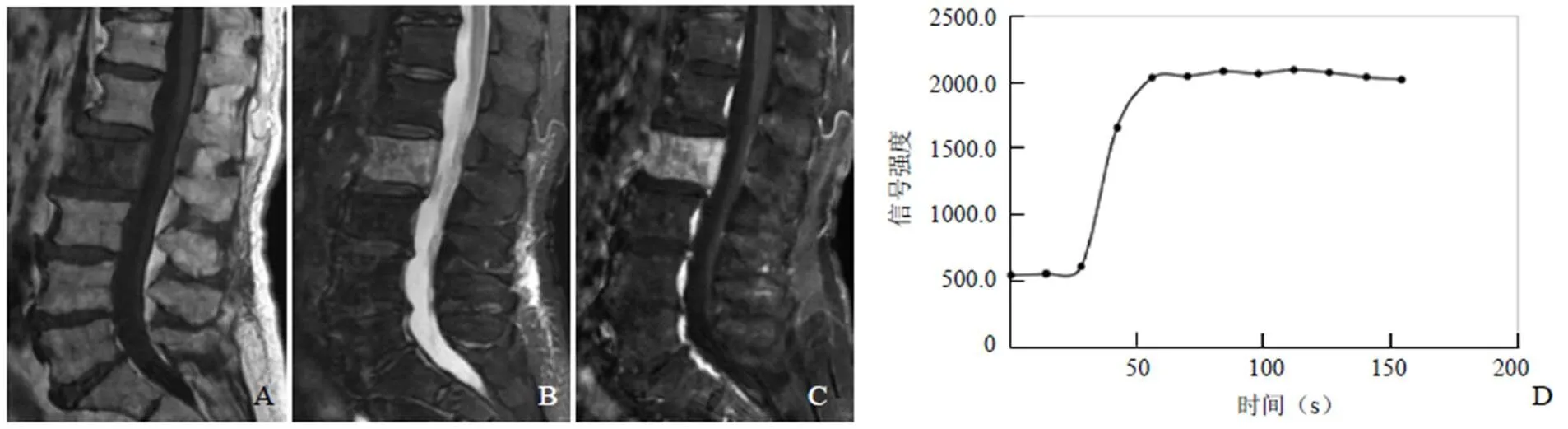
图3 女,79岁,PNHLB。T1WI矢状位,L2椎体骨质破坏,病变呈低信号(A);T2WI脂肪抑制矢状位,病变呈高信号(B);T1WI增强扫描,病变明显不均匀强化(C);病变的信号强度-时间曲线呈平台型(D)
2.2 DCE曲线参数分析 PCM和SPB之间Max Wash-in SE%、Wash-out SE%、IAUC差异无统计学意义(>0.05);PCM和PNHLB之间Wash-out SE%差异有统计学意义(<0.05);SPB和PNHLB之间3个参数差异均有统计学意义(<0.05),见表2。3种DCE曲线参数对骨髓瘤(含PCM和SPB)和PNHLB的鉴别诊断最佳诊断阈值利用ROC法进行分析,其诊断效能见表3。
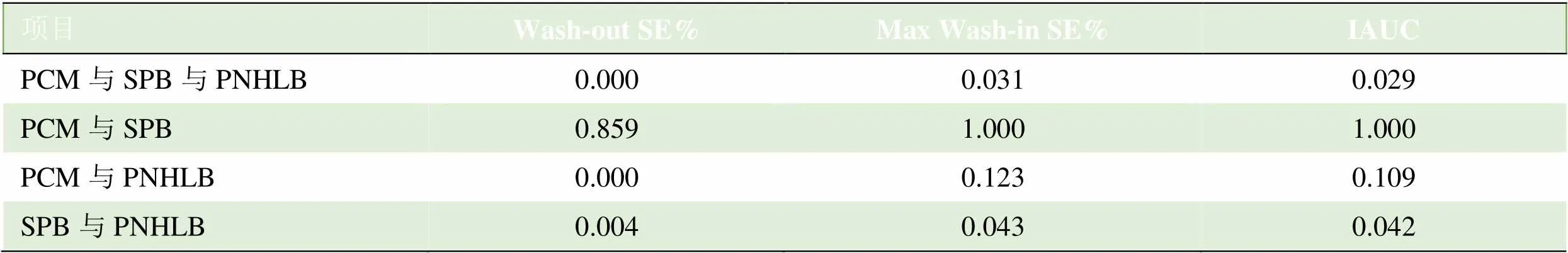
表2 PCM、SPB和PNHLB之间DCE曲线参数的比较
注:Wash-out SE%满足方差齐性,Max Wash-in SE%、IAUC方差不齐

表3 Wash-out SE%、Max Wash-in SE%、IAUC对骨髓瘤(含PCM和SPB)和PNHLB的诊断效能
3 讨论
起源于骨骼的造血系统肿瘤均非良性,既往病理分型中广义上分为骨髓瘤、淋巴瘤,而在2013版WHO骨肿瘤病理分类中,因骨髓瘤的多发性病变和孤立性病变预后不同,将来源于骨骼的造血系统肿瘤分为PCM、SPB、PNHLB三类[9],将SPB从PCM中分列出来,并且重新定义。PCM又称为多发性骨髓瘤,分类中认为其为多中心性,常侵犯不同器官;而SPB则被定义为单中心性,无系统性损害,但是两者病理表现、免疫表型及遗传学特征一致,且均可表现为溶骨性、成骨性或混合性骨质破坏,以溶骨性破坏多见,T1WI上病变呈等或低信号,而在T2WI上的信号则报道不一,以往认为呈高信号,但是部分学者认为以低信号或等信号为主[1,10]。而骨骼的恶性淋巴瘤又称为PNHLB,其好发年龄为50~60岁,且好发于胸椎[2],多呈虫蚀状骨质破坏,极少数可表现为成骨性改变或混合性改变。因肿瘤内部细胞成分较多,间质及水分含量相对较少,因此其在MR T1WI上多呈等、低信号,T2WI上多呈等信号[1,11]。脊柱的骨髓瘤和淋巴瘤常规MRI表现相似,单纯通过影像学表现鉴别较困难。治疗前一般需依靠血液检查和CT引导下病灶穿刺活检等有创操作确诊,如果能通过无创检查为治疗前提供准确诊断,则可给临床医师和患者带来巨大帮助。因此,本研究采用DCE-MRI鉴别诊断脊柱骨髓瘤和PNHLB,提高治疗前的诊断准确性。
以往DCE-MRI研究中常将DCE曲线类型应用于良、恶性病变的鉴别,既往研究发现,速降型曲线代表恶性肿瘤中细胞密集而间质成分较少的部位,由于对比剂很少在细胞间隙中留存而迅速流出,造成曲线迅速下降,认为速降型曲线高度提示恶性病变[12]。本研究,结果显示,11例PCM及12例SPB的DCE曲线类型表现一致,均为速降型曲线,13例PNHLB患者中,1例为速降型曲线,12例为平台型曲线。骨髓瘤(含PCM和SPB)和PNHLB的DCE曲线类型表现差异有统计学意义(<0.05)。因此,DCE曲线类型的结果提示如果是速降型曲线应首先考虑骨髓瘤,如果是平台型曲线则应主要考虑PNHLB,DCE曲线类型可以为两者的鉴别提供很好的参考。既往研究中充分肯定了DCE-MRI半定量参数对良、恶性病变的鉴别价值[12-13],并且少数研究也将其应用于恶性病变之间的鉴别,Schlemmer等[14]研究证实,肿瘤组织开始强化到相邻的正常组织强化的时间区间,高分化癌较低分化癌时间长。本研究通过对数据进行半定量分析,显示的结果与相应的DCE曲线类型一致,造影剂进入和流出的曲线参数Max Wash-in SE%、IAUC、Wash-out SE%在PCM及SPB之间差异均无统计学意义(>0.05),这与两者的病理学特点相符,而Wash-out SE%在骨髓瘤(含PCM和SPB)和PNHLB间差异均有统计学意义(<0.05),可能与两者肿瘤血管及组织学差异有关。
骨髓瘤细胞之间的间质成分少,富含新生的毛细血管样的微血管,且微血管密度较高,结构多不完整,管腔不规则、壁薄,走行紊乱,动、静脉区别不明显,部分血管壁内皮细胞缺失,极少见到肌层和外膜[9],这种病理结构导致造影剂会很快进入骨髓瘤组织,早期强化明显、快速,并且造影剂不易留存,而快速回流到血管中被清除掉;而PNHLB病理上由细胞成分单一的瘤细胞构成,瘤细胞核大,形态不规则,核仁明显,胞质嗜碱性,细胞边界清晰,瘤细胞之间常有纤细网状纤维,既往称为“网织细胞肉瘤”,这种不同程度的纤维化可能是造成PNHLB造影剂存留的原因[9]。因此,骨髓瘤的DCE曲线显示在比较短的时间信号强度即达到高峰,Max Wash-in SE%、Wash-out SE%也较大。其中,IAUC是对比剂注射后多个时间点下的平均信号强度,是最能反映最初上升期信号强度增加速度的参数[8],同样证实了骨髓瘤与PNHLB之间的组织学差异。
总之,DCE-MRI获得的Max Wash-in SE%、Wash-out SE%、IAUC对脊柱骨髓瘤和PNHLB具有一定的鉴别诊断价值,如果常规MRI鉴别困难,可以参考MRI增强曲线参数为鉴别诊断提供依据,为临床选择治疗方法提供更多的信息,同时,DCE-MRI也为两者的鉴别诊断提供了一种简单易行的方法。本研究样本量较少,有待今后增加样本量进一步验证结论。
[1] Huang W, Cao D, Ma J, et al. Solitary plasmacytoma of cervical spine: treatment and prognosis in patients with neurological lesions and spinal instability. Spine (Phila Pa 1976), 2010, 35(8): E278-E284.
[2] Ramadan KM, Shenkier T, Sehn LH, et al. A clinicopathological retrospective study of 131 patients with primary bone lymphoma: a population-based study of successively treated cohorts from the britishcolumbia cancer agency. Ann Oncol, 2007, 18(1): 129-135.
[3] Horwitz SM, Zelenetz AD, Gordon LI, et al. NCCN Guidelines Insights: non-Hodgkin's lymphomas, Version 3. 2016. J Natl ComprCancNetw, 2016, 14(9): 1067-1069.
[4] 中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2015年修订). 中华内科杂志, 2015, 54(12): 1066-1070.
[5] Soutar R, Lucraft H, Jackson G, et al. Guidelines on the diagnosis and management of solitary plasmacytoma of bone and solitary extramedullary plasmacytoma. Br J Haematol, 2004, 124(6): 717-726.
[6] Coley BL, Higinbotham NL, Groesbeck HP. Primary reticulum cell sarcoma of bone: summary of 37 cases. Radiology, 1950, 55(5): 641-658.
[7] Lang N, Su MY, Yu HJ, et al. Differentiation of myeloma and metastatic cancer in the spine using dynamic contrast-enhanced MRI. Magn Reson Imaging, 2013, 31(8): 1285-1291.
[8] Lang N, Su MY, Xing X, et al. Morphological and dynamic contrast enhanced MR imaging features for the differentiation of chordoma and giant cell tumors in the axial skeleton. J Magn Reson Imaging, 2017, 45(4): 1068-1075.
[9] Jo VY, Fletcher CD.WHO classification of soft tissue tumours: an update based on the 2013 (4th) edition. Pathology, 2014, 46(2): 95-104.
[10] 李建, 范国光, 徐克. 脊柱孤立性浆细胞瘤的X线、CT和MRI表现. 中国医学影像学杂志, 2009, 17(6): 454-456.
[11] White LM, Schweitzer ME, Khalili K, et al. MR imaging of primary lymphoma of bone: variability of T2-weighted signal intensity. Am J Roentgenol, 1998, 170(5): 1243-1247.
[12] Van Der Woude HJ, Bloem JL, Verstraete KL, et al. Osteosarcoma and ewing's sarcoma after neoadjuvant chemotherapy: value of dynamic MR imaging in detecting viable tumor before surgery. Am J Roentgenol, 1995, 165(3): 593-598.
[13] 丁庆国, 胡春洪, 丁乙, 等. 早期动态MRI增强斜率值在肌骨系统良恶性肿块中的鉴别诊断价值. 实用放射学杂志, 2003, 19(3): 240-243.
[14] Schlemmer HP, Merkle J, Grobholz R, et al. Can pre-operative contrast-enhanced dynamic MR imaging for prostate cancer predict microvessel density in prostatectomy specimens? Eur Radiol, 2004, 14(2): 309-317.
(本文编辑 周立波)
Dynamic Contrast-enhanced MRI in Differential Diagnosis of Spinal Myeloma and Primary Non-Hodgkin Lymphoma
LANG Ning1, ZHANG Enlong2, SU Minying3, YUAN Huishu1*
To explore the value of dynamic contrast-enhanced MRI in differential diagnosis of spinal plasma cell myeloma (PCM), solitary plasmacytoma of bone (SPB) and primary non-Hodgkin lymphoma of bone (PNHLB).Eleven PCM, 12 SPB and 13 PNHLB confirmed by pathology received dynamic contrast-enhanced MRI. Signal intensity-time curve, the steepest wash-in SE% during the ascending phase (Max Wash-in SE%), the wash-out SE% and the initial area under enhanced curve (IAUC) and other parameters were compared.Both 11 PCM and 12 SPB showed the wash-out pattern. One PNHLB was the wash-out pattern and 12 PNHLB were the plateau pattern. Difference of Max Wash-in SE%, Wash-out SE% and IAUC of PCM and SPB was of no statistical significance (>0.05), among which sensitivity and specificity of diagnosis were 95.7% and 84.6%, 69.6% and 69.2%, 73.9% and 76.9% respectively when taking 21.38% Wash-out SE%, 148% Max Wash-in SE% and 2.47 IAUC as the threshold value for diagnosing myeloma (including PCM and SPB) and PNHLB. The area under curve of Wash-out SE%, Max Wash-in SE% and IAUC when diagnosing myeloma was 0.886, 0.763 and 0.756 respectively according to ROC analysis.Dynamic contrast-enhanced MRI can provide reference for the differential diagnosis of spinal hematopoietic neoplasms.
Multiple myeloma; Plasmacytoma; Lymphoma, non-hodgkin; Spine; Magnetic resonance imaging; Image enhancement; Diagnosis, differential
R445;R738.1
10.3969/j.issn.1005-5185.2018.02.014
2017-10-15
2018-01-18
国家自然科学基金(81701648,81471634);北京市自然科学基金(7164309)

Chinese Journal of Medical Imaging, 2018, 26 (2): 135-139
*Address

