黄连素对2型糖尿病大鼠脂肪肝的治疗作用及机制研究
张 韫 ,赵宗江 ,李 忻 ,张浩军 ,赵婷婷 ,杨 鑫 ,严美花 ,李 平 ★
(1.北京中医药大学,北京 100029;2.中日友好临床医学研究所;北京市免疫炎性疾病重点实验室,北京 100029)
近年来,在全球范围内糖尿病的发病率呈持 续上升的趋势,其中2型糖尿病(type 2 diabetes mellitus,T2DM)接近 90%[1]。 过去人们对糖尿病的聚焦点主要在神经损害、血管损害、肾损害,然而肝脏作为调节血糖最重要的器官,肝功能在糖尿病治疗中的作用正被更多关注[2]。非酒精性脂肪肝 (non-alcoholic fatty liver disease,NAFLD) 在T2DM患者中流行比例达34%,在伴有肥胖的T2DM患者中NAFLD几乎普遍存在[3]。NAFLD可引起胰岛素抵抗、血脂代谢紊乱、脂质过氧化终产物增加等一系列异常情况[4]。中药黄连以及它的主要成分黄连素在治疗糖尿病的研究中受到越来越多的关注[5]。本实验采用高脂饲料喂养联合小剂量链脲佐菌素(streptozotocin,STZ)诱导 T2DM伴非酒精性脂肪肝(NAFLD)大鼠模型,通过观察黄连素对模型大鼠脂代谢和肝组织抗氧化酶的影响,探讨黄连素对肝脏的治疗作用及其机制。
1 材料与方法
1.1 实验动物
Wistar大鼠35只,雄性,6周龄,体重160~180g,北京华阜康实验动物技术有限公司提供,合格证号:SCXK(京)2010-0001。饲养于中日友好临床医学研究所动物室(SPF级)。
1.2 药物与饲料
黄连素:由上海中药创新研究中心提供。高脂饲料成分:38%脂肪,12%蛋白质,50%碳水化合物。由北京华阜康实验动物技术有限公司提供。链脲佐菌素:美国Sigma公司。
1.3 主要试剂及仪器
1.3.1 主要试剂
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、胆固醇(TC)和甘油三酯(TG)检测试剂盒均购自南京建成生物工程研究所;油红O染液(Sigma,美国);脂肪酸合成酶(FAS)抗体(Cell Signaling,美国);免疫组化检测试剂盒(基因科技上海有限公司)。Trizol试剂(Invitrogen,美国);反转录试剂盒(Thermo Fisher,美国);Ultra SYBR Mixture(康为世纪公司,中国)。
1.3.2 实验仪器
全自动生化分析仪(美国CD-1600);滑走式切片机(日本Sakura);显微镜(日本Olympus BX-51); 图象采集系统 (日本 Olympus DP73);ABI 7500 荧光定量 PCR 仪(ABI,美国)。
1.4 模型建立及实验分组
将雄性Wistar大鼠35只顺应性喂养3d后,正常组10只大鼠给予普通饲料,待造模的大鼠25只给予高脂饲料[6],5周后参照文献[7]进行胰岛素钳夹实验,确认出现胰岛素抵抗后,参照文献[8]以25mg/kg的剂量腹腔注射1%的STZ(pH4.2~4.5的0.1M柠檬酸缓冲液配制),72h后测定空腹血糖>11.1mM视为造模成功。将成模动物20只随机分为模型组10只和黄连素组10只。黄连素组予25mg/kg/d黄连素[9],混悬于双蒸水中。正常组与模型组给予等体积双蒸水灌胃。各组动物灌胃给药1次/d,连续给药20周。
1.5 检测指标
1.5.1 一般情况观察
每周密切观察动物精神状态、反应性、毛发色泽、饮食及排泄状况。20周时取材称量并记录体重、肝重,计算肝重指数。肝重指数=肝重/体重×100%。
1.5.2 血生化指标
实验结束时,腹腔注射水合氯醛麻醉实验动物,腹主动脉取血,4℃,3000rpm离心15min,取血清检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)的含量。
1.5.3 肝组织 SOD、CAT、GPX、TC和TG的测定
取肝组织,称重,按重量体积比加入9倍的生理盐水制成10%的组织匀浆,2500rpm离心10min,取上清,按照南京建成生物工程研究所试剂盒操说明书进行操作。
1.5.4 肝脏组织病理形态观察
经HE染色,400倍光镜下观察肝组织病理学变化,按照文献[10]对肝脏脂变程度及炎症进行半定量分析。
肝脏冰冻切片油红O染色后,400倍显微镜下观察肝脏脂滴沉积的变化。
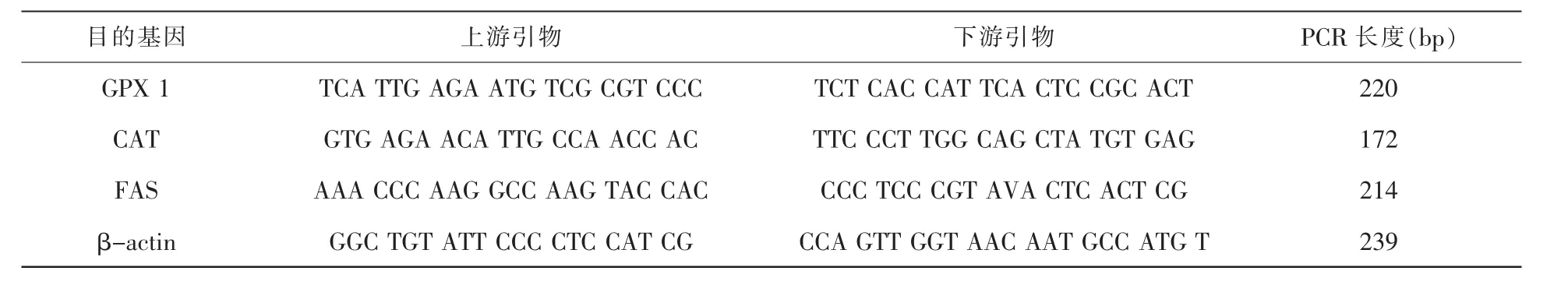
表1 引物序列
1.5.5 肝组织中FAS的表达
采用免疫组化法检测,显微镜下观察并使用Image-Pro Plus软件统计分析结果。
1.5.6 肝脏组织CAT、GPX1及FAS mRNA表达
按照试剂盒方法逆转录后进行荧光定量PCR(quantitative real-time PCR,Q-PCR)。引物合成由上海捷瑞生物工程有限公司完成。引物序列见表1。
1.6 统计学方法
应用SPSS19.0统计软件进行数据分析。方差不齐时采用秩和检验,方差齐时采用One-way ANOVA,再用S-N-K进行两两比较。
2 结果
2.1 黄连素对模型大鼠状态及肝重指数的影响
正常对照组大鼠健康状态良好,进食、饮水均正常,粪便成形,毛色光泽;模型组大鼠食量增加、饮水增加、尿量增多、活动减少、精神稍萎靡、被毛蓬松无光泽;黄连素组较模型组大鼠状态有所改善。实验结束取材时,模型组大鼠肝重指数显著高于正常对照组(P<0.01),黄连素组大鼠的肝重指数较模型组显著改善(P<0.01),结果见表2。
2.2 黄连素对模型大鼠肝功能、血脂的影响
表3示,与正常组比较,模型组肝功ALT、AST水平均显著升高,血脂TC、TG和LDL-C水平也显著升高。 与模型组相比,黄连素组肝功ALT、AST水平降低,血脂TC、TG和LDL-C水平显著降低。差异均有统计学意义。
表2 各组大鼠体质量、肝质量及肝重指数(±s)
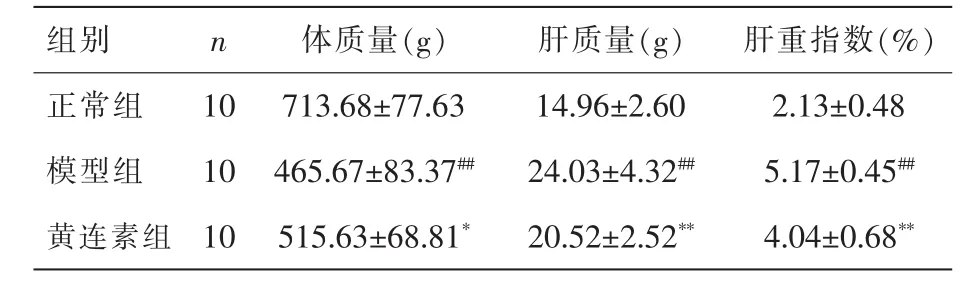
表2 各组大鼠体质量、肝质量及肝重指数(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
?
2.3 黄连素对模型组大鼠肝脏组织抗氧化能力及脂质水平的影响
机体的SOD、CAT、GPX含量是评价其抗氧化能力的重要指标。表4示,与正常对照组相比,模型组 SOD、CAT及GPX活显著降低;同时,模型组肝组织中的TC、TG含量显著升高。黄连素组各抗氧化指标及肝脏中TC、TG含量较模型组均有不同程度的改善,具有统计学意义。
2.4 黄连素对模型大鼠肝组织病理改变的影响
HE染色结果(图1见封底)显示,正常组大鼠肝脏组织结构正常,肝小叶结构明显,肝细胞无变性。模型组大鼠肝细胞质内充满大量大小不等的圆形脂滴,肝小叶结构不清,小叶内有炎症细胞浸润。黄连素组肝脏脂肪变性程度减轻,炎性细胞浸润及坏死灶减少。此外,油红O染色(图1见封底)显示正常组大鼠肝脏组织细胞几乎无脂肪滴,而模型组大鼠肝脏组织分布大量脂肪滴和空泡,脂肪变性程度严重,油红O阳性着色面积显著增加。给予黄连素治疗的大鼠肝脏脂质沉积显著下降,空泡减少,油红O阳性着色面积显著减少。肝脏脂肪变性及炎症评分结果见图2。
2.5 黄连素对模型大鼠肝脏组织中FAS的表达的影响
免疫组化检测结果(图3见封底)显示,与正常组大鼠比较,模型组大鼠肝脏组织中FAS高度表达,提示其肝脏合成脂肪酸的能力较强;给予黄连素治疗后FAS表达显著下降。FAS免疫组化染色阳性率半定量分析[9]结果见图4。
表3 各组大鼠血清学检测指标比较(±s)
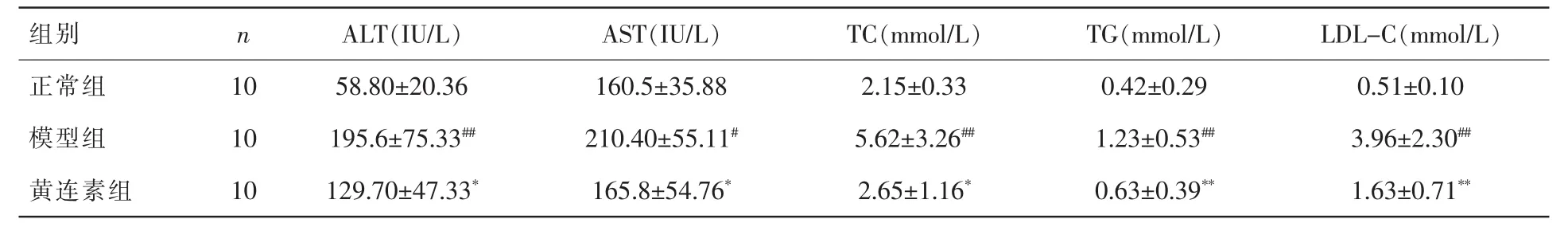
表3 各组大鼠血清学检测指标比较(±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别 n ALT(IU/L) AST(IU/L) TC(mmol/L) TG(mmol/L) LDL-C(mmol/L)正常组 10 58.80±20.36 160.5±35.88 2.15±0.33 0.42±0.29 0.51±0.10模型组 10 195.6±75.33## 210.40±55.11# 5.62±3.26## 1.23±0.53## 3.96±2.30##黄连素组 10 129.70±47.33* 165.8±54.76* 2.65±1.16* 0.63±0.39** 1.63±0.71**
表4 各组大鼠肝脏组织氧化应激指标及脂质水平的比较(±s)
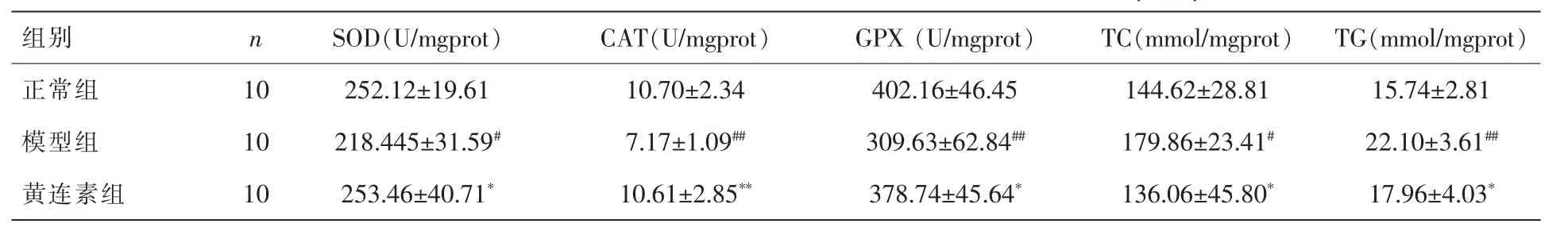
表4 各组大鼠肝脏组织氧化应激指标及脂质水平的比较(±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别 n SOD(U/mgprot) CAT(U/mgprot) GPX (U/mgprot) TC(mmol/mgprot) TG(mmol/mgprot)正常组 10 252.12±19.61 10.70±2.34 402.16±46.45 144.62±28.81 15.74±2.81模型组 10 218.445±31.59# 7.17±1.09## 309.63±62.84## 179.86±23.41# 22.10±3.61##黄连素组 10 253.46±40.71* 10.61±2.85** 378.74±45.64* 136.06±45.80* 17.96±4.03*
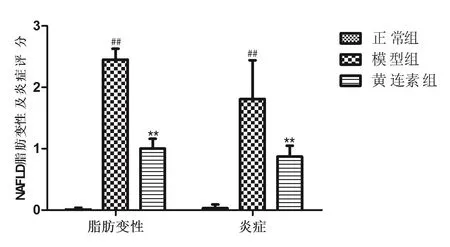
图2 各组大鼠NAFLD脂肪变性及炎症评分
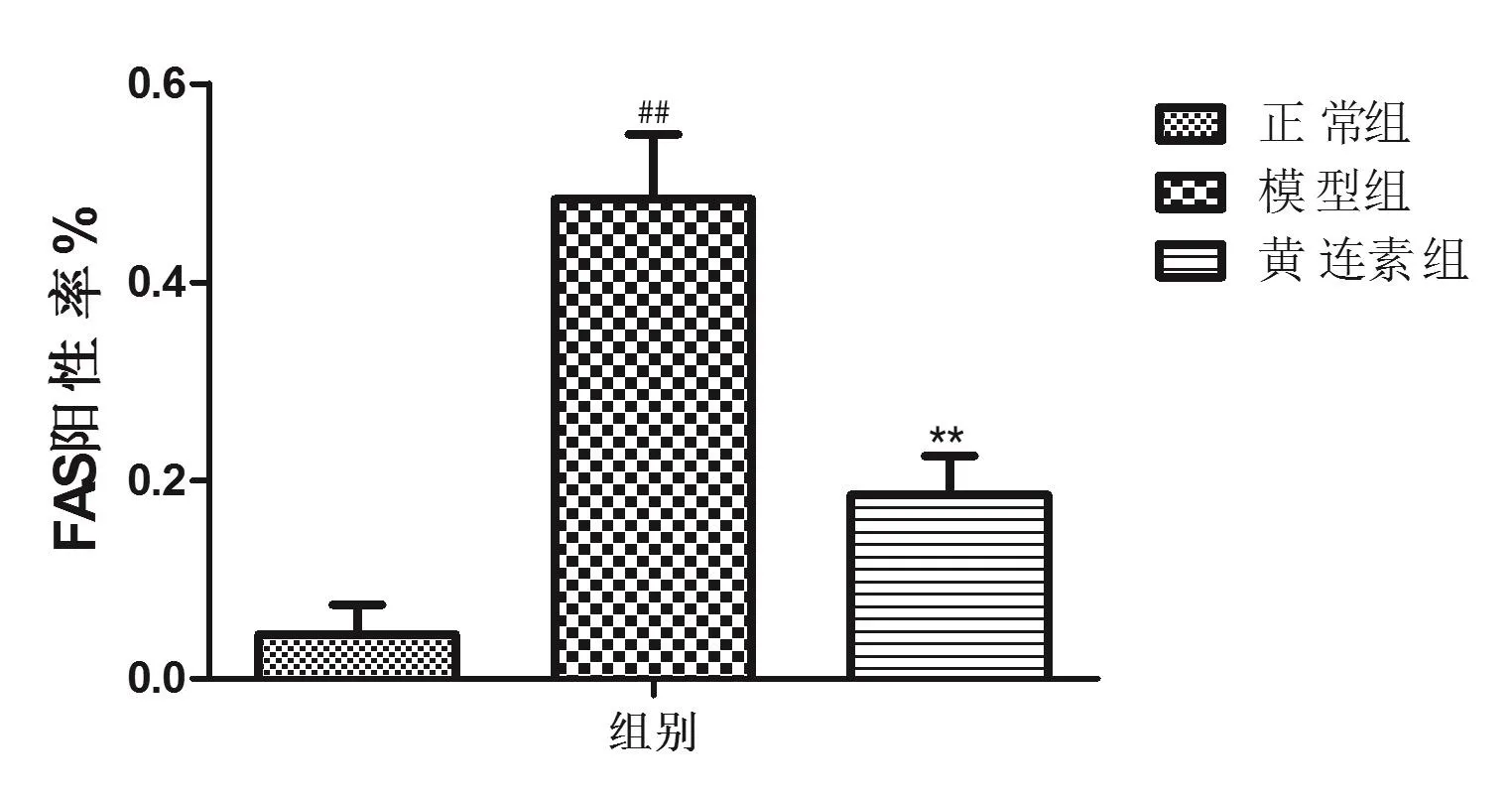
图4 各组大鼠FAS免疫组化染色阳性率半定量分析
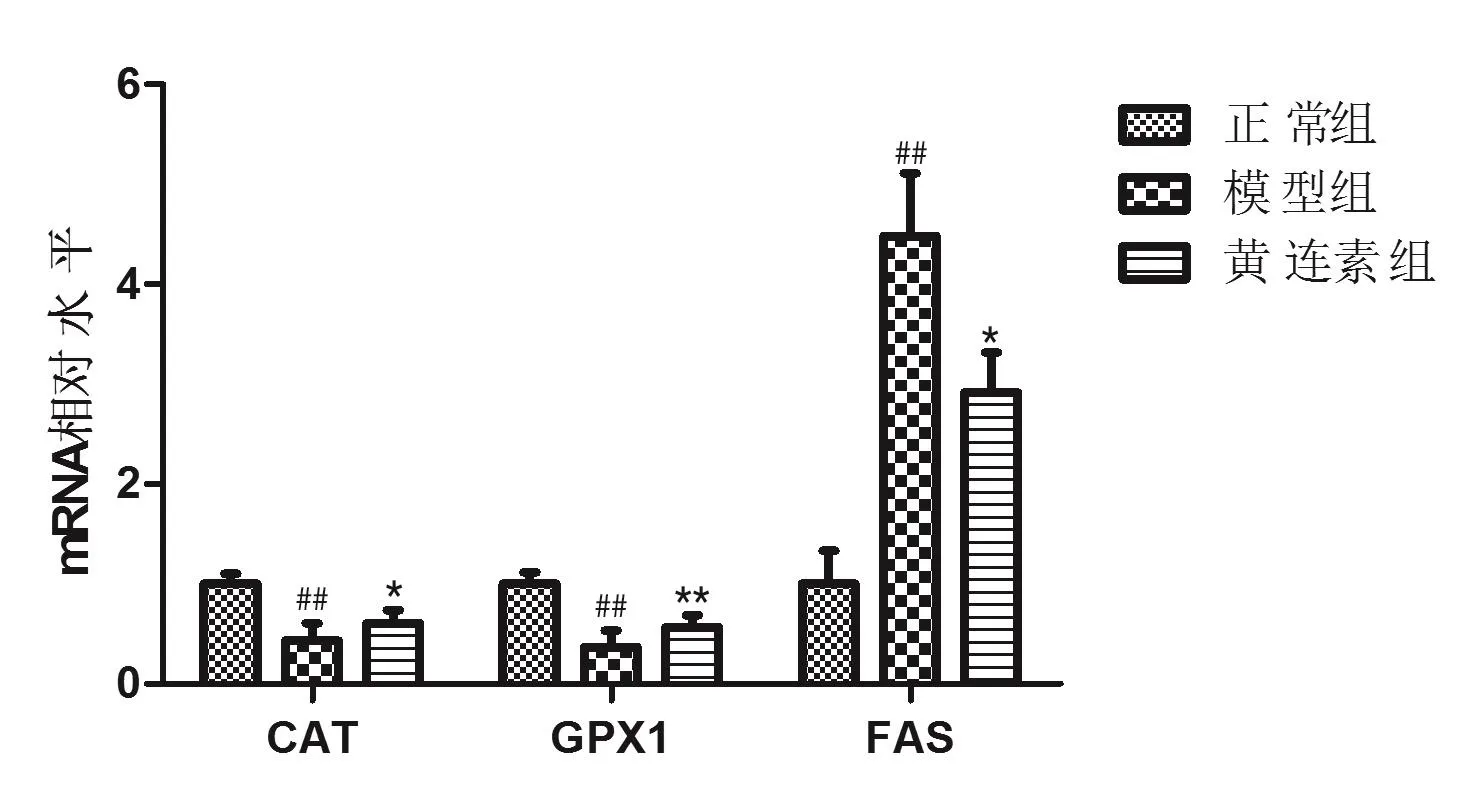
图5 大鼠肝脏组织中CAT、GPX 1及FAS的表达
2.6 黄连素对模型大鼠肝脏组织CAT、GPX1及FAS mRNA表达的影响
模型组大鼠肝脏组织CAT和GPX1的mRNA水平显著低于正常组大鼠,而黄连素可升高CAT和GPX1的mRNA水平;与免疫组化FAS的表达结果相一致,模型组大鼠肝脏组织FAS的mRNA水平显著高于正常组,给予黄连素治疗后可降低其表达水平,具体结果见图5。
3 讨论
糖尿病是一组由遗传以及环境因素相互作用导致的代谢性疾病,其肝脏病变主要表现为NAFLD,比较公认的病理机制是 “二次打击学说”,指在胰岛素抵抗的状态下,肝细胞内脂肪沉积;各种致病因素引发的氧化应激使反应性活性氧(reactive oxygen species,ROS)增多导致脂质过氧化伴线粒体损伤,肝细胞发生炎症、坏死[9]。胰岛素抵抗(insulin resistance,IR)及氧化应激失平衡是NAFLD疾病发生发展的主要病理机制。有研究表明,NAFLD增强了T2DM面临的风险,并会恶化糖尿病患者的血糖控制和心血管疾病。因此临床在治疗T2DM合并NAFLD时,所选用的药物应对肝脏有保护作用[10]。
本实验采用高脂饲料喂养加腹腔注射小剂量STZ制备T2DM合并NAFLD,实验中大鼠出现多尿、多饮、多食及体重下降等临床表现,并有肝功和血脂异常。主要表现为 ALT、AST、TC、TG和LDL-C明显升高。光镜下观察肝细胞排列结构紊乱,细胞体积明显增大,胞内见大量脂滴,核偏向,炎细胞浸润等,油红O染色可发现阳性面积增大,表明实验组大鼠已出现肝脏病变,主要表现为脂肪肝。给予黄连素治疗的大鼠,以上指标均有显著改善,表明黄连素对T2DM大鼠的肝损伤与脂质异常沉积具有显著的保护作用。
脂质异常沉积是导致NAFLD的主要方面之一。肝内脂肪沉积本身可诱发IR,同时IR通过促使外周脂肪分解增加,使得游离脂肪酸产生过多,脂质外溢流入肝脏而造成肝脏异位脂质沉积[11]。FAS是参与脂肪酸合成的主要酶系之一,其表达升高可增加脂肪酸的水平,加重肝脏的脂质沉积,产生脂代谢紊乱。IR与肝脏脂质沉积又互为因果,彼此相互促进,形成恶性循环。故打破这一恶性循环,将有助于整个代谢紊乱的改善。在本研究免疫组化实验中,模型组与正常组大鼠肝组织相比FAS呈高表达,其FAS基因的mRNA表达也显著升高。经黄连素干预后,其肝组织FAS的表达与模型组相比有所降低,FAS基因的mRNA表达也有所降低。提示黄连素改善T2DM大鼠的肝组织脂代谢紊乱与抑制FAS,减少脂质合成有关。
随着脂质沉积所引发的氧化应激、脂质过氧化是推动NAFLD进展的重要因素[12,13]。有研究表明肝组织细胞可以表达抗氧化酶类CAT、SOD和GPX[14]。正常生理情况下,CAT、SOD和GPX可清除ROS,维持细胞处于氧化还原自稳态。当某些因素作用于细胞使这一稳态失调,ROS产生的速率大于清除的速率时,就会造成 ROS的蓄积,产生氧化应激,导致细胞和组织的损伤[15]。本研究显示,模型组大鼠肝脏SOD、CAT和GPX活性下降,表明T2DM肝组织存在着明显的氧化应激,从而导致了脂质过氧化和抗氧化能力降低。黄连素干预后,其肝脏组织中SOD、CAT和GPX活性与模型组相比有所升高。实时定量PCR结果显示模型组抗氧化基因CAT和GPX1的表达均显著下降,而黄连素组可上调其表达,说明黄连素通过调节多种抗氧化酶类的表达与活性,减轻氧化应激,从而改善了肝损伤。
糖尿病非酒精性脂肪肝根据其临床表现可归属为中医 “消渴”、“肝着”、“积聚”、“胁痛”范畴。T2DM伴发NAFLD为多虚多瘀之证,中医认为脂肪属于膏脂,在脂肪肝发病过程中,肝脾失调、湿热中阻、津血膏脂代谢失常,引起湿热与痰浊相互胶结为患[16]。ROS、MDA等氧化代谢产物与湿热痰浊密切相关,湿邪其性黏滞重浊,是体内脏腑功能失调、气机紊乱的病理性产物。痰是机体物质代谢失调生成并积累的各种病理性生化物质,因此湿热痰浊等病理因素与现代医学意义上的氧化应激产物存在一致性。黄连素又称小檗碱,是一种常见的异喹啉类生物碱,主要从黄连和黄柏等传统中药中提取,具有清热燥湿的功效[17]。黄连素对湿热蕴结为主证的NAFLD效果显著,本实验为其清热燥湿功效提供了现代医学实验证据。
综上所述,本研究证实黄连素对T2DM大鼠伴发NAFLD具有明确的肝保护作用,其作用机制可能是通过改善脂代谢相关分子及抗氧化酶的表达而实现的。
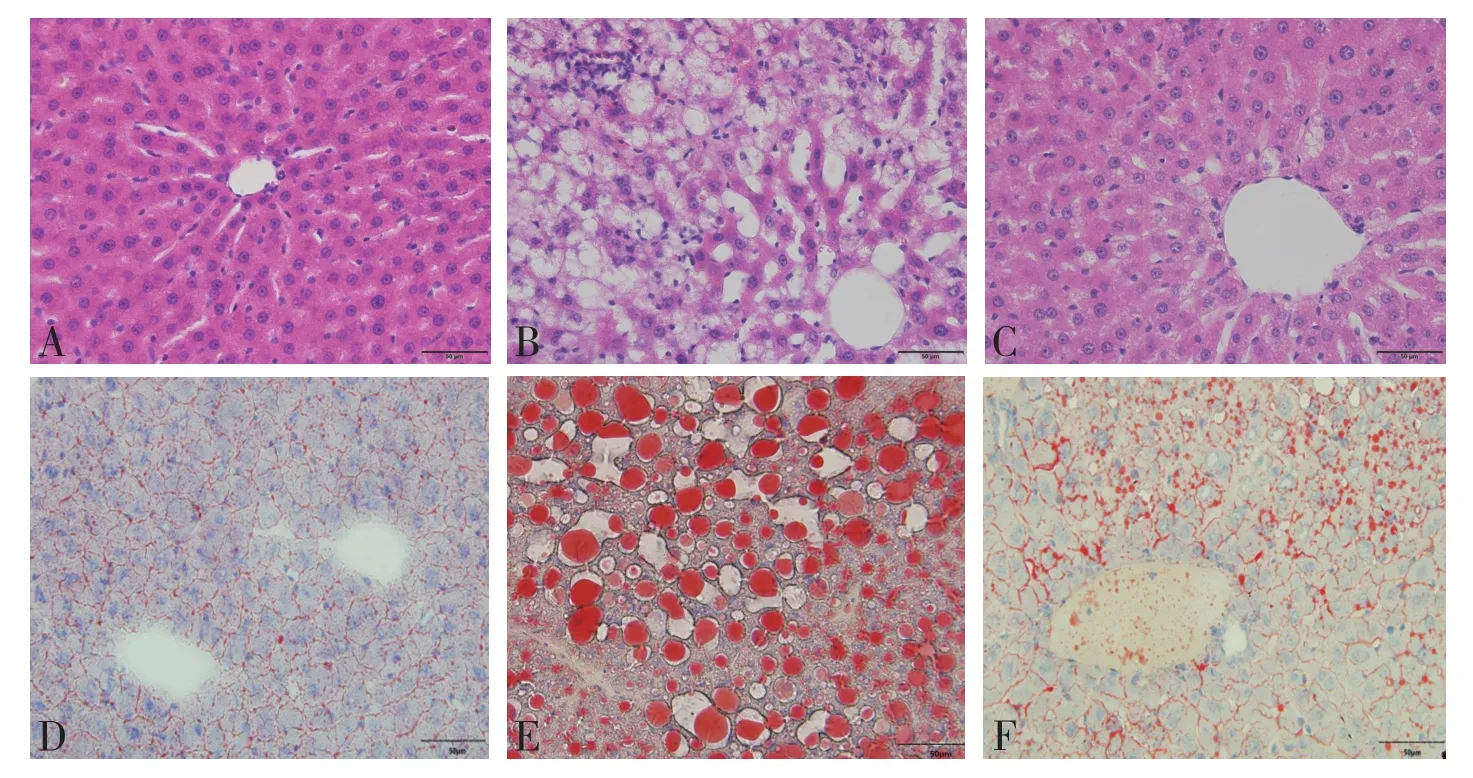
图1 各组大鼠病理结果(×400),A-C为 HE染色,D-F为油红O染色。A:正常组大鼠肝脏组织结构正常,肝小叶结构明显,肝细胞无变性。B:模型组大鼠肝细胞质内充满大量大小不等的圆形脂滴,肝小叶结构不清,小叶内有炎症细胞浸润。C:黄连素组肝脏脂肪变性程度减轻,炎性细胞浸润及坏死灶减少。D:油红O染色显示正常组大鼠肝脏组织细胞几乎无脂肪滴。E: 模型组大鼠肝脏组织分布大量脂肪滴和空泡,脂肪变性程度严重,油红O阳性着色面积显著增加。F:黄连素组油红O阳性着色面积显著减少。
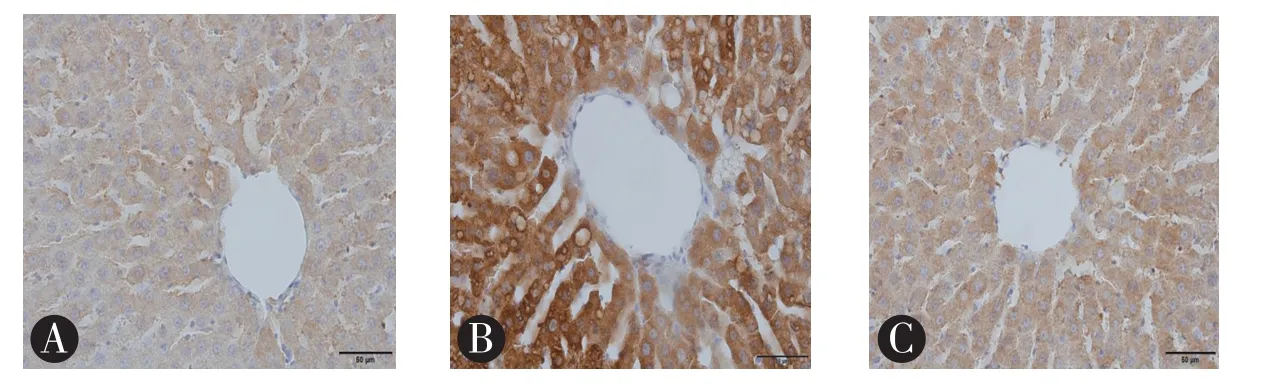
图3 各组大鼠FAS免疫组化染色(×400),A:正常组;B:模型组;C:黄连素组。与正常组大鼠肝脏组织比较,模型组肝脏组织中FAS高度表达;给予黄连素治疗后FAS表达有显著下降。
[1]Yanling Wu,Yanping Ding,Yoshimasa Tanaka,etal.Risk factors contributing to type 2 diabetes and recent advances in the treatment and prevention[J].International Journal of Medical Sciences,2014,11(11):1185-1200.
[2]Keyhani-Nejad F,Irmler M,Isken F,et a1.Nutritional strategy to prevent fatty liver and insulin resistance independent ofobesity by reducing glucose-dependentinsulinotropic polypeptide responses in mice[J].Diabetologia,2015,58(2):374-383.
[3]Younossi ZM,Stepanova M,Afcndy M,et al.Changes in the prevalence of the most common causes of chronic liver diseases in the United State from 1988 to 2008[J].Clin Gastroerol Hepatol,2011,9(6):524-530.
[4]李骋,何金枝,周学东,等.黄连素调控胰岛素抵抗相关2型糖尿病的研究进展[J].中国中医药杂志,2017,42(12):2254-2260.
[5]Hai-Lu Zhao,Yi Sui,Chun-Feng Qiao.Sustained antidiabetic effects of a berberine-containing Chinese herbal medicine through regulation of hepatic gene expression[J].Diabetes,2012,61(4):933-943.
[6]陈剑明,王丙信,伏爱国,等.高脂饮食诱导非酒精性脂肪肝大鼠模型的实验研究 [J].中华中医药学刊,2016,34(11):2709-2712.
[7]陈世清,刘杞,孙航,等.脂肪肝胰岛素抵抗大鼠模型的建立[J].中华肝脏病杂志,2005,13(2):105-108.
[8]Zipeng Gong,Ying Chen,Ruijie Zhang et al.Pharmacokinetic difference of berberine between normal and chronic visceral hypersensitivity irritable bowelsyndrome ratsand its mechanism[J].Archives of Pharmacal Research,2015,38(10):1888-1896.
[9]Yu W,Wu J,Cai F et al.Curcumin alleviates diabetic cardiomyopathy in experimentaldiabetic rats[J].PlosOne,2012,7(12):e25013.
[10]Elodie M.Girault,Anneke Alkemade,Ewout Foppen,et al.A-cute peripheral but not central administration of olanzapine induces hyperglycemia associated with hepatic and extrahepatic insulin resistance[J].Plos One,2012,7(8):e43244.
[11]WangJP,Cui RY,Zhang KY,et al.High-fat diet increased renal and hepatic oxidative stress induced by vanadium of Wistar rat[J].Biol Trace Elem Res,2016,170(2):415-423.
[12]陈剑明,张声生,郭前坤,等.芍药苷对非酒精性脂肪肝大鼠模型的疗效与保护机制研究[J].中华中医药杂志,2013,28(5):1376-1381.
[13]Yoon HJ,Cha BS.Pathogenesis and therapeutic approaches for non-alcoholic fatty liver disease[J].World J Hepatol,2014,6(11):800-811.
[14]Barbara Fruci,Stefania Giuliano,Angela Mazza,et al.Nonalcoholic fatty liver:A possible new target for type 2 diabetes prevention and treatment[J].International Journal of Molecular Sciences,2013,14,22933-22966.
[15]Pao-Yuan Lin,Chih-Hung Chen,Christopher Glenn Wallace1,et al.Therapeutic effect of rosuvastatin and propylthiouracil on ameliorating high-cholesterol diet-induced fatty liver disease,fibrosis and inflammation in rabbit[J].Am J Transl Res,2017,9(8):3827-3841.
[16]翁思颖,柴可夫,周建扬.2型糖尿病合并非酒精性脂肪肝中医体质分布规律与基因多态性关系研究[J].中华中医药杂志,2017,32(5):2216-2219.
[17]张玉佩,杨钦河,韩莉,等.黄连素药性与脂肪肝证治关系初探[J].中国中医基础医学杂志,2015,20(1):115-119.

