H2BTA的非等温热分解特性
王亮亮,刘 艳,赵守田
(防化研究院,北京 102205)
引 言
四唑类含能化合物是新型富氮含能化合物的典型代表之一,具有生成焓高、密度大、热稳定性高、产气量大、爆速和爆压高及燃烧或爆炸产物主要为无污染的N2等特性[1-3],已成为国内外研究的热点[4-6]。随着对四唑化合物研究的不断深入,逐渐由单环四唑衍生出了双环四唑化合物[6],其含氮量、热稳定性、修饰位点及密度等特性相对于单环四唑具有更多优势,因而成为四唑含能化合物领域研究的热点[7]。
N,N-二(1(2)氢-5-四唑基)胺(H2BTA)也称 5,5′-氨基双四唑或双四唑胺,是一种具有代表性的双环四唑含能化合物[8],最早于1963年由Norris等制备得到[9]。该化合物的密度为 1.86g/cm3,氮含量(质量分数)为82.3%,计算爆速为9120m/s,放气量为753L/kg ,生成焓高达633kJ/mol[8]。基于这些优异的物化性能,Highsmith等[10]将其成功应用于气体发生剂领域。
虽然针对H2BTA的热分解已有相关报道[9],但仅限于简单的DSC曲线测定其分解峰温,而关于该化合物详细的热分解特性研究还未见报道。本研究从分解过程、分解温度、放热量、分解产物和分解机理等方面探讨了H2BTA的热分解性能,为其实际应用提供参考。
1 实 验
1.1 试剂与仪器
H2BTA(纯度>99%),白色针状固体,北京理工大学。
TGA/DSC1型热重/差示扫描量热联用仪,梅特勒-托利多国际贸易(上海)有限公司;FTIR Nicolet 6700 型傅里叶红外光谱仪,赛默飞世尔科技(中国)公司,其中气体红外采用TGA-FTIR气体池附件;GAM 200型质谱仪,北京瑞士安维公司。
1.2 实验条件
TG-DSC:升温速率分别为5、8、10、15、20和50℃/min,氦气流速40mL/min,样品研成粉末后在真空烘箱中40℃下干燥24h,试样质量1~2mg,温度范围50~450℃,40μL金属铝坩埚。
FTIR:气体池温度180℃,传输管道温度170℃,氦气流速50mL/min,扫描波数范围400~4000cm-1,扫描模式为吸光度,分辨率2cm-1,扫描29次进行光谱累加。
MS:电子轰击源(EI),四级杆质量分析器,采用多离子通道(MID)模式,二次电子倍增器(SEM)电压1000eV,进样口温度130℃,传输管道温度150℃。
2 结果与讨论
2.1 H2BTA热分解动力学参数
升温速率为10℃/min时H2BTA的TG-DTG曲线见图1,不同升温速率下H2BTA的DSC曲线见图2,热分解数据见表1。
由图1可以看出,该化合物存在3个连续的热分解过程。其中,前两个过程虽有明显的质量损失,但过程相对缓慢。分解放热主要在第3个过程,质量损失速率较快,质量损失率高达35.23%。此外,H2BTA整个分解过程的热焓为797.34J/g,远小于HMX(1987J/g)和RDX(1787J/g)的热焓值[11]。温度高于400℃时,仍有质量分数约30%的残渣剩余,可能为分解产物再聚合形成的高热稳定性物质。
由图2可知,H2BTA热分解的第二和第三个过程对应两个连续的放热峰,随着升温速率的增加,第二个过程放热峰逐渐减弱,而第三个过程放热峰逐渐增强。
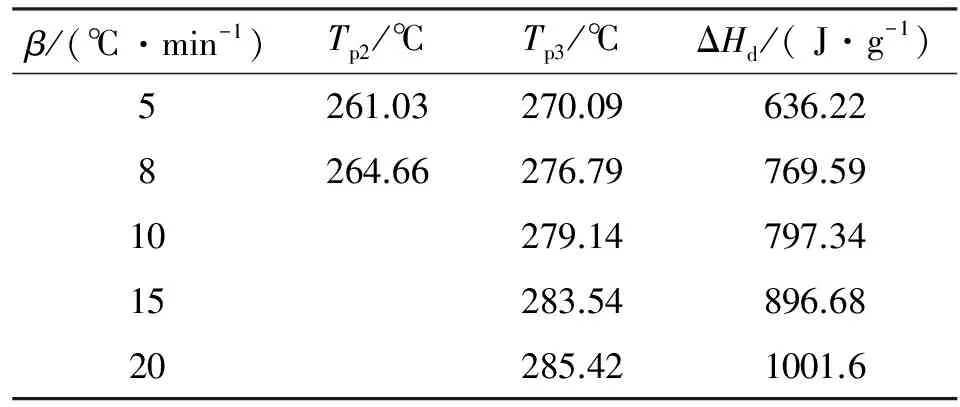
表1 不同升温速率下H2BTA的DSC数据
注:Tp2和Tp3分别为第二和第三个分解过程的峰温;ΔHd为第二和第三分解过程的总热焓。
分别采集相同转化率下H2BTA的3个热分解过程的峰温数据,并利用Kissinger[12]方法计算相应的表观活化能,可得到各分解过程对应的Ea-α曲线,见图3。
由图3可以看出,每个热分解过程均存在一段表观活化能(Ea)数值变化较小的转化率(α)范围,说明这3个热分解过程均可采用某一机理函数进行描述。针对上述各热分解过程选定的转化率区间,分别采用Coats-Redfern[13]和Kissinger[12]方法计算H2BTA 3个热分解过程的动力学参数,结果见表2。
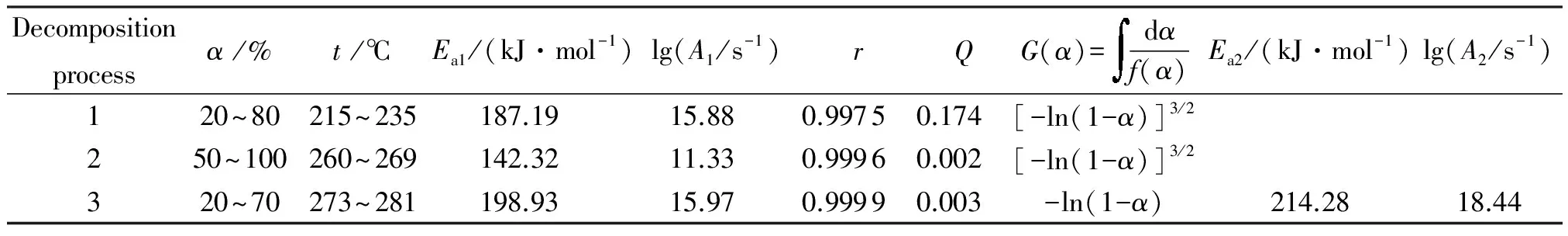
表2 H2BTA的3个热分解过程动力学参数
注:Ea1、lg(A1/s-1)为通过Coats-Redfern方法(β=10℃/min)计算得出;Ea2、lg(A2/s-1)为通过Kissinger方法计算得出;A为化学反应的指前因子,s-1;G(α)为反应机理函数的积分形式;α为转化率,其范围利用Ea-α曲线确定[14];r为线性相关系数;Q为标准偏差。
从表2可知,第一个分解过程的表观活化能为187.19kJ/mol,最可几机理函数为1.5级反应,描述的是随机成核和随后生长模型。由于-N-N-和-N=N-的平均键能[15]分别为160和418kJ/mol,所计算的表观活化能介于二者之间,说明该过程很可能对应于H2BTA四唑环骨架中-N-N-键的断裂。第二个分解过程表观活化能为142.32kJ/mol,最可几机理函数为1.5级反应。说明该过程的控制步骤为分子中剩余骨架-N-N-键的断裂。其表观活化能低于第一个分解过程,很可能由于四唑环断裂后,分子剩余骨架中-N-N-的共轭强度减弱,键能大大减小,进而导致该过程表观活化能有所降低。第三个分解过程存在更为明显的放热峰,质量损失率高达35.23%,是H2BTA最主要的分解过程。计算得到该过程276~280℃的表观活化能为198.83kJ/mol,最可几机理函数为1级反应。利用Kissinger方法计算该过程的表观活化能为214.28kJ/mol。两者的计算结果较为接近,说明该过程的主要控制步骤应为H2BTA剩余骨架的裂解。
2.2 H2BTA的热分解产物
H2BTA热分解产生的气体产物的红外光谱图见图4。通过红外吸收强度随温度的变化,可以直观地反映出H2BTA逐步分解气体产物的变化情况。
图5是280℃时H2BTA气体产物的红外光谱图。分析图中红外吸收峰的振动频率及强度[16],很容易得到该温度下热分解产生的具有红外活性的气体产物为HN3、HCN及NH3。
图6是升温速率分别为10和50℃/min时,H2BTA热分解产生气体的质谱图。
由图6(a)可以清晰地反映气体产物的含量随温度的变化情况。其中,N2为最主要也是最先出现的气体产物,其含量变化与对应的DSC曲线非常相似,说明在3个分解过程中均有N2产生。HN3、HCN、NH3和N2的含量均在H2BTA第三个分解过程中出现极大值,说明该过程为H2BTA的主要分解过程。此外,质谱图中尖锐的峰形表明此时气体产物的生成及扩散速率相对较快。
升温速率为50℃/min时H2BTA的TG-DSC曲线见图7。
从TG曲线中可以看出,H2BTA存在一个“微爆”的剧烈分解过程,质量损失率瞬间达到93%,该过程气体产物的质谱图见图6(b)。与缓慢热分解不同,这时气体产物中HCN的含量明显增加,HN3的含量减小并出现少量的H2。原因在于升温速率加快时,发生剧烈分解,在此条件下,一方面使得化学键的断裂更加容易,导致小分子气体尤其是HCN的含量增加;另一方面让分解产物难以再次发生聚合,因此失重率显著增加;同时HN3在该条件下也容易发生分解,生成N2和H2,导致产生的HN3含量降低。
2.3 H2BTA的热分解机理
基于H2BTA热分解数据、动力学参数、红外及质谱的数据,推断H2BTA的热分解存在两种分解机理,见图8。比较气体产物中N2和HN3的含量可以发现以机理(1)为主。这两种分解机理均始于四唑环骨架的断裂,机理(1)是通过—N-N—的断裂脱除N2,随后是剩余骨架的裂解,最后是裂解产物发生聚合得到产物的二次分解和再聚合形成大分子量的高聚物。机理(2)则是首先通过—N-N—和—C-N—的断裂脱除HN3,然后进行后续的分解和聚合过程。Fischer等[17]针对单环四唑的热分解研究发现四唑环的热分解存在两种反应路径:一种是释放N2;另一种则是产生HN3,这很好地印证了本实验的结果。但由于—C-N—的键能明显高于—N-N—的键能,因此采用机理(1)进行分解相对容易。
两种机制下H2BTA分解后均会产生少量的高聚物,如蜜勒胺、蜜白胺和蜜弄。在大于500℃高温下分解产生氨腈、氰化氢及氨气等挥发性的物质[18]。升温速率为50℃/min时剧烈分解不利于分解产物的聚合反应,因此,高聚物的含量会极大减小,释放出小分子量气体的含量则会明显增加。
3 结 论
(1)H2BTA的热分解可分为3个连续分解过程,表观活化能分别为187.19、142.32和198.93kJ/mol,分别对应于该化合物中四唑环的断裂、骨架中-N-N-键的进一步断裂及剩余骨架的裂解。
(2)H2BTA缓慢热分解产生的气体产物包括N2、NH3、HN3和HCN, N2为主要产物。剧烈分解的气体产物包括N2、NH3、HN3、H2及 HCN, N2和HCN为主要产物。
(3)H2BTA初始分解时,四唑环的断裂存在-N-N-键断裂脱除N2以及-C-N-键断裂释放HN3两种机理。质谱分析数据表明,H2BTA以脱除N2的分解机理为主。
参考文献:
[1]Hammerl A, Hiskey M A, Holl G, et al. Azidoformamidinium and guanidinium 5,5′-azotetra zolate salts[J]. Chemistry of Materials, 2005, 17(14): 3784-3793.
[2]张建国, 张同来, 张志刚, 等. 唑类杂环化合物及其配合物的研究概述[J]. 含能材料, 2001, 9(2): 90-93.
ZHANG Jian-guo, ZHANG Tong-lai, ZHANG Zhi-gang, et al. A review on azotic heterocyclic compounds and their coordination compounds[J]. Chinese Journal of Energetic Materials, 2001, 9(2): 90-93.
[3]代玲玲, 崔胜峰, 周成合. 四唑类化合物的合成及应用研究新进展[J]. 有机化学, 2012, 33(2): 224-244.
DAI Ling-ling, CUI Sheng-feng, ZHOU Cheng-he. Recent advances in the synthesis and application of tetrazoles[J]. Chinese Journal of Organic Chemistry, 2012, 33(2): 224-244.
[4]阳世清,徐松林,黄亨健,等. 高氮化合物及其含能材料[J]. 化学进展,2008, 20(4):526-537.
YANG Shi-qing, XU Song-lin, HUANG Heng-jian, et al. High nitrogen coumpounds and their energy materials[J]. Progress in Chemistry, 2008, 20(4): 526-537.
[5]GAO Hai-xiang, Shreeve J M. Azole-based energetic salts[J]. Chemical Reviews, 2011, 111(11):7377-7436.
[6]彭蕾, 李玉川, 杨雨璋, 等. 双环和多环四唑含能化合物的合成研究进展[J]. 有机化学, 2012, 32(4): 667-676.
PENG Lei, LI Yu-chuan, YANG Yu-zhang, et al. Research progress in synthesis of energetic compounds of bicyclo-and multicyclo-tetrazoles[J]. Chinese Journal of Organic Chemistry, 2012, 32(4): 667-676.
[7]柴玉萍,张同来,姚俊. 双四唑盐的合成及表征[J]. 固体火箭技术,2007, 30(3): 248-252.
CHAI Yu-ping, ZHANG Tong-lai, YAO Jun. Synthesis and characterization of bitetrazole salts[J].Journal of Solid Rocket Technology, 2007, 30(3): 248-252.
[8]Klapötke T M, Mayer P, Stierstorfer J, et al. Bistetrazolylamines-synthesis and characterization[J]. Journal of Materials Chemistry, 2008, 18(43): 5248-5258.
[9]Norris W P, Henry R A. Cyanoguanyl azide chemistry1[J]. Journal of Organic Chemistry, 1964, 29(3): 650-660.
[10] Highsmith T K, North O, Reed J B, et al. Bis (tetrazoly) amine gas generant compositions: US, 5682014 [P].1997.
[11] 刘子如,刘艳,范夕萍,等. RDX和HMX的热分解I. 热分析特征量[J]. 火炸药学报,2004, 27(2):63-66.
LIU Zi-ru, LIU Yan, FAN Xi-ping, et al. Thermal decomposition of RDX and HMX part I: characteristic values of thermal analysis[J]. Chinese Journal of Explosives & Propellants(Huozhayao Xuebao), 2004, 27(2):63-66.
[12] Kissinger H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706.
[13] Coats A W, Redfern J P. Kinetic parameters from thermogravimetric data[J]. Nature, 1964, 201(4914): 68-69.
[14] 张国春,焦宝娟,周春生,等. C8H3O6NNa2·H2O脱水过程的热分析动力学[J]. 西北大学学报(自然科学版),2011, 41(3): 448-454.
ZHANG Guo-chun, JIAO Bao-juan, ZHOU Chun-sheng, et al. Kinetics of dehydration decomposition of in non-isothermal conditions[J]. Journal of Northwest University (Natural Science Edition), 2011, 41(3): 448-454.
[15] Talawar M B, Sivabalan R, Mukundan T, et al. Environmentally compatible next generation green energetic materials (GEMs)[J]. Journal of Hazardous Materials, 2009, 161(2): 589-607.
[16] Shimanouchi T. Tables of molecular vibrational frequencies. Consolidated volume II[J]. Journal of Physical and Chemical Reference Data, 1977, 6(3): 993-1102.
[17] Fischer G, Holl G, Klapötke T M, et al. A study on the thermal decomposition behavior of derivatives of 1, 5-diamino-1H-tetrazole (DAT): a new family of energetic heterocyclic-based salts[J]. Thermochimica Acta, 2005, 437(1): 168-178.
[18] Costa L, Camino G. Thermal behavior of melamine[J]. Journal of Thermal Analysis, 1988, 34(2):423-429.

