外源褪黑素对As3+胁迫下水稻种子萌发的影响
蒋航, 黄益宗, 杨秀文, 黄永春, 刘岩, 胡荣桂, 胡红青, 熊双莲, 刘仕翔, 李文华
1. 农业部环境保护科研监测所,天津300191 2. 华中农业大学资源与环境学院,武汉430070
随着工农业和城市化的飞速发展,污染物排放不断增加,土壤污染问题日益严峻。其中,重金属污染是土壤污染的主要类型之一,因其具有长期性、隐蔽性、不可逆性和生物不可降解性等特点而备受公众的关注和重视。据报道,我国受重金属污染的耕地面积近2 000万 hm2,约占全部耕地面积的五分之一,其中受As污染近1.33万 hm2[1]。刘春早等[2]从湘江流域采集72个土壤样品进行分析的结果表明,As、Cd、Cu、Zn、Ni和Pb的超标率在9.70%~83.34%之间,其中As重度污染占总超标率的2.82%。据《全国土壤污染调查公报》[3]显示,我国土壤总的超标率为16.1%,其中重金属污染问题比较突出,污染类型以无机型为主。Cd、Hg、As、Cu、Pb、Cr、Zn、Ni 8种重金属点位超标率为0.9%~7.0%,其中As的点位超标率为2.7%,在8种无机污染物中排名第3位。As是一种分布广泛的类金属元素,因其有毒且致畸致癌等危害,被世界卫生组织列为优先控制的污染物[4]。我国贵州、湖南、内蒙古、广西等多个地方存在大面积的As污染问题。莫昌琍等[5]对湖南锡矿山锑矿区的采矿区、冶炼区和尾矿区附近农用土壤进行分析表明,采样点的As浓度在14.95~363.19 mg·kg-1,明显高于As的背景值。土壤重金属污染来源十分广泛,主要是人为因素,包括矿产开采、金属冶炼、汽车尾气排放、化工、工业污泥使用、污水灌溉、农药和化肥施用、大气沉降等[6]。重金属进入土壤后,导致土壤肥力降低,农产品产量减少、品质下降。As污染不仅破坏生态系统,还会通过直接接触或者食物链途径危害人体健康。因此,对As污染土壤进行有效修复和治理刻不容缓。
水稻是我国主要的粮食作物,对As的毒性十分敏感。陈同斌和刘更另[7]研究发现,低浓度的As能促进水稻生长,但当As浓度较高时,则对水稻生长起明显的阻碍作用。李仁英等[8]研究发现低浓度的As能提高水稻的发芽率、促进芽和根的生长,当As浓度较高时则显著地抑制了水稻的发芽率及芽和根的生长。种子萌发期是水稻生长周期的开始,影响水稻以后的生长。缓解重金属对水稻种子在萌发过程中的毒害,有利于提高其产量和品质。褪黑素(melatonin,MT),又称果体素,首次在牛的松果体中分离出来[9]。褪黑素早期被认为仅在动物体内存在,但近年来在越来越多的植物体内发现了褪黑素[10]。很多研究发现,添加外源褪黑素不仅能提高植物对紫外线、高温、低温、高盐、干旱以及重金属等胁迫的耐受性,缓解胁迫造成的毒害,也能提高对病虫害的抵抗能力[11-15]。在植物体中,褪黑素参与生长发育的作用逐渐被熟知。除了具有抗氧化和生长调节功能外,褪黑素还参与植物调节光周期和昼夜节律功能。褪黑素对植物逆境的缓解途径主要是通过清除活性氧、提高抗氧化酶活性、参与多胺等物质合成等方式。Turk等[16]研究发现添加外源褪黑素可增强玉米幼苗的抗氧化能力从而缓解低温导致的氧化损伤。Zhang等[17]研究表明,外源褪黑素能通过调节抗氧化酶系统促进高盐胁迫下黄瓜种子的萌发。Posmyk等[14]研究发现褪黑素处理能缓解Cu2+对紫甘蓝种子的毒害作用,提高发芽率和抗氧化活性。目前研究外源褪黑素对As3+胁迫下植物生长发育的影响还未见报道。本文以水稻为研究对象,探讨添加外源褪黑素对水稻种子在As3+胁迫下萌发的影响,为农田As污染防治提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
水稻(Oryza sativa L.)选用四川中农4号。用饱满的水稻种子用5%NaClO浸泡10 min消毒后,用蒸馏水反复冲洗3~5遍直至洗净,并在生化培养箱中暗处28 ℃下催芽16 h。
1.2 实验方法
设置6个As3+浓度处理为0、5、20、40、80、100 μmol·L-1和3个褪黑素(MT)浓度处理为0、10、100 μmol·L-1,共组合成18个实验处理。As3+以NaAsO2的形式加入。挑选露白一致的种子均匀放入在直径9 cm的培养皿中,种子下铺两层无菌试纸,每个培养皿30粒种子。按照上述设置加入6 mL含有不同浓度As3+和褪黑素的处理液,在28 ℃生化培养箱中进行萌发。每个处理重复3次。培养期间每天更换滤纸且加入6 mL相应浓度的处理液,观察并记录种子的发芽情况。
1.3 测定项目与方法
1.3.1萌发指标测定
处理3 d后统计种子的发芽势,处理7 d后统计发芽率,并测定水稻幼芽的根芽长,根芽鲜重(其中根长、芽长用直尺测量,芽鲜重、根鲜重按每皿计算)。水稻种子的胚根长与种子长相等,且胚芽长为种子长一半时记为有效萌发[18]。根长和芽长分别为种子根或芽开口处到根尖或芽尖的长度。
1.3.2生理指标测定
收取萌发7 d的幼芽用液氮速冻,放入-80 ℃超低温冰箱保存待测各项生理指标。参考《植物生理生化实验原理和技术》中的方法[19],MDA含量用硫代巴比妥酸法测定,根系活力用TTC法测定。采用Zhang等[17]的方法,POD活性用愈创木酚法测定,CAT活性用H2O2法测定,SOD活性用氮蓝四唑(NBT)还原法测定。
1.4 数据处理
发芽势和发芽率的计算公式如下:
发芽势=3 d内有效发芽的种子数/种子总数×100%
发芽率=7 d内有效发芽的种子数/种子总数×100%
实验数据以平均值±标准差表示,数据采用Origin 8.6和 SPSS 19统计软件进行分析,并对不同处理间的数据用单因素方差分析(ANOVA)和Duncan多重比较进行差异显著性检验。
2 结果与分析(Results and analysis)
2.1 褪黑素对水稻种子发芽率和发芽势的影响
添加褪黑素可以促进As3+胁迫下水稻种子的萌发,并促进种子幼根的生长(图1)。褪黑素对As3+胁迫下水稻种子发芽率的影响见图2。从图中可以看出,随着As3+浓度的增加(0~100 μmol·L-1),其发芽率显著降低,当浓度为100 μmol·L-1时发芽率仅为对照处理的31.1%。添加外源褪黑素对不同As3+浓度下水稻种子发芽均有显著促进作用。当As3+浓度为5 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素相比,未添加处理分别提高水稻种子发芽率5.1%和6.3%。当As3+浓度为20 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素分别提高发芽率9.9%和16.9%。当As3+浓度增加到100 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素分别显著提高发芽率28.6%和57.1%。在没有As3+胁迫的时候,添加50、100 μmol·L-1褪黑素没有对水稻种子发芽产生影响。
图1 褪黑素(MT)对As3+胁迫下水稻种子萌发的影响(5 d)注:MT和As的浓度单位为 μmol·L-1。Fig. 1 Effects of exogenous melatonin (MT) on rice seed germination under As3+ stress (5 d)Note: The unit of MT and As concentration is μmol·L-1.
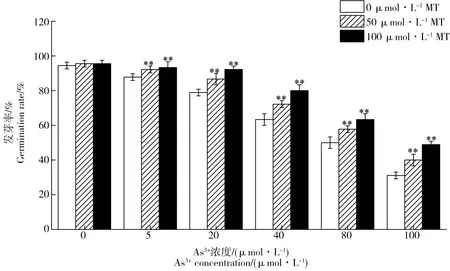
图2 褪黑素对As3+ 胁迫下水稻种子发芽率的影响注:*和**分别表示同一As3+ 浓度下添加褪黑素与未添加处理之间差异显著(P<0.05)和显著(P<0.01),下同。Fig. 2 Effects of exogenous melatonin on germination rate under As3+ stressNote: *and ** indicate in the same As3+ concentration treatment significant difference (P<0.05) and significant difference (P<0.01) between MT treatment and non-MT treatment respectively. The same below.
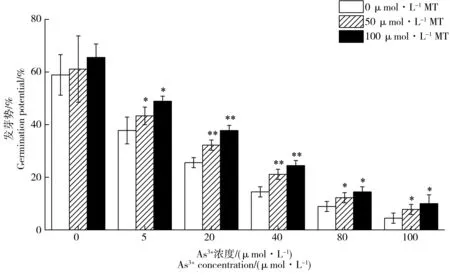
图3 褪黑素对As3+胁迫下水稻种子发芽势的影响Fig. 3 Effects of exogenous melatonin on germination potential under As3+ stress
图3为添加褪黑素对As3+胁迫下水稻种子发芽势的影响,如图所示,As3+胁迫对水稻种子发芽势有显著的降低作用。当As3+浓度从0 μmol·L-1升至100 μmol·L-1,其发芽势从58.9%降至4.4%。添加外源褪黑素对不同As3+浓度下水稻种子发芽势有明显的促进作用。当As3+浓度为20 μmol·L-1时,与没有添加褪黑素的对照相比,添加50和100 μmol·L-1褪黑素分别提高水稻种子发芽势26.1%和47.8%。当As3+浓度增加到100 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素分别提高发芽率75.0%和125.0%。
2.2 褪黑素对水稻根长及根芽鲜重的影响
表1为添加褪黑素对As3+胁迫下水稻根长、芽长的影响。从表1看出,As3+胁迫下,水稻根、芽生长受到明显的限制。随着As3+浓度的增加,萌发种子的根和芽长度也逐步下降,且对根系生长的抑制作用比芽更显著。5 μmol·L-1As3+胁迫下,水稻幼芽根长从11.47 cm降至9.56 cm,芽长从6.39 cm降至5.96 cm,相比对照组根长和芽长分别下降了16.7%和6.7%。而As3+增加至100 μmol·L-1时,根长从11.47 cm降至2.69 cm,芽长从6.39 cm降至3.97 cm,下降幅度更明显,分别为76.5%和38.0%。添加外源褪黑素明显促进As3+胁迫下水稻幼苗的生长。当As3+浓度为5 μmol·L-1时,与未添加褪黑素相比,添加50 μmol·L-1和100 μmol·L-1褪黑素显著提高根长14.1%和19.7%。当As3+浓度为40 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素分别提高水稻根长12.0%和24.5%,提高芽长4.9%和8.0%。当As3+浓度升高至100 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素分别提高水稻根长35.1%和50.0%。添加褪黑素对不同浓度As3+胁迫下水稻芽长的提高在2.5%~8.4%之间。在无As3+胁迫的情况下,50和100 μmol·L-1褪黑素对水稻幼芽根长和芽长没有显著影响。
表2为添加褪黑素对As3+胁迫下水稻根鲜重和芽鲜重的影响。从表2看出,As3+胁迫下,幼芽根鲜重和芽鲜重均明显下降。随着As3+浓度增加(0~100 μmol·L-1),根鲜重从0.67 g降至0.21 g,芽鲜重从0.62 g降至0.25 g。且As3+浓度越高,下降幅度越大。20 μmol·L-1As3+胁迫下水稻幼芽根鲜重和芽鲜重比对照处理分别下降了23.1%和22.0%;40 μmol·L-1As3+胁迫下水稻幼芽根鲜重和芽鲜重分别下降了33.0%和27.2%;而As3+浓度增加至100 μmol·L-1时根鲜重和芽鲜重下降幅度更明显,分别为69.2%和59.7%。外源褪黑素对水稻的根鲜重有明显的提高作用。当As3+浓度为20 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素比未添加褪黑素分别提高水稻根鲜重14.5%和24.4%。80 μmol·L-1As3+胁迫下,添加50 μmol·L-1和100 μmol·L-1褪黑素导致水稻幼芽根鲜重分别增加15.1%和35.2%。当As3+浓度增加至100 μmol·L-1时,相比于对照处理,添加50、100 μmol·L-1褪黑素使水稻根鲜重分别提高31.5%和63.7%。褪黑素处理同样也对水稻芽鲜重有提高作用。当As3+浓度为5 μmol·L-1时,50 μmol·L-1和100 μmol·L-1褪黑素处理分别导致水稻芽鲜重提高16.1%和22.4%。当As3+浓度为40 μmol·L-1时,50 μmol·L-1和100 μmol·L-1褪黑素处理分别导致水稻芽鲜重提高11.0%和17.8%。当As3+浓度升高至100 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素可分别提高33.0%和49.0%的芽鲜重。在无As3+胁迫的情况下,添加褪黑素对水稻芽鲜重没有显著影响。
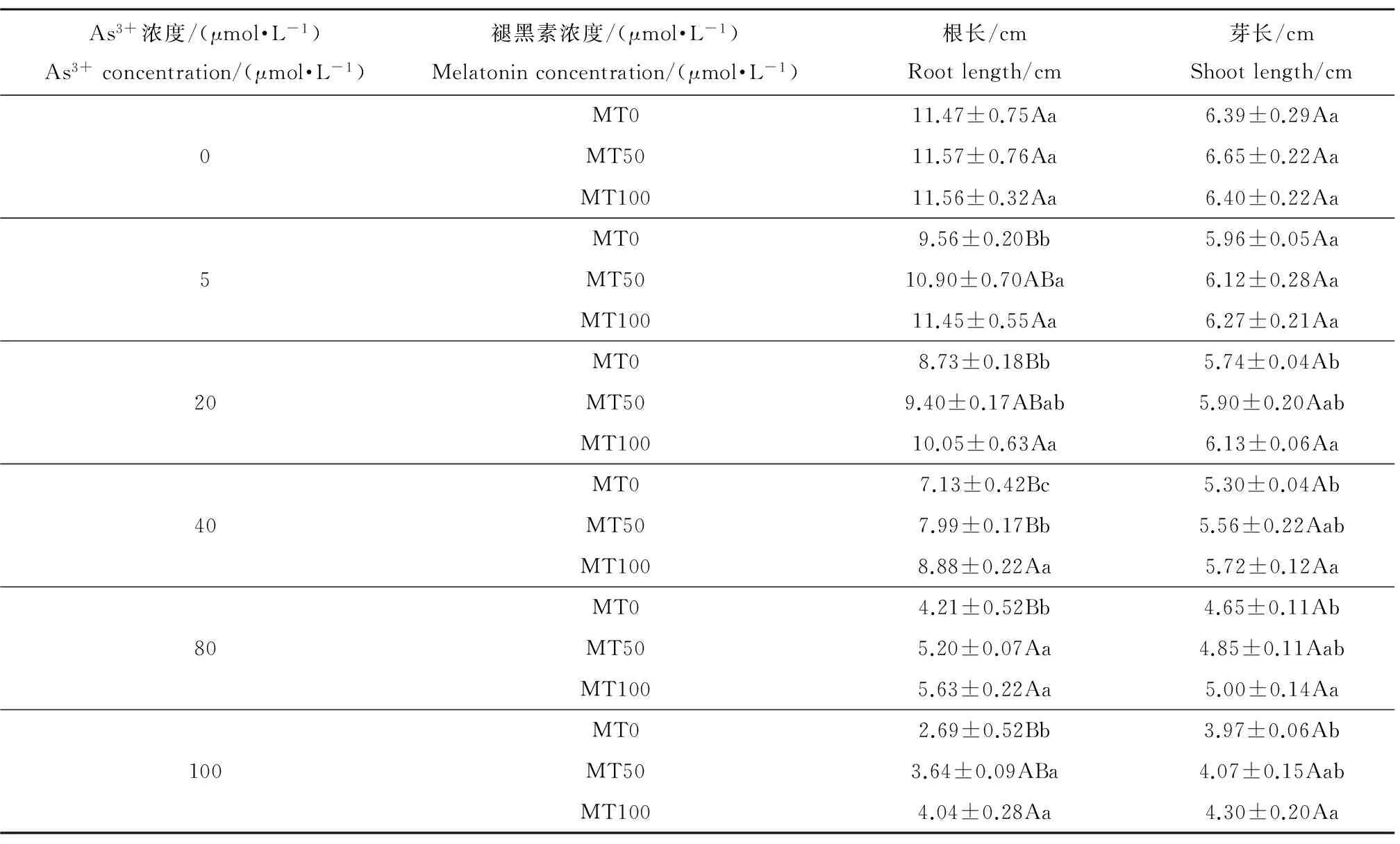
表1 褪黑素对As3+胁迫下水稻幼芽根长和芽长的影响Table 1 Effects of exogenous melatonin on root length, shoot length under As3+ stress
注:不同小写字母和大写字母分别表示同一As3+浓度不同褪黑素处理间差异达到显著水平(P<0.05)和显著水平(P<0.01),下同。
Note: Different lowercase letters and capital letters indicate in the same As3+concentration treatment significant difference (P<0.05) and significant difference (P<0.01) between MT treatment and non-MT treatment. The same below.
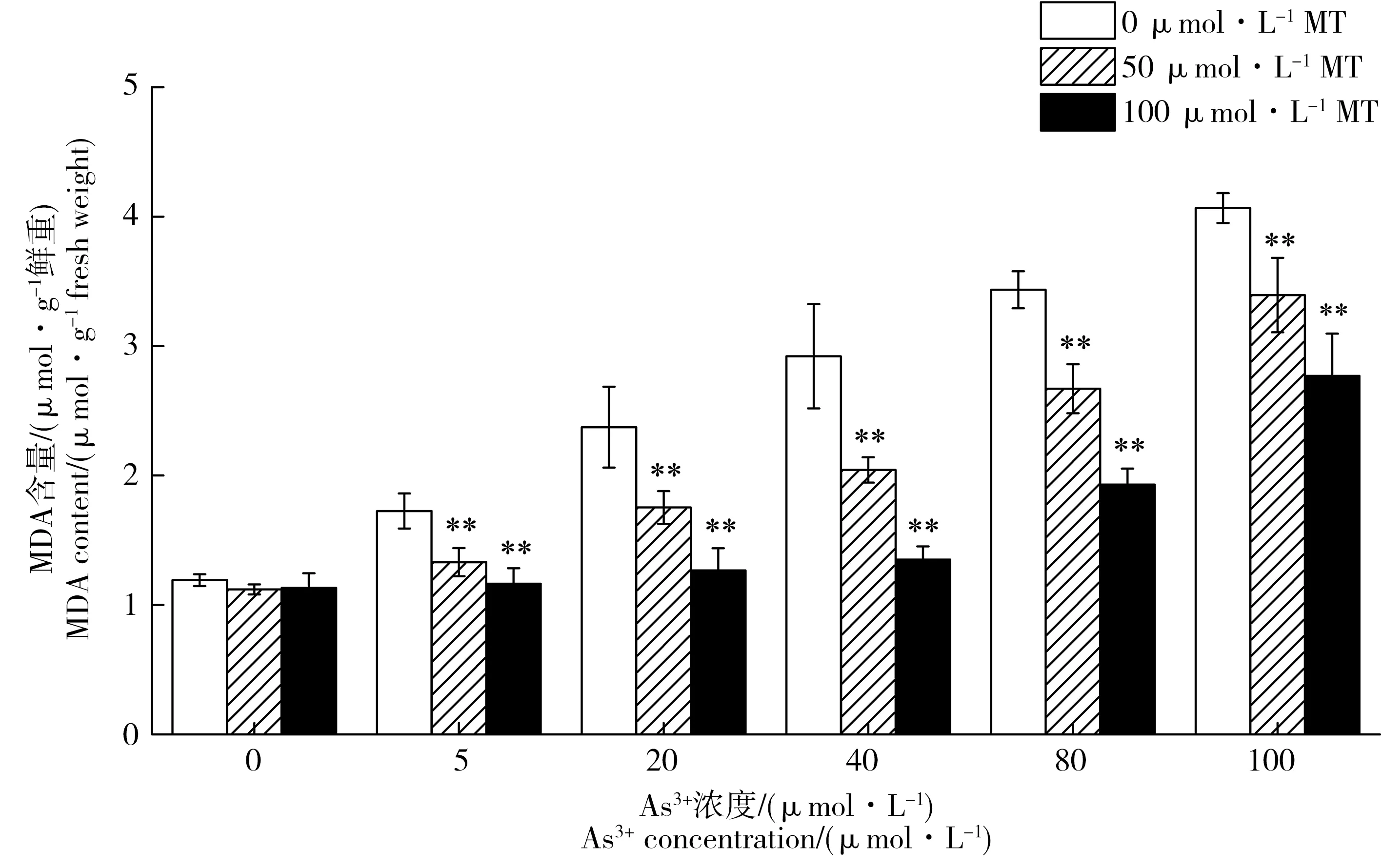
图4 褪黑素对As3+胁迫下水稻幼芽中MDA含量的影响Fig. 4 Effects of exogenous melatonin on MDA content of rice under As3+ stress
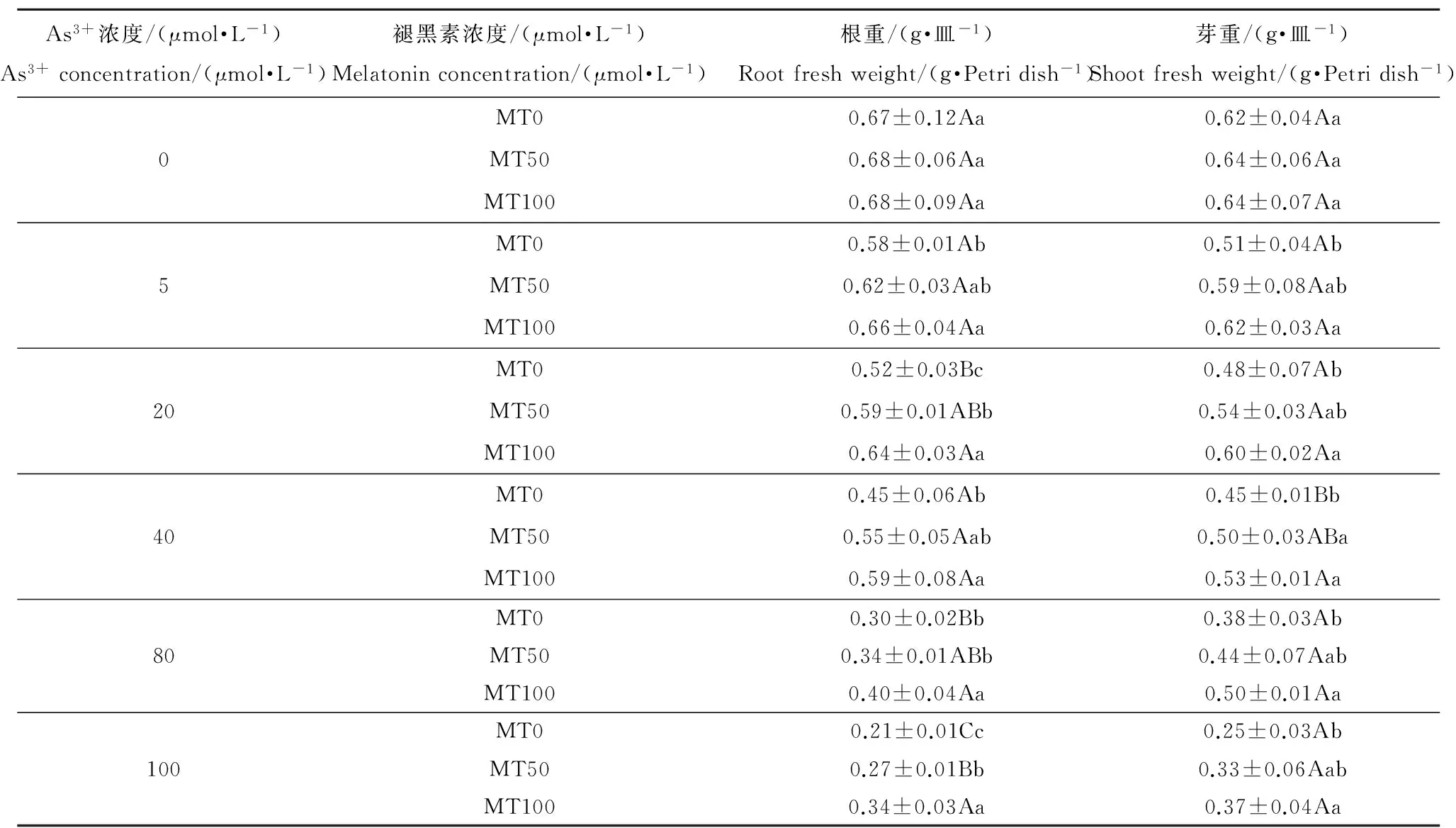
As3+浓度/(μmol·L-1)As3+concentration/(μmol·L-1)褪黑素浓度/(μmol·L-1)Melatoninconcentration/(μmol·L-1)根重/(g·皿-1)Rootfreshweight/(g·Petridish-1)芽重/(g·皿-1)Shootfreshweight/(g·Petridish-1)0MT00.67±0.12Aa0.62±0.04AaMT500.68±0.06Aa0.64±0.06AaMT1000.68±0.09Aa0.64±0.07Aa5MT00.58±0.01Ab0.51±0.04AbMT500.62±0.03Aab0.59±0.08AabMT1000.66±0.04Aa0.62±0.03Aa20MT00.52±0.03Bc0.48±0.07AbMT500.59±0.01ABb0.54±0.03AabMT1000.64±0.03Aa0.60±0.02Aa40MT00.45±0.06Ab0.45±0.01BbMT500.55±0.05Aab0.50±0.03ABaMT1000.59±0.08Aa0.53±0.01Aa80MT00.30±0.02Bb0.38±0.03AbMT500.34±0.01ABb0.44±0.07AabMT1000.40±0.04Aa0.50±0.01Aa100MT00.21±0.01Cc0.25±0.03AbMT500.27±0.01Bb0.33±0.06AabMT1000.34±0.03Aa0.37±0.04Aa
2.3 褪黑素对水稻幼芽中MDA含量及抗氧化酶活性的影响
图4为添加褪黑素处理对As3+胁迫下水稻幼芽中MDA含量。从图中可以看出,MDA含量随着As3+胁迫浓度的增加而升高。当As3+胁迫浓度从0 μmol·L-1升至100 μmol·L-1,MDA含量从1.19 μmol·g-1鲜重升高至4.07 μmol·g-1鲜重。5 μmol·L-1、20 μmol·L-1As3+胁迫后,MDA含量比对照分别增加了44.8%和99.2%。当As3+胁迫浓度在40~100 μmol·L-1时,MDA含量增加1.5~2.4倍。外源褪黑素处理显著降低不同As3+浓度下水稻幼芽的MDA含量。当As3+浓度为20 μmol·L-1时,添加50 μmol·L-1和100 μmol·L-1褪黑素使MDA含量显著下降,分别从对照时的2.37 μmol·g-1鲜重降至1.75 μmol·g-1和1.27 μmol·g-1鲜重。当As3+浓度持续升高时,添加褪黑素明显降低MDA含量。当胁迫浓度为100 μmol·L-1时,50 μmol·L-1和100 μmol·L-1褪黑素使MDA含量分别降低16.5%和31.9%。在无As3+胁迫的情况下,添加褪黑素对水稻幼芽中MDA含量没有显著影响。
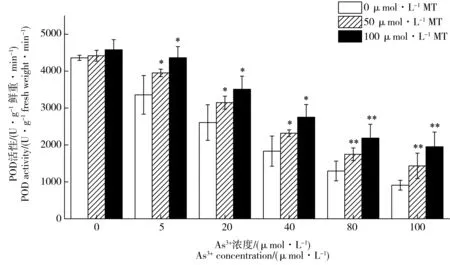
图5 褪黑素对As3+胁迫下水稻幼芽中POD活性的影响Fig. 5 Effects of exogenous melatonin on POD activity of rice under As3+ stress
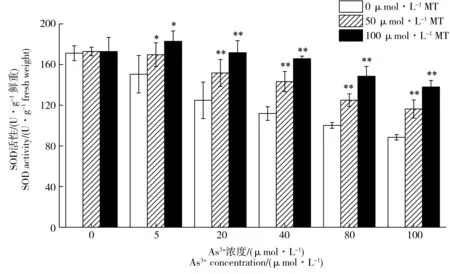
图6 褪黑素对As3+胁迫下水稻幼芽中SOD酶活性的影响Fig. 6 Effects of exogenous melatonin on SOD activity of rice under As3+ stress
图5为添加褪黑素处理对As3+胁迫下水稻幼芽中POD活性的影响。随着As3+胁迫浓度的升高(0~100 μmol·L-1),POD、CAT和SOD活性逐渐降低;POD活性从4 359.86降至909.23 U·g-1鲜重·min-1,CAT活性从748.19降至337.98 U·g-1鲜重·min-1,SOD活性从171.16降至88.44 U·g-1鲜重。在5~100 μmol·L-1As3+胁迫后,POD活性比无砷胁迫降低23.0%~79.1%,CAT活性降低12.9%~54.8%,SOD活性降低12.1%~48.3%。如图5所示,添加外源褪黑素对不同As3+浓度胁迫下水稻幼芽中POD活性均有明显的提高作用。当As3+胁迫浓度为100 μmol·L-1时,添加50和100 μmol·L-1褪黑素后水稻幼芽POD活性比对照处理分别提高57.5%和114.8%。在As3+胁迫浓度5~80 μmol·L-1,添加褪黑素后POD活性比对照提高了17.7%~68.9%。外源褪黑素处理后As3+胁迫下水稻幼芽中SOD、CAT活性的变化趋势与POD相似,均得到显著提升(图6和图7)。当As3+浓度为5 μmol·L-1时,相比于对照,添加50和100 μmol·L-1褪黑素处理后水稻幼芽中CAT活性分别提高14.7%和19.6%,SOD活性分别提高12.8%和21.5%。当As3+胁迫浓度在20~80 μmol·L-1时,不同浓度褪黑素处理后CAT活性提高19.8%~52.1%,SOD活性提高21.5%~48.2%。当As3+胁迫升高到100 μmol·L-1时,相比于对照,不同浓度褪黑素处理后水稻幼芽中CAT活性分别提高29.4%和53.6%,SOD活性分别提高31.5%和56.0%。在无As3+胁迫的情况下,添加褪黑素对水稻POD、CAT和SOD活性没有显著影响。
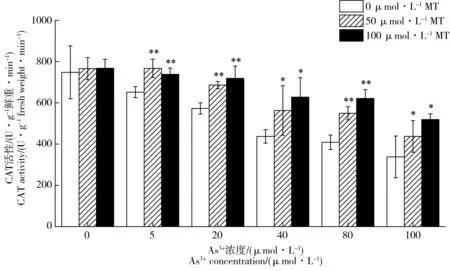
图7 褪黑素对As3+胁迫下水稻幼芽中CAT酶活性的影响Fig. 7 Effects of exogenous melatonin on CAT activity of rice under As3+ stress
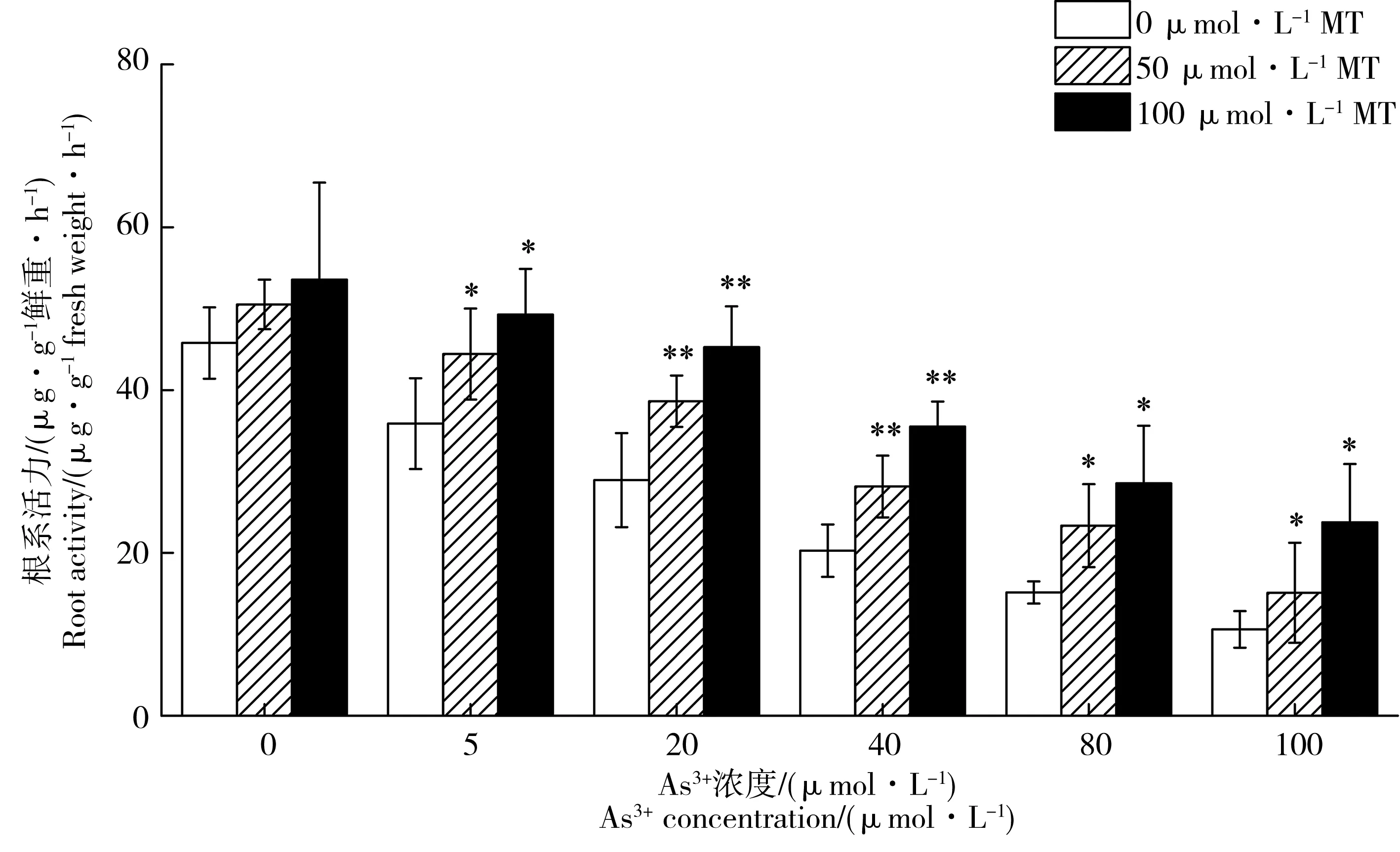
图8 褪黑素对As3+胁迫下水稻根系活力的影响Fig. 8 Effects of exogenous melatonin on rice root activity under As3+ stress
2.4 褪黑素对水稻根系活力的影响
添加外源褪黑素对As3+胁迫下水稻根系活力的影响如图8所示。从图中可知,As3+胁迫能显著降低水稻根系活力,且胁迫浓度从0 μmol·L-1升至100 μmol·L-1,根系活力从45.78降至10.60 μg·g-1鲜重·h-1。不同As3+浓度胁迫后(5~100 μmol·L-1),根系活力比对照处理下降了21.6%~76.8%。外源褪黑素处理能显著提高水稻的根系活力。当As3+浓度为5 μmol·L-1时,添加50和100 μmol·L-1外源褪黑素水稻根系活力比对照处理分别提高23.8%和37.3%。当As3+胁迫浓度在20~80 μmol·L-1时,50和100 μmol·L-1褪黑素处理均提高水稻的根系活力,提升幅度分别为33.5%~54.3%和56.4%~88.6%。当As3+胁迫升至100 μmol·L-1时,50、100 μmol·L-1褪黑素处理分别提高水稻根系活力42.4%和124.1%。
3 讨论(Discussion)
过量As3+显著抑制水稻的生长发育,其毒害机理主要是与水稻中酶和蛋白质上的巯基反应,抑制细胞的功能[20]。As3+胁迫下,水稻发芽率低、幼苗生长不良、细胞分裂遭受破坏,影响水稻的光合作用、代谢过程以及呼吸作用,最终影响水稻品质和产量。水稻在As毒害作用下,也会引起活性氧(ROS)的变化[21],产生氧化胁迫。本研究发现:As3+胁迫下水稻萌发受到明显抑制,主要表现为发芽率和发芽势显著下降,幼芽和幼根生长明显受损,且抑制程度随着As3+浓度的升高而增加。然而,外源褪黑素处理后均有效缓解As3+胁迫对水稻种子萌发产生的不利影响。Tan等[22]研究发现,褪黑素能促进铜胁迫下豌豆种子的萌发。Posmyk等[14]发现在铜胁迫下用褪黑素处理紫甘蓝能促进种子的萌发,与本文的结果相一致。
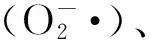
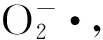
根系是水稻中水分和养分吸收的主要器官,其生长情况对根系自身发育以及水稻生长均产生重要影响。根系是水稻中有丝分裂最强的部分,As对其影响也最明显。根系活力主要反映植物根系长势及生长潜力。根系活力越高,水稻根系氧化、还原及合成的能力也越强,表明水稻根代谢越旺盛,根越健壮。我们的研究发现,As3+胁迫下,根系活力显著降低,表明As对根有明显的毒害作用。但是添加50 μmol·L-1和100 μmol·L-1褪黑素显著提高As胁迫下水稻的根系活力,且100 μmol·L-1比50 μmol·L-1提高幅度更大(图7)。有研究表明,添加褪黑素提高渗透胁迫下黄瓜的根系活力[37]。
近年来,不少专家学者对植物抵抗逆境进行了探索。与其他抗氧化剂如IAA、谷胱甘肽等相比,褪黑素不仅抗氧化能力更强,还可以刺激植物中谷胱甘肽的合成并提高其他抗氧化剂的活性。Hernndezruiz等[38]通过在离体白化羽扇豆下胚轴的试验发现褪黑素促进羽扇豆生长的效果约为IAA作用效果的10%~50%。除此以外,褪黑素还具有亲水性和亲脂性,能在细胞间自由穿梭,更好地发挥其清除自由基的作用。不仅如此,褪黑素容易购买,大规模使用也比较经济。因此,在对抗植物逆境,特别是重金属胁迫方面使用褪黑素具有广大的市场潜力。
本研究中施用不同浓度的褪黑素对植物抵抗As3+胁迫均产生较大影响,50和100 μmol·L-1褪黑素均能有效缓解As3+导致的氧化损伤且效果显著,主要是提高抗氧化系统的酶活性,从而减轻As3+造成的过氧化损伤。添加50和100 μmol·L-1褪黑素后,也明显缓解As3+胁迫对水稻种子萌发及水稻根系的毒害作用。实际应用过程时,可根据具体作物及逆境条件对褪黑素的浓度做出筛选。
参考文献(References):
[1]陈怀满. 环境土壤学[M]. 北京: 科学出版社, 2005: 100-101
Chen H M. Environment Pedology [M]. Beijing: Science Press, 2005: 100-101 (in Chinese)
[2]环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17) [2017-01-12]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm
[3]刘春早, 黄益宗, 雷鸣, 等. 湘江流域土壤重金属污染及其生态环境风险评价[J]. 环境科学, 2012, 33(1): 260-265
Liu C Z, Huang Y Z, Lei M, et al. Soil contamination and assessment of heavy metals of Xiangjiang River basin [J]. Environmental Science, 2012, 33(1): 260-265 (in Chinese)
[4]赵小燕, 吕家珑, 代允超, 等. 我国主要农田土壤对外源As(Ⅴ)吸附的差异及其与理化性质的关系[J]. 西北农林科技大学学报: 自然科学版, 2014, 42(9): 144-148
Zhao X Y, Lv J L, Dai Y C, et al. Difference in exogenous As(Ⅴ) adsorption and the relationship with soil physicochemical properties in major farmland types in China [J]. Journal of Northwest A & F University: Nature Science Edition, 2014, 42(9): 144-148 (in Chinese)
[5]莫昌琍, 吴丰昌, 符志友, 等. 湖南锡矿山锑矿区农用土壤锑、砷及汞的污染状况初探[J]. 矿物学报, 2013, 33(3): 344-350
Mo C L, Wu F C, Fu Z Y, et al. Antimony, arsenic and mercury pollution in agricultural soil of antimony mine area in Xikuangshan, Hunan [J]. Acta Mieralogica Sinica, 2013, 33(3): 344-350 (in Chinese)
[6]黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32(3): 409-417
Huang Y Z, Hao X W, Lei M, et al. The remediation technology and remediation practice of heavy metals-contaminated soil [J]. Journal of Agro-Environment Science, 2013, 32(3): 409-417 (in Chinese)
[7]陈同斌, 刘更另. 砷对水稻生长发育的影响及其原因[J]. 中国农业科学, 1993, 26(6): 50-58
Chen T B, Liu G L. Effects of arsenic on rice (Oryza sativa L.) growth and development and its mechanism [J]. Scientia Agricultura Sinica, 1993, 26(6): 50-58 (in Chinese)
[8]李仁英, 沈孝辉, 张耀鸿, 等. 无机砷对不同水稻品种种子萌发和幼苗光合生理的影响[J]. 农业环境科学学报, 2014, 33(6): 1067-1074
Li R Y, Shen X H, Zhang Y H, et al. Effects of inorganic arsenic on seed germination and photosynthetic characteristics of various rice cultivars [J]. Journal of Agro-Environment Science, 2014, 33(6): 1067-1074 (in Chinese)
[9]Lerner A B, Case J, Takahashi Y. Isolation of melatonin, the pineal gland factor that lightens melanocytes [J]. Journal of the American Chemical Society, 1958, 80(10): 2587
[10]Dubbels R, Reiter R J, Klenke E, et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry [J]. Journal of Pineal Research, 1995, 18(1): 28-31
[11]Afreen F, Zobayed S M A, Kozai T. Melatonin in Glycyrrhiza uralensis: Response of plant roots to spectral quality of light and UV-B radiation [J]. Journal of Pineal Research, 2006, 41(2): 108-115
[12]Tiryaki I, Keles H. Reversal of the inhibitory effect of light and high temperature on germination of Phacelia tanacetifolia seeds by melatonin [J]. Journal of Pineal Research, 2012, 52(3): 332-339
[13]Zuo B X, Zheng X D, He P L, et al. Overexpression of MzASMT improves melatonin production and enhances drought tolerance in transgenic Arabidopsis thaliana plants [J]. Journal of Pineal Research, 2014, 57(4): 408-417
[14]Posmyk M M, Kuran H, Marciniak K, et al. Presowing seed treatment with melatonin protects red cabbage seedlings against toxic copper ion concentrations [J]. Journal of Pineal Research, 2008, 45(1): 24-31
[15]Lee H Y, Byeon Y, Back K. Melatonin as a signal molecule triggering defense responses against pathogen attack in Arabidopsis and tobacco [J]. Journal of Pineal Research, 2014, 57(3): 262-268
[16]Turk H, Erdal S. Melatonin alleviates cold-induced oxidative damage in maize seedlings by up-regulating mineral elements and enhancing antioxidant activity [J]. Journal of Plant Nutrition and Soil Science, 2015, 178(3): 433-439
[17]Zhang H J, Zhang N, Yang R C, et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA 4, interaction in cucumber (Cucumis sativus L.) [J]. Journal of Pineal Research, 2014, 57(3): 269-279
[18]许昊, 苏锋, 高孝美. 砷和草甘膦复合污染对水稻种子萌发的影响[J]. 湖北农业科学, 2015, 54(22): 5540-5543
Xu H, Su F, Gao X M. Effect of combined pollution of arsenic and glyphosate on rice seed germination [J]. Hubei Agricultural Sciences, 2015, 54(22): 5540-5543 (in Chinese)
[19]王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 119-260
Wang X K. Principle and Technology of Plant Physiological and Biochemical Experiments [M]. Beijing: Higher Education Press, 2006: 119-260 (in Chinese)
[20]Tripathi R D, Srivastava S, Mishra S, et al. Arsenic hazards: Strategies for tolerance and remediation by plants [J]. Trends in Biotechnology, 2007, 25: 158-165
[21]Hartley W J, Ainsworth G, Meharg A. Copper and arsenate-induced oxidative stress in Holcus lanatus L.clones with differential sensitivity [J]. Plant, Cell and Environment, 2001, 24(7): 713-722
[22]Tan D X, Manchester L C, Helton P, et al. Phytoremediative capacity of plants enriched with melatonin [J]. Plant Signaling and Behavior, 2007, 2(6): 514-516
[23]Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance [J]. Journal of Experimental Botany, 2002, 53(366): 1-11
[24]Estebanzubero E, Alatorrejiménez M A, Lópezpingarrón L, et al. Melatonin's role in preventing toxin-related and sepsis-mediated hepatic damage: A review [J]. Pharmacological Research, 2016, 105: 108-120
[25]Frank T, Kee L W. Cadmium and cellular signaling cascades: Interactions between cell death and survival pathways [J]. Archives of Toxicology, 2013, 87(10): 1743-1786
[26]Schutzendubel A, Polle A. Plant responses to abiotic stresses: Heavy metal-induced oxidative stress and protection by mycorrhization [J]. Journal of Experimental Botany, 2002, 53(372): 1351-1365
[27]Foyer C H, Noctor G. Oxidant and antioxidant signalling in plants: A re-evaluation of the concept of oxidative stress in a physiological context [J]. Plant Cell & Environment, 2005, 28(8): 1056-1071
[28]Shri M, Kumar S, Chakrabarty D, et al. Effect of arsenic on growth, oxidative stress, and antioxidant system in rice seedlings [J]. Ecotoxicology and Environmental Safety, 2009, 72(4): 1102-1110
[29]Stoeva N, Bineva T. Oxidative changes and photosynthesis in oat plants grown in As-contaminated soil [J]. Bulgarian Journal of Plant Physiology, 2002(1-2): 87-95
[30]朱云集, 王晨阳, 马元喜, 等. 砷胁迫对小麦根系生长及活性氧代谢的影响[J]. 生态学报, 2000, 20(4): 707-710
Zhu Y J, Wang C Y, Ma Y X, et al. Effects of arsenic stress on the growth and metabolism of the wheat root system [J]. Acta Ecologica Sinica, 2000, 20(4): 707-710 (in Chinese)
[31]Reiter R J, Tan D X. Melatonin: An antioxidant in edible plants [J]. Annals of the New York Academy of Sciences, 2002, 957: 341-344
[32]Pieri C, Marra M, Moroni F. Melatonin: A peroxyl radical scavenger more effective than vitamin E [J]. Life Science, 1994, 55(15): 271-276
[33]Tan D X, Manchester L C, Terron M P, et al. One molecule, many derivatives: A never-ending interaction of melatonin with reactive oxygen and nitrogen species? [J]. Journal of Pineal Research, 2007, 42(1): 28-42
[34]刘仕翔, 黄益宗, 罗泽娇, 等. 外源褪黑素处理对镉胁迫下水稻种子萌发的影响[J]. 农业环境科学学报, 2016, 35(6): 1034-1041
Liu S X, Huang Y Z, Luo Z J, et al. Effects of exogenous melatonin on germination of rice seeds under Cd stresses [J]. Journal of Agro-Environment Science, 2016, 35(6): 1034-1041 (in Chinese)
[35]Kanazawa S, Sano S, Koshiba T, et al. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence: Comparison with those during dark-induced senescence [J]. Physiologia Plantarum, 2000, 109(2): 211-216
[36]Shah K, Kumar R G, Verma S, et al. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings [J]. Plant Science, 2001, 161(1): 1135-1144
[37]张娜. 褪黑素处理对渗透胁迫下黄瓜种子萌发及幼苗生长的影响及其分子机制[D]. 北京: 中国农业大学, 2014: 10-11
Zhang N. Regulation of melatonin and seeding growth under osmotic stress in cucumber [D]. Beijing: China Agricultural University, 2014: 10-11 (in Chinese)
[38]Hernandezruiz J, Cano A, Arnao M B. Melatonin: A growth-stimulating compound present in lupin tissues [J]. Planta, 2004, 220(1): 140-144

