貉细小病毒SD1607株的分离鉴定及VP2基因序列分析
齐 宇 , 蒋依倩, 扈荣良, 管 岩, 张英海, 张迎志, 张国军
(1.吉林和元生物工程股份有限公司 , 吉林 松原 138000 ; 2.军事医学科学院军事兽医研究所 , 吉林 长春 130112 ;3.山东省诸城市畜牧局 , 山东 诸城 262200 ; 4.河北省乐亭县畜牧局 , 河北 唐山 063600)
貉(N.procyonoides),属于食肉目、犬科动物,其皮张具有针毛长、底绒丰厚,保温力强等特点,是我国重要的毛皮动物养殖种类之一。近年来,由于貉皮在国际毛皮市场中价格不断上涨,我国貉养殖数量也随之增加。据统计,2014-2015年我国貉养殖存栏总量均高达2 500万只以上[1],其毛制品大量出口,为养殖者带来丰厚的经济效益。然而随着养殖规模和养殖密度的扩大,各类传染病的感染和传播的风险也相应增加。
本试验从山东某貉养殖场疑似患细小病毒性肠炎的貉肠道中成功分离出1株RDPV,并对其VP2基因进行了序列分析,为貉细小病毒性肠炎的流行病学调查奠定基础,同时对了解貉细小病毒病的抗原变异情况及其防控具有积极意义。
1 材料与方法
1.1 病料采集及处理 采自山东诸城某貉养殖场疑似患细小病毒性肠炎死亡的貉子肠道组织。加入3倍体积生理盐水充分研磨制成组织匀浆,反复冻融3次,10 000 r/min离心5 min,取上清加入等体积氯仿混匀,室温作用30 min,10 000 r/min (4 ℃)离心20 min取上层水相,过滤除菌,-80 ℃保存备用。
1.2 细胞株及试剂 猫肾细胞(F81)。ExTaqDNA聚合酶、pMD18-T载体、BamHI、XhoI和DH5α感受态细胞,均购自上海宝生物有限公司;DNA提取试剂盒、胶回收试剂盒,均购自康宁公司。
1.3 病毒培养 采用同步接毒的方式,按照体积比1∶10同步接入病料处理液,细胞培养箱中静置培养,并设置正常细胞对照,逐日观察细胞病变(CPE)情况。若有CPE出现则初步判为阳性,并在细胞病变达到80%以上时收毒。
1.4 PCR鉴定 出现CPE后,将病毒继续培养至第5代,取细胞培养物反复冻融2次为样品,按照DNA提取试剂盒说明书提取基因组。参照周云朵等[3]建立的肉食兽细小病毒检测方法进行PCR检测。
1.5 病毒的形态学观察 将病毒液经10 000 r/min (4 ℃)离心10 min,取上清液加入0.5%磷钨酸溶液染色,用电镜观察其形态学特征。
1.6 病毒组织细胞半数感染量TCID50测定 CPV阳性第5代细胞培养物反复冻融后取上清液依次做10倍稀释,分别接种于F81细胞96孔培养板中,每个稀释度做8个重复,0.1 mL/孔,设正常细胞为对照组,观察至120 h,记录病变孔数目,按Reed-Muench法计算病毒的TCID50。
1.7 VP2引物合成 参考GenBank中已发表的貉源细小病毒VP2全基因序列,利用Primer Premier 5.0软件设计1对引物,VP2-F:5′-CGGGATCCATGAGTGATGGAGCAGTTCAA-3′, VP2-R:5′-CCGCTCGAGTTAATATAATTTTCTAGGTGCT-3′。其中上游引物引入BamHI 酶切位点,下游引物引入XhoI 酶切位点。引物由吉林省库美生物科技有限公司合成。
1.8 VP2基因PCR扩增与克隆质粒构建 提取的病毒基因组为模板,按照常规方法进行PCR反应,反应条件为:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 45 s,72 ℃ 90 s,30个循环,72 ℃延伸10 min。取3 μL PCR产物在1%琼脂糖凝胶上进行电泳检测。按照胶回收试剂盒说明书方法回收VP2基因PCR产物,并与克隆载体pMD18-T连接,转化至DH5α感受态细胞,培养过夜后,挑取单菌落扩大培养。提取质粒DNA,利用BamHI 和XhoI限制性内切酶进行双酶切鉴定,阳性重组质粒送往吉林省库美生物科技有限公司测序。
2 结果
2.1 病毒分离结果 正常细胞边缘清晰,形态统一(图1A);接种病毒后的F81细胞,在第72 h开始出现细胞圆缩、肿胀、聚集成团,边缘细胞形态细长,细胞间隙变大,呈抽丝拉网样病变(图1B)。
2.2 PCR鉴定结果 利用肉食兽细小病毒通用引物对分离株病毒进行PCR扩增,得到与预期片段大小相符的目的条带(图2)。
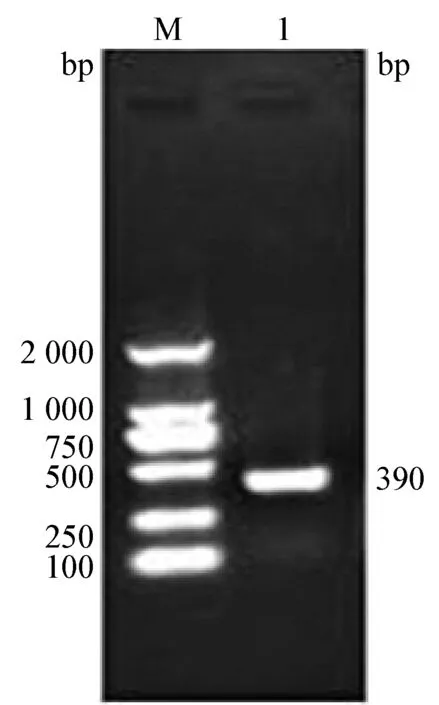
图2 肠道组织PCR特异性引物扩增结果
2.3 病毒形态观察结果 病毒经磷钨酸染色后,通过透射电镜观察可见到典型的细小病毒病毒粒子,直径约20 nm,呈圆形或卵圆形,将病毒命名为RDPV-SD1607株。
2.4 毒力测定结果 按照Reed-Muench法计算RDPV-SD1607株分离毒的TCID50为1.0×10-4.5/mL。
2.5 VP2基因序列测定与遗传进化分析 提取RDPV-SD1607株基因组,进行VP2全基因的PCR扩增,经克隆、酶切鉴定(图3)后送往吉林省库美生物科技有限公司测序,并对序列结果进行整理拼接,得到RDPV-SD1607株VP2全基因序列,长度为1 755 bp。与GenBank中肉食兽细小病毒核苷酸相似性在97.44%~99.49%。将RDPV-SD1607与其他24株不同来源的肉食兽细小病毒VP2基因序列进行分析,绘制系统进化树(图4)。

图3 重组质粒pMD18T-VP2 PCR及酶切鉴定
3 讨论
貉细小病毒属于细小病毒科,细小病毒属成员。病毒粒子无囊膜,不含糖和脂类,结构坚实紧密,因此该病毒对外界理化因素具有非常强大的抵抗力,可在自然界长期存活并广泛传播。虽然细小病毒是DNA病毒,但它却与RNA病毒类似,基因突变率特别高,许多新的亚型不断被发现[5]。1894年我国首次报道了貉细小病毒性肠炎,但直到1988年才首次分离到貉细小病毒[6]。2009年,闫喜军等[7]从辽宁、河北省地区分离到6株CPV-2型貉细小病毒。同年,刘双翼等[8]从大庆地区分离到8株CPV-2 c型貉源细小病毒。
细小病毒属成员核衣壳蛋白结构相似,均由VP1、VP2、VP3构成。其中VP2蛋白是细小病毒衣壳蛋白的重要组成成分,几乎包含了病毒所有的中和抗原表位[9]。VP2蛋白关键位点氨基酸的改变可以引起细小病毒的抗原特性、细胞嗜性及宿主范围发生变化。研究表明,细小病毒在不同pH值缓冲液中的血凝性与VP2蛋白323位氨基酸残基相关。当FPLV的VP2蛋白323位残基为Asn时,在pH值高达7.5时仍表现出血凝性;而当CPV的323位残基为Asp时,只能在pH值6.6以下才能表现出血凝性[10]。VP2蛋白第300位氨基酸残基则是影响CPV感染宿主细胞的关键位点。2015年,Andrew等[11]发现,从浣熊体内分离的CPV变异株不能感染犬细胞,而当其VP2蛋白300位氨基酸残基由Asn变为Ala时就能有效地结合犬细胞表面的TfR,从而感染犬细胞。虽然肉食兽细小病毒属各成员间亲缘关系较近,抗体具有交叉保护性,但即使是与RDPV亲缘关系最近的CPV-2相比,VP2蛋白中部分氨基酸仍有差异,这些差异对RDPV的抗原特性的影响,仍有待进一步研究。
本试验从貉肠道中成功分离出一株RDPV并对其VP2全基因序列进行了测序及分析,且与国内外发表的犬细小病毒分离株、犬细小病毒疫苗株、貉细小病毒分离株、浣熊细小病毒分离株、水貂细小分离株、猫细小病毒分离株、狐细小病毒分离株进行了同源性比较。结果发现, RDPV-SD1607的VP2基因片段长度为1 775 bp,与FPLV和MEV相比,该分离株VP2基因与CPV具有更高的同源性,核苷酸同源性均在99.0%以上,且与RDPV-HB3(GenBank登陆号为GU392240)分离株的同源性最高,达99.49%。系统进化树结果表明, RDPV-SD1607位于细小病毒CPV-2亚型和CPV-2a亚型聚类分支之间,推测其可能正处于CPV-2亚型向CPV-2a亚型进化的中间状态,或是CPV适应貉而形成的新毒株。将该分离株与9个参考毒株VP2蛋白的关键位点的氨基酸[12-13]进行比较分析,结果发现与RDPV-HB3、CPV-Cv、CPV-Vac 1株关键位点氨基酸一致,判定该分离株属于CPV-2型。推测可能是由于多数养殖场对犬使用犬细小病毒弱毒疫苗(CPV-2型)进行免疫,免疫后的犬持续排毒,CPV-2弱毒株在易感动物间传播过程中毒力返强,身为CPV-2易感动物的貉,因接触了含细小病毒的粪便而感染发病。
参考文献:
[1] 佚名. 中国貂、狐、貉存栏数量统计报告(2015)[J]. 特种经济动植物, 2016, 19(1):18-19.
[2] 呼延良澔, 钱爱东, 张海玲,等. 貉细小病毒HLJ11-1株的分离鉴定及VP2基因序列分析[J]. 黑龙江畜牧兽医, 2014(17):11-16.
[3] 周云朵, 康真玉, 陈月平,等. 犬细小病毒的分离鉴定与生物学特性分析[J]. 畜牧兽医学报, 2011, 42(10):1 402-1 408.
[4] 殷震. 动物病毒学[M].北京: 科学出版社, 1997.
[5] Veijalainen P. Characterization of biological and antigenic properties of raccoon dog and blue fox parvoviruses: a monoclonal antibody study[J]. Veterinary Microbiology, 1988, 16(3):219-230.
[6] 夏咸柱, 叶俊华. 犬用细小病毒自然弱毒株的分离、鉴定和免疫研究[J]. 中国预防兽医学报, 1989,21(6):6-9.
[7] 闫喜军, 张蕾, 柴秀丽. 我国狐、貉体内发现2型犬细小病毒[J]. 特产研究, 2010, 32(1):79-79.
[8] 刘双翼, 余丽芸, 侯喜林,等. 貉源细小病毒的分离鉴定[J]. 中国兽医科学, 2009, 39(3):214-218.
[9] Cavalli A, Martella V C,Camero M,etal.Evaluation of the Antigenic Relationships among Canine Parvovirus Type 2 Variants[J].Clinical & Vaccine zmmunology,2008,15(3):534-539.
[10] 康洪涛. 貉细小病毒分离鉴定及免疫原性研究[D].北京: 中国农业科学院, 2012.
[11] Allison A B, Organtini L J, Zhang S,etal. Single mutations in the VP2 300 loop region of the three-fold spike of the carnivore parvovirus capsid can determine host range[J]. Journal of Virology, 2016,90(2).
[12] Shackelton L A, Parrish C R, Truyen U,etal. High rate of viral evolution associated with the emergence of carnivore parvovirus[J]. Proceedings of the National Academy of Sciences, 2005, 102(2):379-384.
[13] 邱薇, 范泉水, 李作生,等. 犬细小病毒VP2基因的比较及分型研究[J]. 动物医学进展, 2005, 26(5):69-72.

