水浴消解与传统工艺制备北部湾南美白对虾甲壳素研究
蓝尉冰,王帅静,韩鑫,肖金亮
(1.钦州学院,广西 钦州 535099;2.广西高校北部湾特色海产品资源开发与高值化利用重点实验室(钦州学院),广西 钦州 535099;3.广西大学,南宁 530004;4.武汉理工大学,武汉 430063)
甲壳素又名甲壳质、壳蛋白和壳聚糖,甲壳素及其衍生物以独特的功能和特性被广泛应用于环境保护、食品、医药等领域[1]。如甲壳素直接被用来制造味精及酱油等调味品[2],甲壳素经脱乙酰得壳聚糖作为调味品[3],南美白对虾是世界养殖产量最高的三大优质虾种之一,而我国的南美白对虾除鲜售外大部分加工成去头、去壳的冻虾和虾仁出口,在此过程中产生大量的虾类废弃物,造成资源浪费及环境污染[4],因此这些废弃物的利用应给予足够的重视。目前,国内外新兴的甲壳素制备方法主要有酶法[5]、发酵法[6]、化学改良法等[7-11],但对南美白对虾甲壳素制备过程中数学表达式及模型建立研究较少。故本实验采用水浴消解技术来优化传统工艺,使脱除蛋白和脱除碳酸钙盐可在较短时间内完成,建立广西北部湾地区南美白对虾废弃物制备甲壳素数学表达式,从而有效利用广西北部湾水产资源,减少废弃物排放,有效降低环境污染。
1 材料与方法
1.1 材料与试剂
新鲜南美白对虾:购自广西钦州钦南区东风海鲜市场。
1.2 仪器与设备
EL204电子天平、EL20实验室pH计、HH-S4数显恒温水浴锅梅特勒-托利多仪器(上海)有限公司; SZ-500A-3超高速多功能粉碎机永康市善竹贸易有限责任公司;V-1800PC可见分光光度计上海美谱达仪器有限公司。
1.3 试验方法
1.3.1制备工艺
虾头、虾壳→烘干预处理→NaOH溶液脱蛋白(水浴条件下)→水洗至中性→烘干→盐酸脱钙(水浴条件下)→水洗至中性→烘干→过氧化氢溶液漂白→水洗至中性→低温干燥→甲壳素产品[12]。
1.3.2脱蛋白单因素试验
以脱蛋白率为指标,分别按以下考察因素进行试验:料液比1∶15,1∶20,1∶25,1∶30,1∶35(g/mL);反应时间0.5,1.0,1.5,2.0,2.5 h;反应温度60,70,80,90,100 ℃;NaOH浓度1%,3%,5%,7%,9%后离心测定上清液蛋白质含量。
1.3.3蛋白质含量测定
考马斯亮蓝法[13,14]。
1.3.4蛋白质脱除率测定
式(1)
式中:α为脱蛋白率,%;x为蛋白质含量,μg;V1为提取液总体积,mL;V0为测定时取用提取液体积,mL;m0为预处理样品的质量;X1为预处理样品中蛋白质的质量分数,%。
1.3.5脱钙工艺
基于本课题组前期工作,选择脱钙工艺为HCl浓度3%,水浴时间1.0 h,水浴温度60 ℃,料液比1∶35(g/mL)。
1.3.6脱钙率W测定[15,16]
用移液管移取1 mL上清液于100 mL的锥形瓶中,加入10 mL蒸馏水、1 mL浓度为10% NaOH溶液及钙指示剂2~3滴,充分混匀后,用EDTA溶液滴定,锥形瓶中溶液从红色变为蓝色,即为终点。平行标定3次,记下所消耗的EDTA溶液的体积。
脱钙率W按下式计算:
式(2)
式中:W为脱钙率,%;V为溶液体积,mL; VEDTA为滴定消耗的体积,L; CEDTA为EDTA浓度,mol/L;MCa为钙的摩尔质量,g/mol;m为脱蛋白后的质量,g;X2为脱蛋白后样品中钙的质量分数,%。
1.3.7甲壳素得率测定
将脱蛋白、脱钙后所得样品进行双氧水漂白(10%,80 ℃,2 h),洗净烘干即可得到甲壳素,甲壳素得率为:

式(3)
1.4 水浴消解脱蛋白正交试验
采用4因素3水平的分析方法进行正交试验设计[17],见表1。
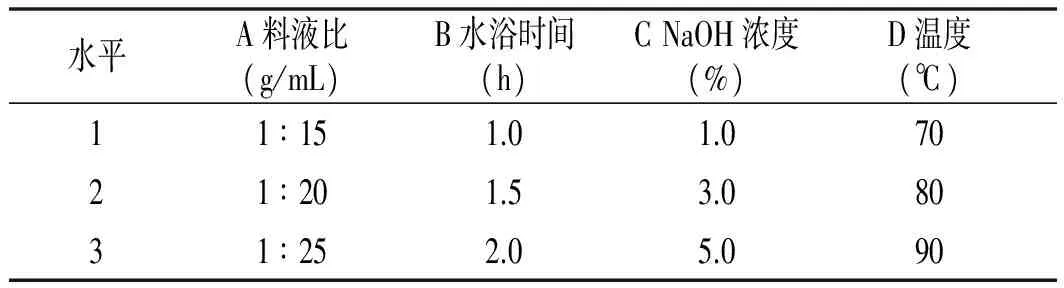
表1 正交试验因素水平Table 1 Factors and levels of orthogonal experiment
1.5 传统工艺
取预处理过的虾头、虾壳粉,调整料液比,加入10%氢氧化钠,于100 ℃加热2.0 h,不停搅拌,冷却至室温,抽滤蒸馏水洗至中性,重复此步2次后用5% HCl溶液于室温下浸泡8.0 h,不断搅拌,水洗滤渣至中性,重复此步2次。之后用双氧水漂白,干燥,即得甲壳素产品。
1.6 数据处理
采用Origin 8.0 进行数据处理及图表处理。
2 结果与分析
2.1 水浴时间对脱蛋白率的影响
水浴时间对虾废弃物脱蛋白率的影响见图1。
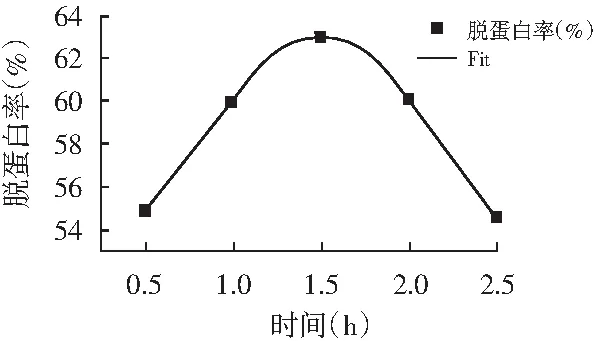
图1 水浴时间对脱蛋白率的影响及拟合曲线Fig.1 Effect of water bath time on protein removal rate and fitting curve
水浴时间在0.5~1.5 h脱蛋白率呈上升趋势,水浴时间达1.5 h时脱蛋白率达最高;之后随水浴时间延长脱蛋白率呈下降趋势,可能是因为时间越长会导致产品的水解,因此水浴时间取1.5 h为最佳。且对该曲线进行拟合,符合Gauss 函数模型,所得拟合曲线方程见为式(4),y0=50.53232,Xc=1.49095,W=1.34464,A=20.99076,拟合判定系数R2=0.98,说明此模型符合,在水浴时间为0.5~2.5 h时,虾头虾壳脱蛋白都有规律,可根据所得方程估算出用量,控制脱蛋白率。
式(4)
2.2 水浴温度对脱蛋白率的影响
水浴温度对脱蛋白率的影响见图2。
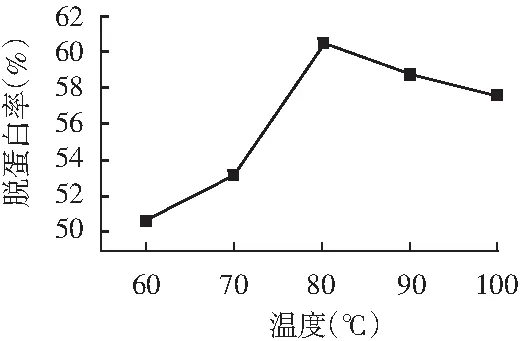
图2 水浴温度对脱蛋白率的影响Fig.2 Effect of water bath temperature on protein removal rate
由图2可知,温度越高,脱蛋白质的效果越好,当温度达80 ℃时脱蛋白率达最高,而当温度超过80 ℃时脱蛋白率有下降趋势,从经济角度考虑,以80 ℃的水浴温度脱蛋白质为最佳。
2.3 料液比对脱蛋白率的影响
料液比对脱蛋白率的影响见图3。

图3 料液比对脱蛋白率的影响Fig.3 Effect of material-liquid ratio on protein removal rate
料液比对脱蛋白率有显著影响,其趋势是先增大后降低。料液比为1∶15~1∶20(g/mL)时脱蛋白率呈上升趋势,当达到1∶20(g/mL)时脱蛋白率最高,后脱蛋白率呈下降的趋势,因此脱蛋白时料液比取1∶20(g/mL)为最佳。
2.4 NaOH浓度对脱蛋白率的影响

图4 NaOH浓度对脱蛋白率的影响及拟合曲线Fig.4 Effect of NaOH concentration on protein removal rate and fitting curve
由图4可知,脱钙率随NaOH的浓度增大呈先增大后下降的变化趋势,呈非线性状态,在1%~3%脱蛋白率呈上升趋势,当NaOH浓度在3%时达最高,当继续提高NaOH浓度时,脱蛋白率呈下降趋势。对该曲线进行拟合,符合Gauss 函数模型,所得拟合曲线方程见式(4)。y0=38.94297,Xc=3.7871,W=3.17071,A=111.26518,拟合判定系数R2=0.96,说明此模型符合,在NaOH的浓度为1%~9%时,虾头虾壳脱蛋白都有规律,可根据所得方程估算出用量,控制脱蛋白率。
2.5 水浴脱蛋白正交试验结果

表2 正交试验结果Table 2 Orthogonal test results

续 表
由表2可知,料液比的极差R为8.404,水浴时间的极差R为1.830,碱浓度的极差R为12.677,水浴温度的极差R为7.056。由此可知,碱浓度是影响脱蛋白率的最主要因素,综合考虑,影响脱蛋白率的因素的主次为:NaOH浓度>料液比>水浴温度>水浴时间。根据极差分析结果可知,脱蛋白的最佳工艺参数为:A3B1C2D1,即NaOH浓度为3%,料液比为1∶20(g/mL)水浴温度为80 ℃,水浴时间为1.5 h。
为进一步判断上述4因素对正交试验结果的影响是否显著,将正交试验数据进行方差分析,选择水浴时间为误差所在的列,结果见表3。

表3 方差分析Table 3 Variance analysis
注:**表示非常显著水平(F>F0.01(2,2));*表示显著水平(F0.05(2,2) 由表3可知,在95%置信度时,误差所在列为水浴时间,料液比与碱浓度对脱蛋白率的影响显著,而水浴时间和水浴温度对脱蛋白率影响不显著,这说明料液比和NaOH浓度对脱蛋白率起主要作用,水浴温度和水浴时间对脱蛋白率影响不大。 本试验以南美白对虾虾头、虾壳为原料,通过脱蛋白、脱钙、脱色素三步骤提取甲壳素,以脱蛋白率、甲壳素得率为指标,分别通过对脱蛋白进行单因素试验和正交试验,经正交结果分析,脱蛋白的最佳工艺条件为NaOH浓度3%,料液比1∶20(g/mL),水浴温度80 ℃,水浴时间1.5 h;为提高试验的可信度,在此条件下验证,5次验证试验得到的甲壳素的得率分别为23.88%,24.02%,23.92%,24.00%,23.87%。通过验证试验发现甲壳素的平均得率可达23.94%,故甲壳素提取工艺稳定可行。 表4 水浴消解与传统工艺提取甲壳素结果比较Table 4 Comparison of water bath digestion and traditional process for chitin extraction % 由表4可知,用水浴消解法提取甲壳素时,脱蛋白率为75.12%,脱钙率为96.00%,甲壳素得率为23.94%;传统工艺提取甲壳素时,脱蛋白率为52.45%,脱钙率为70.54%,甲壳素得率为14.63%。由此可知,水浴消解提取甲壳素比传统工艺多了9.31%,该方法不仅可以解决传统工艺的一些不足,而且可以提高甲壳素得率。 本次试验采用水浴消解法优化传统工艺,考察水浴时间、水浴温度、料液比、NaOH浓度制备甲壳素过程的规律研究,脱蛋白率都随水浴时间、水浴温度、料液比、碱浓度增大呈先增大后减小的趋势,且时间、NaOH浓度对脱蛋白率符合Gauss 函数模型,所得拟合曲线方程系数分别为y0=50.53232,Xc=1.49095,W=1.34464,A=20.99076,R2=0.98及y0=38.94297,Xc=3.7871,W=3.17071,A=111.26518,R2=0.96。4个因素对脱蛋白率的影响依次为:NaOH浓度>料液比>水浴温度>水浴时间。最佳工艺参数为:A3B1C2D1,即NaOH浓度3%,料液比1∶20(g/mL),水浴温度80 ℃,水浴时间1.5 h。水浴消解提取甲壳素比传统工艺多了9.31%,这能为有效提取甲壳素提供一定的理论支撑,同时也能缓解提取甲壳素时所造成的污染问题的严重性。 参考文献: [1]王建刚,严涛海,陈光艺.虾蟹壳制取甲壳素工艺的实验研究[J].轻纺工业与技术,2012,41(5):1-3. [2]包光迪.甲壳质制造味精及鲜酱油等调味料的方法[J].化学世界,1955(10):52. [3]范素琴,陈鑫炳,王成忠.黄粉虫甲壳素-壳聚糖在食品工业中应用[J].粮食与油脂,2009(12):43-45. [4]庄志凯,蓝尉冰,吉宏武,等.南美白对虾虾头蛋白酶提取工艺的研究[J].食品工业科技,2010(12):227-230. [5]曹文红,章超桦,洪鹏志.响应面法优化南美白对虾虾头自溶工艺的研究[J].中国食品学报,2009,9(1):158-159. [6]王云阳,李元瑞,张丽.蓝色犁头霉酵法制备甲壳素和壳聚糖的研究[J].中国食品学报,2005,5(3):43-45. [7]黄俊娴,杨建男.EDTA处理虾壳制备甲壳素的研究[J].现代食品科技,2009,25(3):296-297. [8]李婷,胡小喜,周幸芝,等.从虾蟹壳中提取甲壳素的研究进展[J].食品工业,2014,35(6):209-212. [9]Tretenichenko E M,Datsun V M,Ignatyuk L N,et al.Properties of chitin and chitosan from a hydroid polyp[J].Russian Journal of Applied Chemistry,2006,79(8):1341-1346. [10]Rashidova S S,Milusheva R Y,Voropaeva N L,et al.Isolation of chitin from a variety of raw materials, modification of the material,and interaction its derivatives with metal ions[J].Chromatographia,2014,59(11/12):783-786. [11]时杰,刘怀平,刘洋洋,等.海南产虾蟹壳制取甲壳素的工艺研究[J].海南师范大学学报(自然科学版),2010,23(3):296-299. [12]窦勇,胡佩红,王芳.淡水小龙虾虾头中甲壳素的EDTA法提取工艺研究[J].农业科技与设备,2014(3):60-63. [13]高玲,刘卫群.生物化学实验教程[M].北京:高等教育出版社,2010:15-17. [14]何兰珍,杨丹,刘毅,等.制备甲壳素过程中EDTA脱钙法的研究[J].食品与生物技术学报,2008,27(4):49-52. [15]卓双文,章汝平,林水东.虾、蟹壳制备甲壳素工艺探讨[J].龙岩学院学报,2009,27(15):61-64. [16]刘卫星.马尾松毛虫蛹壳甲壳素的提取和壳聚糖的制备研究[D].长沙:中南林学院,2005:1-49. [17]李云燕,胡传荣.试验设计与数据处理[M].北京:化学工业出版社,2008.2.6 最佳工艺条件的验证分析
2.7 水浴消解与传统工艺提取甲壳素的结果比较

3 结论

