国内商品化猪圆环病毒2 型疫苗效力检验方法之比较
何天慈, 万建青, 邹兴启, 李 翠, 朱元源, 徐 嫄, 赵启祖
(中国兽医药品监察所, 北京 海淀100081)
由猪圆环病毒(PCV)引起的猪圆环病毒病(PCVD)已成为继猪繁殖与呼吸综合征之后新发现的猪的重要传染病[1],PCVD 成为2010 年国际猪兽医大会最受关注的疫病之一[2]。 目前,十分确定的是猪圆环2 型病毒(PCV2)与断奶仔猪多系统衰弱综合征、皮炎和肾病综合征、仔猪先天性震颤、坏死性增生性肺炎、猪呼吸道综合征、母猪繁殖障碍等多种疾病相关,所以防控PCV2 的感染成为了养猪业的重中之重。 疫苗免疫接种被认为是防控PCVD的有效手段,商品化疫苗的推广应用为有效防控中国PCV2 疫情发挥了重要作用[3]。
1 国内商品化PCV2 疫苗种类及基本情况
PCV2 疫苗于2006 年研制成功,国内A 公司率先推出全病毒灭活苗( SH 株),后来有LG 株、DBN -SX07 株、WH 株、ZJ /C 株疫苗陆续被批准上市[2],截至2017 年8 月23 日,国内商品化PCV2 疫苗已有10种,其中8 种为国产疫苗,2 种为进口疫苗,分别由32家国内企业和两家进口企业生产[4],见表1。
2 国内商品化PCV2 疫苗效力检验方法基本情况
国内商品化PCV2 疫苗众多,据农业部公告(第1448号文件等可知)不同厂家所产疫苗采用的效力检验方法也不相同,如表2,免疫攻毒法经典却耗时耗力,免疫试验法相对缩短了时间,而抗原含量检测法用时更短,成本也大大降低。 但每种方法的具体检测法也不同,这种差异就会影响疫苗质量的判定结果。 下面作者将概述国内商品化PCV2 疫苗的效力检验方法,以进行比较。
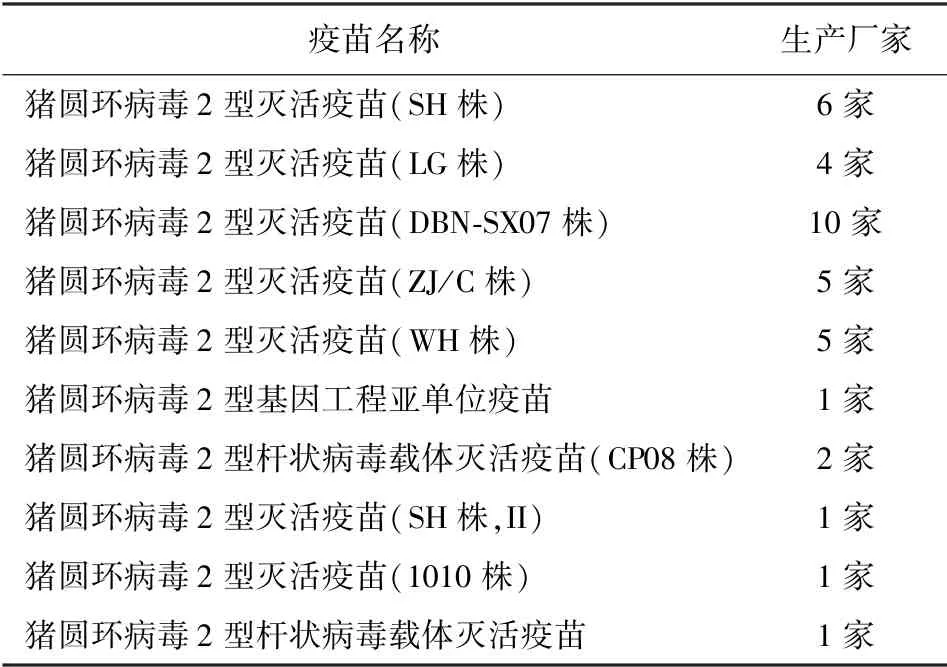
表1 国内商品化猪圆环病毒2 型疫苗及其基本情况
2.1 免疫攻毒检验法 上述10 种疫苗效力检验方法均为二选一,每种疫苗均涉及到了免疫攻毒检验,检测抗原的方法存在较大差异,主要有两处不同。
2.1.1 实验动物的种类及日龄 实验动物有BALB/c 小鼠和阴性仔猪两种。
研究表明,自然条件下,BALB/c 小鼠不会感染PCV2,筛选PCV2 抗原和抗体双阴性的小鼠较容易[5]。 此外,BALB/c 小鼠已被证实可人工感染PCV2,病毒能在体内复制增殖,产生特征性病理变化和临床症状[6]。 董林等[7]以BALB/c 小鼠为动物模型,对疫苗免疫ELISA 抗体水平、攻毒后临床症状、病理变化、PCV2 核酸载量等指标进行了研究,结果表明,不同免疫剂量和免疫途径能显著影响PCV2 特异性抗体水平,攻毒后PCV2 感染小鼠出现了消瘦、腹泻、精神紧张临床症状和淋巴细胞肿大,肺脏、脾脏出血和肾脏水肿等特征性PCVD 病理变化,于攻毒后11 d 出现特征性稽留热,体温升高1 ℃,并持续4 d,疫苗免疫组仅出现低于1 ℃的体温升高,不同组织中PCV2 核酸载量检测结果证明,PCV2 感染有趋淋巴结特性。 但因小鼠自身体重的限制及其生长特性等生理指标与猪可能存在较大不一致性,该数据与以猪为实验动物的相关检测数据存在一定差异性,还需进一步试验数据的支撑。

表2 国内商品化PCV2 疫苗效力检验方法
猪是PCV2 主要易感动物,除了ZJ/C 株灭活疫苗同时涉及小鼠和猪两种实验动物,其余9 种疫苗均以猪作为实验动物。 有专家通过超声影像引导,将PCV2 经腹腔注射到子宫,建立了以宫内感染PCV2 试验猪模型,以此评价PCV2 对母猪繁殖的影响,也有专家观察仔猪与病猪直接接触而感染PCV2 的平均感染时间为18.4 d,建立了PCV2 感染与时间相关的模型[2]。 董信田等[1]在试验中对实验动物攻毒后,攻毒对照猪体重有所降低,免疫猪和空白对照猪平均体重升高,说明PCV2 疫苗能够对猪体产生一定的免疫保护作用,并提出平均日增重是评价PCV2 疫苗对猪体保护程度的一个很重要的指标。 国内有4 种疫苗采用猪免疫攻毒检验法进行效力检验时,将相对日增重纳入了判定标准。
但是,PCV2 疫苗临床接种率逐年上升,2017 年已达98.12%,获得双阴性仔猪的成本较大。 此外,10 种疫苗中有6 种疫苗使用14 ~21 日龄的阴性仔猪,另外4 种疫苗分别采用了14 ~28 日龄、21 ~28日龄、21 ~35 日龄和30 ~40 日龄的阴性仔猪。 日龄不同,其机体免疫系统完善程度不同,免疫应答水平则存在差异[18],进而影响疫苗评估的一致性。
2.1.2 病原检测法 尽管对免疫攻毒动物的组织进行病原检测是圆环疫苗的重要手段,但方法有所不同,在我国已批准的圆环疫苗中,ZJ/C 株和LG 株分别采用了间接免疫荧光法和荧光定量PCR 检测病原,其余8 种疫苗均采用了免疫组化方法检测抗原,SH 株、SH II 株和DBN-SX07 株也进行了体温或相对日增重的测量,WH 株和CP08 株采用PCR 法检测病毒血症,对疫苗的效力检测进行了补充,而1010 株疫苗进行效力检验时不仅运用了免疫组化法检测抗原,还用实时荧光定量PCR 测定了病毒核酸数量,同时进行了液相阻断ELISA 检测抗体和测量相对日增重,从多方面进行评价。
2.1.2.1 间接免疫荧光检测技术(IFA) Allan等[9]曾用IFA 检测组织、细胞培养物中的PCV。 该法操作快捷、简单、成本低,应用较广泛,但该法用于疫苗评估时需应用病毒分离及培养技术,若所用细胞不适宜病毒的生长,病毒滴度则会降低。
2.1.2.2 免疫组织化学技术(IHC) IHC 定位准确、特异性强、操作简单,检测成本低,对试验条件要求不高,是许多实验室首选的检测手段[10]。 唐宁[11]等将PCV2 BF 株经滴鼻接种28 日龄健康仔猪,于接种后不同时间剖杀并采集相关器官组织制备组织切片,用该法检测病毒在猪体内的分布。 但该法仍具有局限性,抗体浓度不当、抗体本身达不到应有的敏感度、标本处理不当或标本抗原含量少,都会造成假阴性[12],而且,该法繁琐、耗时长,所使用的二甲苯具有致畸性和致癌性。
2.1.2.3 聚合酶链式反应(PCR) PCR 敏感性强,常用于筛选抗原阴性动物和检测病料。 Larochelle 等[13]用多重PCR 方法检测1997 -1998 年间的42 份病料发现40 份PCV2 阳性,1 份PCV1 阳性,1 份PCV1 和PCV2 混合感染。 徐朋丽等[14]建立了PCV 2/3 型双重PCR 检测方法,检测176 份病料时发现无PCV 3 单独感染样品,并推测PCV 3 易与PCV 2 混合感染。 但该法不能量化核酸,只要待测样品中含有微量的特定DNA 片段即可检测为阳性,无法判定病毒血症的严重程度。 罗玉均[15]等人成功建立了Taqman 探针荧光定量PCR 方法,为PCV2 的研究提供了先进的检测技术,并提出,对于病毒的含量和疾病发生的相关性研究,以及对PCV2 的监测等研究均可用此法获得准确的定量数据。 但该法只能相对定量,仍需具有丰富经验的人员操作,给生产企业成品疫苗质量控制实施过程造成很大困扰[16]。
2.2 免疫抗体水平检测 上述10 种疫苗中有5 种疫苗采用了免疫试验,猪圆环病毒2 型灭活疫苗(SH 株)和猪圆环病毒2 型灭活疫苗(SH 株,II)采用了小鼠免疫试验,猪圆环病毒2 型灭活疫苗(LG株)、猪圆环病毒2 型灭活疫苗(WH 株)和猪圆环病毒2 型灭活疫苗(DBN-SX07 株)采用了仔猪免疫试验。 5 种疫苗中只有LG 株采用IPMA 法检测抗体水平,另4 种则采用ELISA 法检测。
2.2.1 免疫过氧化物酶单层细胞试验(IPMA) IPMA 具有特异、敏感、操作简单、实用性强等特点。刘长明等[17]建立并优化的IPMA 可用于PCV2 血清抗体检测。 潘晓梅等[18]用其实验室建立的IPMA法与已有的ELISA 法对135 份猪血清进行平行试验,发现IPMA 法检测样品中有73 份呈阳性和62份呈阴性,而ELISA 法检测有87 份呈阳性和48 份呈阴性,采用IPMA 法检测ELISA 阳性样品,其中阴性者有14 份;检测ELISA 阴性样品,其中阳性者有2 份,两种方法检测均为阳性者73 份,均为阴性者46 份,总符合率为88.15%。 该法所用的条件实施较为普遍,结果判定只需在普通显微镜下观察即可,但实际操作者需具有一定的经验,才能保证结果判定的准确性。
2.2.2 酶联免疫吸附试验(ELISA) ELISA 速度快、敏感性强,是检测血清中抗体水平的常用方法之一。 PCV2 疫苗对于猪的有效保护性依赖于主动诱导机体产生体液免疫而获得特异性抗体。 特定的免疫应答在接种后的2 ~3 周形成,机体血清中抗体水平的变化和持续时间的长短及离散性,是反映疫苗免疫效力的重要指标[2],因此,国内PCV2 灭活疫苗效力检测方法大多为ELISA 检测血清抗体水平,而且该类试剂盒已商业化,被广泛运用。 然而,吴华伟等[19]对国内5 个厂家生产的5 种PCV2 抗体检测试剂盒进行了敏感性、特异性和符合率测定,并比较了试剂盒间的符合率,发现5 个PCV2 抗体检测试剂盒特异性检测结果均在90%左右,但敏感性差异较大,且各试剂盒间检测结果的符合率较差,仅为63.2%,总体来看,国产PCV2 抗体检测试剂盒质量参差不齐,仅2 个试剂盒适合用于PCV2抗体检测。
2.3 疫苗抗原含量检测 Cinzia Zanotti 和Massimo Amadori[20]于2015 年利用蔗糖梯度离心和分光光度法原理将猪圆环2 型病毒抗原量化,探索了PCV2抗原含量与紫外吸收峰面积的相关性,建立了一种PCV2 全病毒粒子的检测方法,并建议采用该方法检测猪圆环疫苗的批次一致性。 然而,国内只有4种商品化PCV2 灭活疫苗的效力检验方法涉及到疫苗抗原含量的测定,使用的方法分别为琼脂扩散试验、Cap 蛋白含量测定、夹心ELISA 法和相对效力检验法。
琼脂扩散试验为可溶性抗原与相应抗体在含有电解质的半固体凝胶中进行的一种沉淀试验。朱莹莹[21]等人发现,PCV2 Cap 蛋白原核表达工程菌表达产物中总蛋白含量为0.255 ~0.857 mg/mL区间内,蛋白含量与琼脂双向免疫扩散试验抗原滴度成正相关关系。 该方法操作简单,但结果为肉眼观察,判定标准会因人而异。
Cap 蛋白含量测定是利用BCA 法检测样品总蛋白含量,同时进行SDS-PAGE 蛋白电泳,并分析目的条带在总蛋白中的浓度,代入公式计算Cap 蛋白含量。 该方法计算简便,但对蛋白纯化技术及仪器设备要求较高。
夹心ELISA 法简便、快速、敏感性高,该方法不仅能用于抗原的定性检测,还可进行定量分析,因此具有重要的应用价值。 McNeilly[22]等首先建立的PCV2 抗原捕获ELISA 方法。 翟淑燕[23]建立的夹心ELISA 抗原检测方法采用了“四参数逻辑拟合”免疫检测方式,绘制四参数曲线,其相关系数R 值为0.99,该曲线可比较精确的反映抗原浓度和吸光度的曲线关系,从而准确计算出样品中的PCV2 抗原含量。 杨利等[24]采用重组抗PCV2b 纳米抗体作为捕获抗体,鼠抗PCV2b 单克隆抗体为检测抗体,建立了定量检测PCV2b 的夹心ELISA 方法。 该方法不仅能够用于猪圆环疫苗中PCV2b 抗原的检测,还可用于大肠杆菌或杆状病毒表达的PCV2b 衣壳蛋白(Cap)亚单位疫苗的检测,且与其他猪病毒无交叉反应。
相对效力检验法是以ELISA 原理为基础的疫苗抗原检测方法,但需要参考疫苗做对比,最后计算RP 值。 上述10 种疫苗中,只有猪圆环病毒2 型杆状病毒载体灭活疫苗(CP08 株)和猪圆环病毒2型杆状病毒载体灭活疫苗采用了该方法,该方法既敏感、快捷、简便,也替代了动物实验,用时只有2天,省时省力。
3 总结
国内PCV2 疫苗生产企业和生产量逐年增加[25],PCV2 疫苗临床接种率逐年上升,2017 年已达98.12%,截止2018 年3 月19 日,已签发疫苗再添猪圆环病毒2 型基因工程亚单位疫苗(大肠杆菌源),猪圆环病毒2 型灭活疫苗(YZ 株)也获得了批准文号[4]。 然而,不同生产厂家采用着不同实验室方法来确定PCV2 疫苗的效力,未统一方法和标准。PCV2 疫苗接种后均无繁殖过程,因而必须有足够的抗原量作保证,才能刺激机体产生坚实的免疫力[26],然而,只有4 种采用疫苗抗原含量测定方法来评估疫苗效力,方法和判定标准也不统一。 王晓卉[27]建立了定量检测PCV2 灭活苗参考品的荧光定量PCR 方法,并证明了直接检测疫苗破乳水相中的病毒核酸拷贝数与小鼠免疫试验法具有很好的相关性。 但该方法只能用与全病毒疫苗的测定,不适用于基因工程亚单位疫苗。 Cap 蛋白是猪圆环病毒唯一的结构蛋白,具有免疫原性,因此,可尝试探索一种准确检测疫苗中Cap 蛋白含量的方法,并确定该方法与常规疫苗效力检验方法或靶动物攻毒保护力之间的相关性,那么这种操作简单、方便快捷的方法将可能替代常规疫苗效力检验方法,不再依赖实验动物,避免了实验动物本身的差异对效力检验的影响,这不仅省时省力,降低成本,减少了获得阴性动物的困难,还尊重了动物试验的“3R”理论。

