异育银鲫中鲤疱疹病毒Ⅱ型载量测定方法的建立
李双 ,吴霆 ,2,顾伟 ,孟庆国 ,王文
(1.南京师范大学生命科学学院,江苏省水生甲壳动物病害重点实验室,江苏 南京 210023;2.宝应县水生动物疫病预防控制中心,江苏 宝应 225800)
1 引言
鲫鱼是我国重要的淡水养殖鱼类之一[1],其分布广,肉质鲜美,营养丰富,一直受到我国消费者的青睐,具有重要的经济价值,养殖规模不断扩大,近几年来,鲫鱼呈现出越来越大的养殖潜力。据统计,2012年我国养殖鲫产量已达340多万吨,在我国淡水养殖中占有十分重要的地位[2],而异育银鲫是中国科学院水生生物研究所培育出来的鲫鱼的一个品种[3-4],具有个头大、出肉率及成活率高[5-6]、肉质鲜美、营养丰富等特点,越来越受到广大养殖户的喜爱,其产量持续增长,并带来了巨大的经济效益和社会效益。
然而,大规模病害的爆发阻碍了异育银鲫养殖业的发展,如寄生虫病、细菌性疾病、真菌性疾病、病毒性疾病等。2012年来,异育银鲫养殖区出现了越来越严重的鳃出血性疾病,造成了大规模的死亡,带来了严重的经济损失,经鉴定引起这种疾病的是鲤疱疹病毒Ⅱ型(CyHV-2),引起了广泛研究者的研究兴趣。CyHV-2最早于1992年在日本的金鱼中被发现[7,10],称为“金鱼疱疹病毒性造血器官坏死症”,将该病毒称“金鱼造血器官坏死病毒”(Goldfish haematopoietic necrosis virus,GFHNV)[7,10]。2012年中国江苏出现的CyHV-2是第二个从鲤科鱼中分离出的病毒,国际病毒系统分类与命名委员会命名其为鲤疱疹病毒Ⅱ型(cyprinid herpes virusⅡ,Cy-HV-2)[8-9],因其可造成鲫鱼造血组织器官坏死,所以又称该病毒为“疱疹病毒性造血器官坏死症病毒”,(Herpes viral haematopoietic necrosis virus,HVHNV)[9,25-26]。鲤科鱼疱疹病毒目前分为三个型,分别为鲤痘疮病毒 (Carp pox herpes virus,Cyprinid herpes virus,CyHV-1);鲤疱疹病毒Ⅱ型(CyHV-2)及锦鲤疱疹病毒(Koi herpes virus,Cyprinid herpes virus 3,CyHV-3)。CyHV-2与CyHV-3关系较近,而与CyHV-1关系较远[9-10];CyHV-2核衣壳呈六边形,直径为100~110 nm;CyHV-2病毒具有囊膜,呈椭圆形,直径为 175~200 nm[11-12]。CyHV-2具有高致病性,病死率可达90%~100%,主要感染金鱼,鲫鱼及其变种,不感染鲤鱼和锦鲤。该病发病水温范围为15~32 ℃,流行高峰为20~28℃[13-14]。鱼发病时表现的病症为活动缓慢,不活泼,鳃部和鳍基部有出血点,鱼鳔有出血斑点,尾鳍末端发白等。
目前对该病毒的检测方法主要有普通PCR[15]、巢式 PCR[16]、环介导等温扩增[17-18]、电镜观察[19]、细胞培养分离法[20]等。实时荧光定量PCR技术具有灵敏度高、特异性好、快速准确方便等优点,既能定性检测也能够定量检测,在水生病原微生物的检测中得到了广泛的应用。定量检测异育银鲫体内的CyHV-2有基于TaqMAN探针方法的荧光定量PCR方法的建立,但是没有基于SYBR Green法建立的荧光定量PCR检测方法,且利用荧光定量PCR来研究CyHV-2在鱼体内组织器官分布的报道还是一片空白。基于SYBR Green法简单快捷等特点,本文建立了SYBR Green法实时荧光定量PCR定量方法,并研究了鱼体内各个器官的病毒载量,体现了不同器官CyHV-2的分布情况,为该病毒的免疫学研究提供了数据和奠定了研究基础。
2 材料与方法
2.1 实验鱼和病毒来源
2.1.1 实验健康鱼 试验用健康100尾异育银鲫来自于江苏省宝应县没有发病史的养殖塘口,Cy-HV-2 PCR检测阴性,体质量为280~400 g,养殖在紫外杀菌水控温增氧循环水养殖系统(上海海圣)中,温度控制在26~28℃,在处理前先暂时养殖1周。
2.1.2 病毒来源 CyHV-2病毒由江苏省宝应县具有明显出血病发病症状、且CyHV-2 PCR检测阳性的异育银鲫体内分离得到,病鱼来自江苏宝应县养殖户发病塘口,发病当天将这些垂死新鲜病鱼收集起来用于病毒液的提取。
2.2 生物实验试剂
PBS配方:磷酸缓冲液PBS(pH 7.5)100 mL A液:2.53%NaH2PO4·2H2O 83 mL;B 液:2.52%NaOH 17 mL。
5%chelex-100配方:称取5 g chelex-100固体颗粒放入100 mL ddH2O中,混匀,放于4℃冰箱保存。
Chelex-100、protease K、2 000 DNA Marker、2×EasyTay PCR Super Mix、灭菌双蒸水等均购自南京百斯凯生物公司。SYBR premix Ex TaqⅡ购自Takara公司。RNAfree水购自北京全式金生物公司。
2.3 实验方法
2.3.1 病毒的分离与纯化 用75%酒精消毒病鱼,解剖后取病鱼的肾脏、鳃,放在匀浆器里,然后加5 mL PBS在冰上研磨3~5 min;将研磨液倒入50 mL离心管中放入离心机中4 000 r/min室温离心10 min;将上清液转移至另一支新的50 mL离心管中;在超净工作台中纯化病毒粗提液,先用1 mL PBS润湿0.22 μm滤器,然后病毒粗提液经0.22 μm滤器后过滤至新的50 mL离心管中;将过滤的病毒液分装在1.5 mL的离心管中放4℃保存备用。
2.3.2 病毒回感和病鱼组织的获取 取两支病毒液1 mL,每尾健康鱼进行胸鳍注射100 μL,共回感20尾,之后每天观察鱼的发病特征和有无死亡。取有典型发病症状鱼的肾、鳃、脾、肝、肠、肌肉和卵,用于DNA的提取。
2.3.3 DNA的提取 将获取的组织(0.1~0.5 g)放入1.5 mL离心管中,然后用牙签搅碎成匀浆状;加入200 μL 5%chelex和20 μL蛋白酶K至组织匀浆液,旋涡仪振荡混匀,56℃水浴锅中水浴20 min,用漩涡器振荡混匀后再99℃水浴锅水浴8 min;之后4 ℃,12 000 r/min,离心 4 min,之后取上清,用移液枪轻轻转移到另一新离心管中即为DNA粗提液,标记好后置于-20℃保存备用。
2.3.4 普通PCR检测
2.3.4.1 引物设计 引物设计参考文献设计和合成引物:
CyHVpol-F:5'-CCCAGCAACATGTGC-GACGG-3';
CyHVpol-R:5'-CCGTARTGA-GAGTTGGCGCA-3'。
扩增CyHV-2特异性聚合酶基因362 bp片段。
2.3.4.2 PCR扩增体系 上下游引物1μL,2×Easy-Tay PCR Super Mix 12.5 μL,灭菌双蒸水 10 μl,DNA 模板 0.5 μL,总共 25μL,混匀。
2.3.4.3 PCR扩增程序 PCR反应程序为:94℃预变性 3 min;94℃变性 3 s、56 ℃退火 15 s、72℃延伸10 s,35次循环;72℃延伸10 min;4℃保温。
2.3.4.4 琼脂糖凝胶电泳 取5 μL PCR产物于1.2%的琼脂糖凝胶电泳跑胶,120 V,25 min,并在紫外灯下查看扩增效果,检测有无目的基因片段的扩增。
2.3.5 荧光定量PCR
2.3.5.1 引物设计 利用Primer 5设计引物如下:
CyHV-16-QF:5'-TTACTGGAGGTCGGTGAAGG-3';
CyHV-16-QR:5'-CGTCTGGAAAGCGTGTGACT-3'。
2.3.5.2 实时荧光定量PCR体系 荧光定量PCR体系共 10 μL,上下游引物各 0.4 μL,SYBR Green核酸染料加 5μL,RNA free H2O 3.2 μL,DNA 模板1 μL。
2.3.5.3 实时荧光定量PCR反应程序 预变性:95℃,5 min;扩增 40个循环:95 ℃,10 s,60 ℃,30 s;溶解曲线:95 ℃,15 s,60 ℃,1 min,95 ℃,15 s。
3 实验结果
3.1 普通PCR检测结果
在实验前,为了保证实验顺利进行,在给健康鱼注射病毒前,对用于提取病毒液的4条垂死病鱼的肾组织进行了普通PCR检测,看这些病鱼是否真正的感染上病毒,得到的结果如下图1,可以看到这4条鱼的检测结果中,4条病鱼的肾组织皆为阳性。总之,这些病鱼提取的病毒液可以放心用于人工回感。另外,回感过后也对提取的病毒液进行了PCR检测,结果也呈阳性。
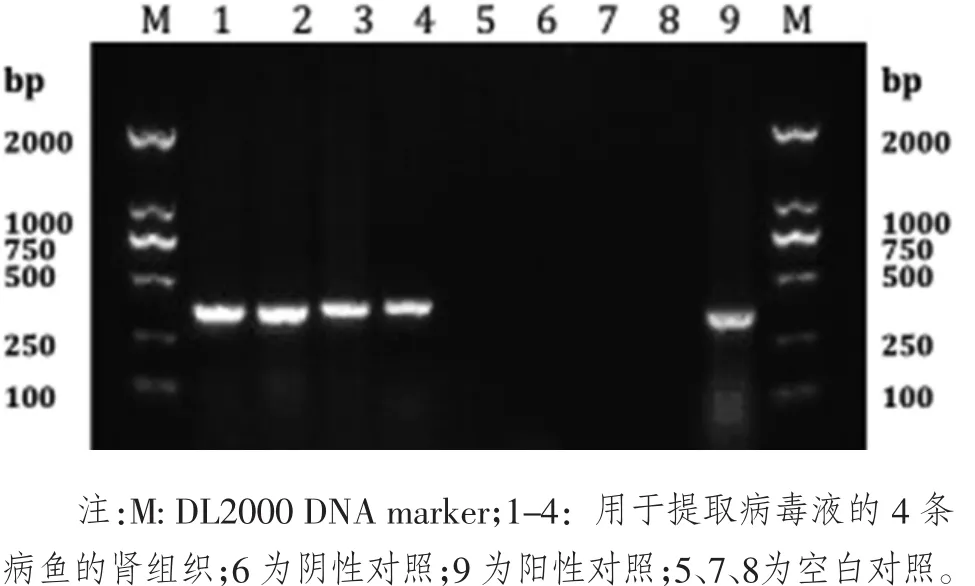
图1用于提取病毒液的病鱼组织PCR结果
3.2 疾病感染症状

图2异育银鲫人工感染鲤疱疹病毒Ⅱ型后的疾病症状和健康鱼的对比(A:感染3d后有明显病症的病鱼;B:健康鱼作为对照)
与正常鱼相比,回感的鱼出现行动缓慢等反应。从第2天开始鱼出现了轻微病症,第3天开始出现死亡,都有明显的病症:鳍基部有出血点、尾鳍末端发白、眼球突出、行动缓慢等,第7天90%回感鱼死亡。
3.3 溶解曲线
在real-time PCR扩增40个循环后,进行了溶解曲线分析,表明该引物的的特异性较强。由得到的溶解曲线可以看出CyHV-2的溶解温度为84.5℃(如图3)。而阴性对照没有扩增信号。
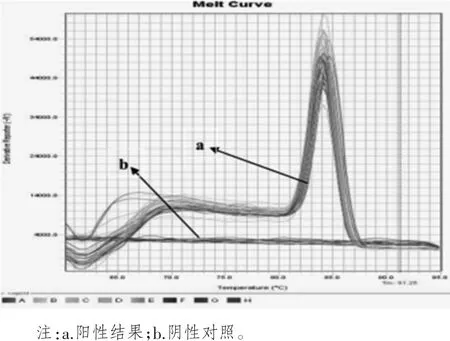
图3 CyHV-2 real-time PCR扩增40个循环后产物的溶解曲线
3.4 荧光定量PCR标准曲线的绘制
将获取的DNA模板测定浓度后,10倍梯度稀释,分别以 6.07×108~6.07×102copies/L 为模板,进行荧光定量PCR检测,检测结果见表1、图4,计算并得出标准曲线:y=-3.6399x+36.941,R2=0.9998。3.5 QRT-PCR检测CyHV-16的组织分布
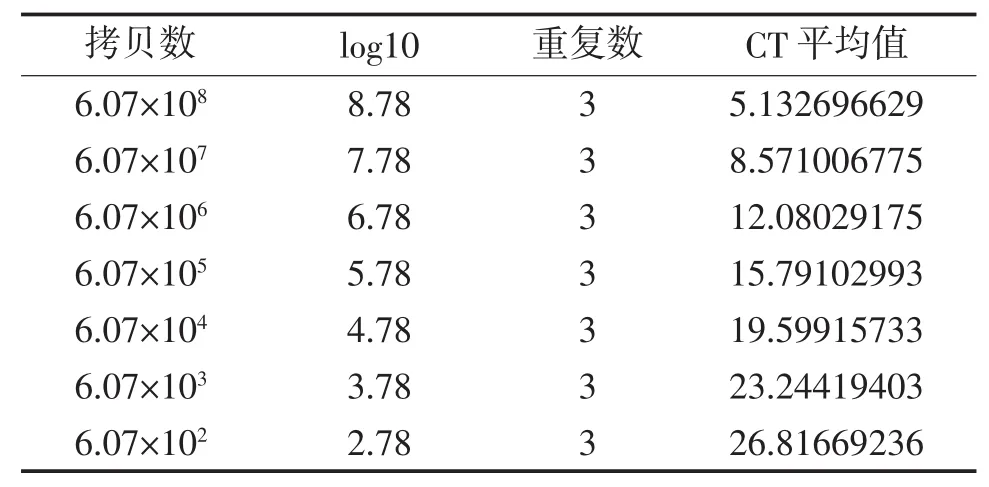
表1荧光定量PCR标准曲线绘制相关数值
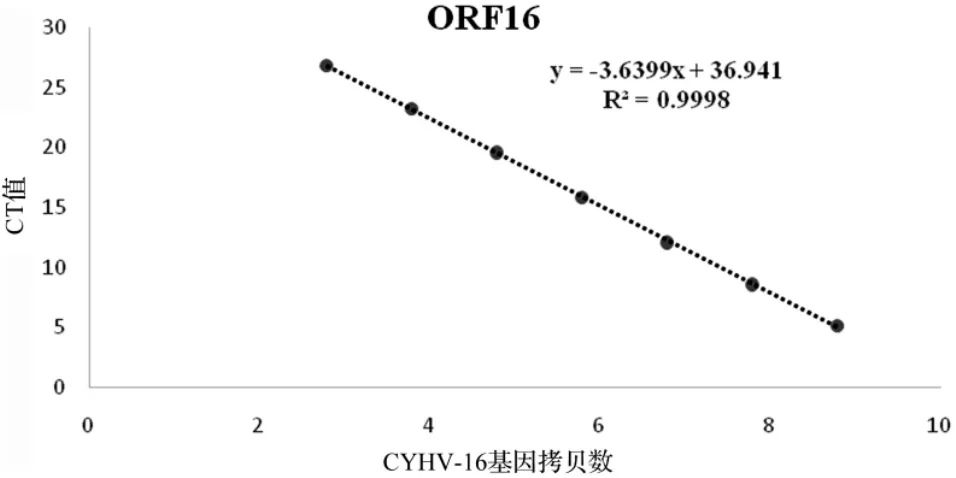
图4荧光定量PCR标准曲线.横坐标为CyHV-16基因拷贝数的对数值;纵坐标为起始扩增的循环数
QRT-PCR检测CyHV-16在发病异育银鲫各个组织的表达分布,图5结果显示CyHV-16几乎分布在被感染的异育银鲫的各个组织和器官,如脾脏、肾脏、鳃、肝脏、肠道和肌肉组织等,但是卵巢中未检测到。其中CyHV-16在脾脏组织中表达量最高,在肾、肝脏和鳃中次之,肌肉组织中表达量较少。
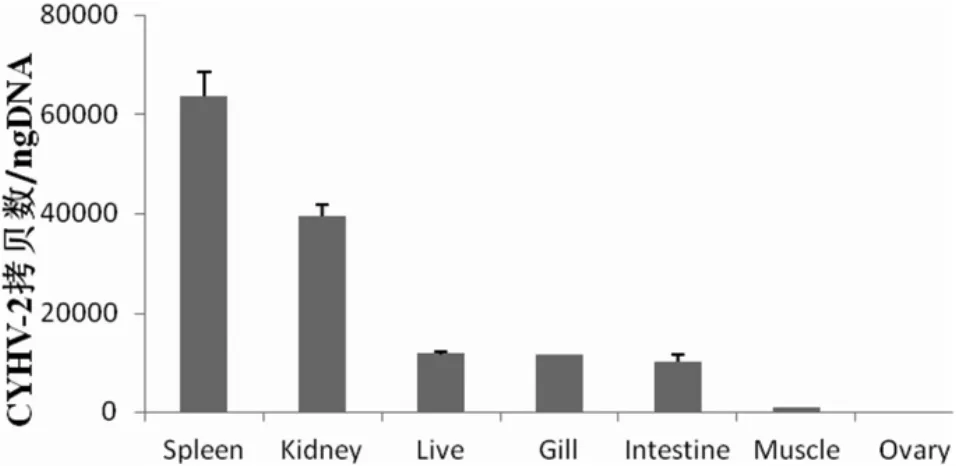
图5 QRT-PCR检测CyHV-16在不同组织中的表达分布差异分析
4 讨论
鲫鱼是我国重要的淡水养殖品种,而异育银鲫因其生长快速,食性杂,易饲养,含肉率高,味道鲜美,营养价值高而广受消费者的青睐,对我国淡水养殖业的发展起着重要的作用,而疾病对其造成了一定的经济损失,因此,对异育银鲫病害的防治对淡水养殖业的越来越好的发展至关重要。CyHV-2是目前危害异育银鲫养殖业最大的病原,可造成100%的病死率,因此,建立一种CyHV-2定量检测技术对于有效预防控制该病毒具有重要的意义。
目前对病毒的检测方法中,应用最为广泛的是PCR检测。Goodwin等基于CyHV-2聚合酶基因建立的PCR方法将取自美国患鲤疱疹病毒Ⅱ型病的金鱼组织中提取的DNA扩增出目的基因片段,且目的基因序列与Waltzek等[11]报道的CyHV-2基因序列也有99%以上的一致性。薛忠仪等[8]建立了一种快速检测CyHV-2的PCR检测方法,该方法运用Chelex-100这一离子螯合剂快速粗提组织DNA[8],该方法提取快速简单,大大缩短了提取时间,仅仅需要1 h内就可完成实验,大大提高了CyHV-2检测的效率。但是该方法只能粗略的检测组织中有无CyHV-2,却无法定量病毒数的多少。于力等[12]人建立的Taqman实时荧光PCR方法,他们依据CyHV-2的主要衣壳蛋白MCP基因,不仅设计了普通PCR引物,还设计了Taqman荧光探针引物,比较繁琐,而且他们对所有病鱼组织混在一块提取DNA,只是对该病毒与其他病原菌做对比,进行特异性和灵敏性验证,并不能看出病鱼各个组织中该病毒的分布情况;周勇等[21]虽然建立了Taqman实时荧光PCR定量CyHV-2的方法,是试验中合成探针引物,过程较复杂,并且没有进一步研究CyHV-2在各组织的分布情况。而本文建立的Realtime PCR方法(SYBR Green法)在快速提取DNA的基础上进行了改良,简单快速,不需要设计合成探针引物等优点,不仅能够定性检测,而且可以定量病毒载量的多少,是一种即快速准确又能定量各个组织内病毒拷贝数的有效的检测方法,在此基础上本文还调查了各组织中该病毒的不同分布。
综上可知,本研究基于Chelex-100快速提取核酸的基础上,建立了快速灵敏高效的Realtime PCR方法(SYBR Green法),可以定量异育银鲫体内Cy-HV-2拷贝数,这对以后研究该病毒的致病机理提供了一定的数据参考,为以后有效地预防和控制该病奠定了基础。
参考文献:
[1]Xue M,Cui Y.Effect of several feeding stimulants on diet preference by juvenile gibel carp(Carassius auratus gibelio),fed diets with or without partial replacement of fish meal by meat and bone meal[J].Aquaculture,2001,198(3):281-292.
[2]刘文枝,曾令兵,张辉,等.异育银鲫感染鲤疱疹病毒Ⅱ型(CyHV-2)后血液生理生化指标变化的研究[J].上海海洋大学学报,2013,22(06):928-935.
[3]桂建芳.异育银鲫养殖新品种——“中科3号”简介[J].科学养鱼,2009(5):21-22.
[4]孙少起,孙少洪,曹续宝.异育银鲫“中科三号”繁育技术[J].天津水产,2011(Z1):39-41.
[5]单娜,林听听,来琦芳,等.4种环境源性胁迫对异育银鲫血浆生化指标的影响[J].海洋渔业,2017,39(2):162-172.
[6]王健,龚山明,陈志刚.异育银鲫“中科3号”与普通异育银鲫生长对比试验[J].科学养鱼,2015(9):21-22.
[7]Jung S J,Miyazaki T.Herpesviral haematopoietic necrosis of goldfish,Carassius auratus(L.)[J].Journal of Fish Diseases,2010,18(3):211-220.
[8]薛中仪,朱春艳,王瑶,等.一种鲤科疱疹病毒Ⅱ型的PCR快速检测方法[J].水产养殖,2015,36(07):45-48.
[9]周勇,范玉顶,徐进,等.鲤疱疹病毒Ⅱ型ORF4基因的克隆、表达与免疫学检测方法[J].淡水渔业,2017,47(1):61-65.
[10]Groff J M,Lapatra S E,Munn R J,et al.A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology[J].Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc,1998,10(4):375-378.
[11]田飞焱,何俊强,王璐,等.金鱼疱疹病毒性造血器官坏死病研究进展[J].中国动物检疫,2012,29(04):78-80.
[12]于力,王津津,史秀杰,等.鲤科疱疹病毒2型Taqman实时荧光PCR方法的建立[J].中国动物检疫,2015(10):80-84.
[13]Xu J,Zeng L,Zhang H,et al.Cyprinid herpesvirus 2 infection emerged in cultured gibel carp,Carassius auratus gibelio in China[J].Veterinary Microbiology,2013,166(1-2):138-144.
[14]刘文枝,曾令兵,张辉,等.异育银鲫感染鲤疱疹病毒Ⅱ型(CyHV-2)后血液生理生化指标变化的研究[J].上海海洋大学学报,2013,22(06):928-935.
[15]李莉娟,罗杨志,刘学芹,等.金鱼鲤疱疹病毒Ⅱ型的分子诊断[J].华中农业大学学报:自然科学版,2013,32(1):92-96.
[16]罗丹,梁利国,谢骏,等.2型鲤疱疹病毒双重PCR快速检测方法的建立及应用[J].中国预防兽医学报,2014,36(05):379-382.
[17]He J,Shi X,Li Y,et al.Development and evaluation of a loop-mediated isothermal amplification assay for diagnosis of Cyprinid herpesvirus 2[J].Journal of Virological Methods,2013,194(1-2):206-210.
[18]Zhang H,Zeng L,Fan Y,et al.A loop-mediated isothermal amplification assay for rapid detection of cyprinid herpesvirus 2 in gibel carp(Carassius auratus gibelio)[J].Scientific World Journal,2014,2014:716413.
[19]Groff J M,Lapatra S E,Munn R J,et al.A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology[J].Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc,1998,10(4):375.
[20]Ma J,Jiang N,Lapatra S E,et al.Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2(CyHV-2)[J].Veterinary Microbiology,2015,177(3–4):315-325.
[21]周勇,曾令兵,张辉,等.鲤疱疹病毒Ⅱ型TaqMan realtime PCR检测方法的建立及应用[J].水产学报,2013,37(04):607-613.
[22]Jeffery K R,Bateman K,Bayley A,et al.Isolation of a cyprinid herpesvirus 2 from goldfish,Carassius auratus(L.),in the UK[J].Journal of Fish Diseases,2007,30(11):649-656.
[23]吴霆,丁正峰,朱春艳,等.异育银鲫鳃出血病流行病学调查和研究[J].水产科学,2014,33(05):283-287.
[24]Waltzek T B,Kurobe T,Goodwin A E,et al.Development of a polymerase chain reaction assay to detect cyprinid herpesvirus 2 in goldfish[J].Journal of Aquatic Animal Health,2009,21(1):60-67.
[25]Jung S J,Miyazaki T.Herpesviral haematopoietic necrosis of goldfish,Carassius auratus(L.)[J].J Fish Dis,1995,18(3):211-220.
[26]徐进,曾令兵,杨德国,等.鲤疱疹病毒2型武汉株的分离与鉴定[J].中国水产科学,2013,20(6):1303-1309.

