基于PHREEQC数值模拟软件的方解石热力学溶蚀机理及控制因素
唐慧雅 李国翔 郭梁锋
(三峡大学水利与环境学院,湖北 宜昌 443002)
0 引言
自工业革命以来,全球增温趋势非常明显,大气CO2浓度平均每年1.5 μatm~1.8 μatm的速度持续增高[1],“固碳减排”成为环境研究重点,碳循环机理探究成为近几年的热点。基于此原因,科学家建立全球碳循环模型[2],发现大气中增加的CO2的量小于由人类各种活动向大气排放的量和海洋吸收的量之差,存在一个“遗失的汇”,科学家经过研究发现其为岩石圈中CO2-H2O-CaCO3系统(岩溶动力系统)对碳的吸收。2014年11月IPCC发布的AR5报告[3]将岩石风化“碳汇”纳入CO2移除的4种方法之一,并发现硅酸盐矿物的风化速度在百年尺度上能够达到地球化学平衡,而碳酸盐矿物的风化速度较硅酸盐矿物快上100倍以上,从溶解速度和经济角度出发,碳酸盐岩“碳汇”具无可比拟的优势[4]。同时在有机物矿化作用参与下,碳酸盐岩“碳汇”量会更大且速率更稳定,“碳储”量时间尺度较其他岩更长。
综上所述,岩溶作用对大气CO2浓度具有重要的调节作用,同时碳酸盐岩“碳汇”无论从时间尺度还是经济考虑都具有无可比拟的优势,而我国又是岩溶发育大国,岩溶面积约362.8万km2,岩溶作用在全国岩溶区产生的大气CO2的汇为1 423万t/年[5],占全球“碳汇”量1/3,方解石是碳酸盐岩尤其是灰岩所含的主要矿物,所以对其溶蚀机理的研究必不可少且非常有实际意义。对碳酸盐溶蚀规律研究,陈履安[6]在1987年即开始,本文在理论研究的同时,结合PHREEQC软件进行数值模拟,进一步说明影响方解石溶蚀速率的内在规律。
1 方解石的溶蚀反应原理
方解石的溶蚀作用发生在CO2-H2O-CaCO3(汽—水—岩)体系中,反应过程为含有游离态CO2的介质溶液与不可溶的方解石CaCO3反应生成可溶性Ca(HCO3)2的过程。在自然状态下,CaCO3和含CO2水溶液发生离子反应,反应方程式如下:

(1)
这个总反应方程式包含了几部分的反应过程,可以分解为以下几个过程:
首先是大气中的CO2溶解到介质溶液中(通常是水溶液),反应生成碳酸:
CO2(g)CO2(aq)
(2)
CO2(aq)+H2OH2CO3(aq)K1=aH2CO3(aq)/PCO2
(3)
而碳酸是弱酸,在水中会发生一、二级电离:
H2CO3(aq)
(4)
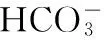
(5)
CaCO3也会在水中发生电离平衡:
CaCO3(s)
(6)
综上,式(1)反应方程式可以写成下述离子反应式:

(7)
当反应达成平衡时有下列平衡常数表达式:
(8)
结合前式得方解石的溶解度S(c)为:
(9)

从式(9)可知,影响方解石溶蚀速率的热力学因素如下:1)温度,温度越高,溶蚀速率增大。2)盐度,盐度越高,离子强度越大,离子活度系数随盐度或者离子强度的增大而增大[7],方解石的热力学溶解度越大。3)CO2分压,平衡体系中CO2分压越大,碳酸电离速度越大,量越多,碳酸盐矿物的溶解度越大。pH=7左右,理论上方解石溶解度是最大的,但是如果调节介质液pH值使得H+离子浓度增大,则对方解石起分解作用,使得方解石热力学溶解度的增加。
PHREEQC软件所自带的数据库是学术界高度仍可且在不断更新完善的,模拟计算所采用的主要离子平衡常数、自由能等热力学常数和吸附交换、动态和平衡化学表达式等取至系统自带的数据库数据,控制研究条件后求解。
2.1 温度对方解石溶蚀速率的影响
考虑到4 ℃以下,水的物理性质发生改变,在模拟计算中,设定温度梯度为5 ℃~70 ℃,反应结束条件为方解石的饱和指数为0,计算结果如图1所示。方解石的溶蚀量随温度增大而增加,同时由曲线斜率可知,温度高于25 ℃后,溶蚀速率有显著增大。

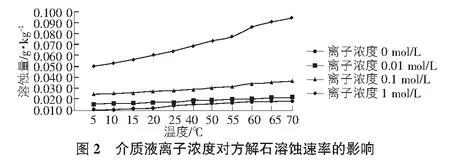
2.2 离子浓度对方解石溶解速率的影响
设定温度梯度为5 ℃~70 ℃,反应介质溶液离子浓度取纯水(0 mol/L),0.01 mol/L,0.1 mol/L,1 mol/L四个不同浓度梯度考虑,反应结束条件为方解石的饱和指数为0,计算结果如图2所示。可以看出,相同离子浓度条件下,温度越高,溶蚀量越大,溶蚀速率越快。这是因为温度越高,离子活性越强,活度越大,溶蚀能力增强,所以溶蚀量增大。而相同温度条件下,离子浓度越大,方解石溶蚀量越大,溶蚀速率越快。当浓度梯度呈倍数级别增长时,离子浓度越大,对方解石溶蚀量影响大大增加。
2.3 二氧化碳分压对方解石溶解速率的影响
取二氧化碳分压条件为10-1,10-0.52,10-0.40,10-0.30,100,温度梯度为5 ℃~70 ℃,反应结束条件为方解石的饱和指数SI为0,结果如图3所示。可以看出,随二氧化碳分压的增大,方解石溶蚀量增大,同时,从模拟曲线斜率可以看出,溶蚀速率亦随之增大。这是因为二氧化碳分压增加,水中溶解的氢离子浓度增加,
反应速率随之增加。而在相同二氧化碳分压条件下,温度升高,方解石到平衡态溶蚀量减少,这是因为温度升高,碳酸分解,分子运动加剧,二氧化碳气体分子溢出,溶解度降低。

3 结语
方解石溶蚀机理及其控制因素讨论是岩溶“碳汇”作用的基础,也是重要的理论依据。通过理论分析和数值模拟结果得出如下结论:方解石的溶蚀量随温度增大而增加,溶蚀速率随温度增大而增大,并且在25 ℃后有显著增大。而离子浓度越大,方解石溶蚀量越大,溶蚀速率越快。当浓度梯度呈倍数级别增长时,离子浓度越大,对方解石溶蚀量影响大大增加。同时温度增高会放大离子浓度对方解石溶蚀量作用。这是因为温度越高,离子活性越强,活度越大,溶蚀能力增强,所以溶蚀量增大。随二氧化碳分压的增大,方解石溶蚀量增大,同时,从模拟曲线斜率可以看出,溶蚀速率亦随之增大。这是因为二氧化碳分压增加,水中溶解的氢离子浓度增加,反应速率随之增加。
参考文献:
[1]PRENTICE I C,FARQUHAR G,FASHAM M,et al.The carbon cycle and atmospheric carbon dioxide[M].2001.
[2]MELNIKOV N B,O'NEILL B C.Learning about the carbon cycle from global budget data[J].Geophysical Research Letters,2006,33(2):356-360.
[3]史一卓.IPCC发布第五次评估报告综合报告[N].2014-11-04.
[4]蒲俊兵,蒋忠诚,袁道先,等.岩石风化碳汇研究进展:基于IPCC第五次气候变化评估报告的分析[J].地球科学进展,2015,30(10):1081-1090.
[5]蒋忠诚,蒋小珍,雷明堂.运用GIS和溶蚀试验数据估算中国岩溶区大气CO2的汇[J].中国岩溶,2000,19(3):212-217.
[6]陈履安.影响岩溶速率的若干问题的讨论[J].贵州地质,1987(4):89-95.
[7]MILLERO F J.The effect of ionic interactions on the oxidation of metals in natural waters[J].Geochimica Et Cosmochimica Acta,1985,49(2):547-550.

