镰形艾美耳球虫感染早期对小鼠的致病性研究
贾妮娜,袁顺子,车丽霞,张丽萍,杨雯,任超
镰形艾美耳球虫感染早期对小鼠的致病性研究
贾妮娜,袁顺子,车丽霞,张丽萍,杨雯,任超通信作者
(天津农学院 动物科学与动物医学学院,天津 300384)
为研究镰形艾美耳球虫感染早期对小鼠的致病性,将镰形艾美耳球虫经口感染小鼠,同时设立无球虫感染空白对照组。通过观察各组小鼠的临床症状,感染36 h后剖检的眼观病变,以及各个脏器的病理组织学观察和盲肠免疫组化观察,来研究感染早期镰形艾美耳球虫对小鼠的致病性。结果表明:早期感染镰形艾美耳球虫主要破坏肠道的黏膜组织,导致黏膜上皮和腺上皮细胞变性、坏死、脱落,黏膜下层水肿,炎性细胞浸润至黏膜层,对其他脏器未造成可见的病理损伤;免疫组化观察,发现早期感染镰形艾美耳球虫也主要侵染黏膜层和黏膜下层。因此,镰形艾美耳球虫仅感染小鼠的盲肠,不感染其他器官,可以作为候选的疫苗载体。
镰形艾美耳球虫;致病性;小鼠;器官指数;免疫组化;病理组织切片
研究发现,艾美耳球虫生物安全性较高,寄生宿主的特异性强,遗传性状稳定,通过人工转染能够表达外源抗原,可持续传代并稳定表达目的抗原,激发局部黏膜免疫和系统性免疫反应[1-2]。鉴于艾美耳球虫具有上述优势,在禽免疫学上已利用柔嫩艾美耳球虫()和缓艾美耳球虫()作为抗原载体,研究外源抗原被有效运送、递呈,进而产生保护性免疫应答的细胞与分子生物学机制[3-5]。感染哺乳动物的球虫,如感染家兔的斯氏艾美耳球虫(),也可以作为抗原载体通过人工转染途径稳定表达外源抗原[6]。目前已发现的鼠球虫有15种,镰形艾美耳球虫()是其中的一种,它主要感染小鼠盲肠和结肠的黏膜组织[7]。镰形艾美耳球虫能够在小鼠体内大量繁殖,未来有望成为一类新型疫苗载体,具有广阔的应用前景。因此,本研究通过建立镰形艾美耳球虫感染小鼠的动物模型,研究感染早期镰形艾美耳球虫对小鼠各个脏器的致病性,以及镰形艾美耳球虫抗原的组织分布,为新型兽用疫苗载体的研究提供新的研究思路。
1 材料与方法
1.1 材料
1.1.1 试验动物
昆明系小鼠60只,购自天津医科大学实验动物中心,9 周龄,体重为(25±2)g,饲料充足,饮水不限,分笼饲养,室温,湿度适宜。
1.1.2 主要试剂
生物素标记的山羊抗鸡IgY二抗购自艾美捷科技有限公司;HRP标记的链霉卵白素复合物购自北京鸿跃创新科技有限公司;DAB辣根过氧化物酶显色试剂盒购自北京雷根生物技术有限公司。
1.1.3 虫株
镰形艾美耳球虫由中国农业大学国家动物寄生原虫实验室赠予,天津农学院基础兽医学实验室保存。
1.2 方法
1.2.1 试验动物分组与处理
将9周龄雌性清洁级昆明小鼠20只分成2组,每组10只,试验组小鼠经口感染镰形艾美耳球虫5×104个/只,对照组灌服等量生理盐水。感染后观察并记录各组小鼠的精神状态、活动情况、皮毛光泽、食欲排泄、死亡等临床症状。
1.2.2 剖检与病理组织学观察
将感染36 h后的小鼠剖检,观察各组小鼠心脏、肝脏、脾脏、肾脏、盲肠的病变情况,计算器官指数(各脏器重量与体重之比)。采集各组小鼠的心脏、肝脏、脾脏、肾脏、盲肠组织,用4%甲醛溶液进行固定,经过7 d的组织固定,将各组小鼠的脏器进行常规病理组织切片制备与HE染色,光镜下观察各脏器的病理变化。“-”表示无病变,“+”表示轻度损伤,“++”表示中度损伤,“+++”表示重度损伤。
1.2.3 免疫组织化学观察
石蜡切片按常规进行脱蜡处理至蒸馏水,之后PBS洗3次,每次5 min;5%双氧水室温避光孵育20 min,去除内源性过氧化物酶,PBS洗3次,每次5 min;山羊血清室温封闭30 min;弃去血清,滴加鸡抗镰形艾美耳球虫全抗原一抗(工作浓度为1∶2 000),37 ℃孵育2 h,PBS洗3次,每次5 min;滴加生物素标记的山羊抗鸡IgY二抗(工作浓度为1∶1 000),37 ℃孵育1 h,之后PBS洗3次,每次5 min;滴加HRP标记的链霉卵白素复合物,37 ℃孵育30 min,之后PBS洗3次,每次5 min;滴加DAB显色液,室温显色10 min;用蒸馏水终止显色;放入苏木素中复染30 s;蒸馏水冲洗后盐酸酒精分色10 s;自来水反蓝5 min;按HE染色步骤进行脱水、透明、中性树胶封片,显微镜下观察。
1.2.4 统计与分析
2 结果与分析
2.1 临床症状观察
在感染镰形艾美耳球虫36 h内,试验组与对照组小鼠的精神、活动、食欲、排泄、皮毛等临床症状均无异常。
2.2 病理剖检观察
感染36 h后剖检观察各组小鼠的心脏、肝脏、脾脏、肾脏,试验组与对照组相比,各脏器的形状、大小与色泽均正常,未见病变情况,且各脏器的器官指数差异不显著(表1)。对盲肠剖检,观察可见试验组黏膜肿胀、有少量出血点,黏膜表面覆盖多量黏液。试验组与对照组相比,小鼠的盲肠指数差异显著(表1)。
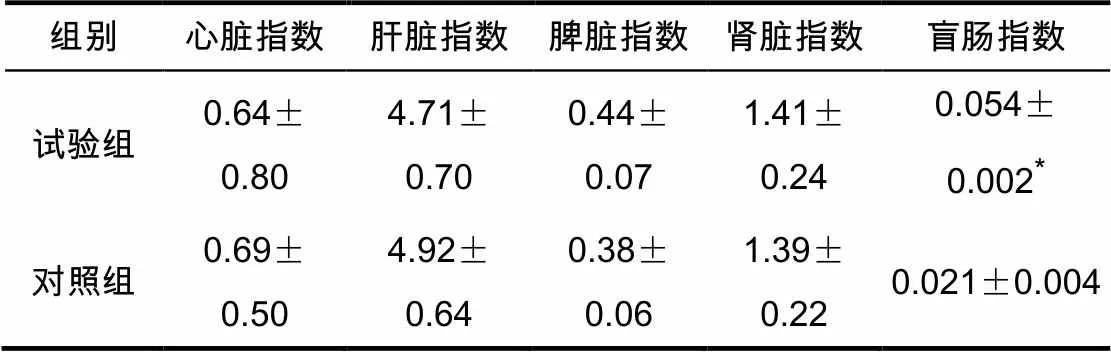
表1 各组小鼠的器官指数 %
注:*表示差异显著(<0.05)
2.3 病理组织学观察
感染36 h后试验组与对照组相比,小鼠的心脏、肝脏、脾脏、肾脏的病理组织学观察未见异常,差异不显著(表2,图1A-H)。

表2 各组小鼠器官病理学检查结果
感染36 h后试验组与对照组相比,试验组小鼠的盲肠黏膜上皮和腺上皮变性、坏死、脱落,大量炎性细胞浸润,黏膜下层水肿、增宽,对照组的病理组织学观察未见异常(表3,图1I-J)。
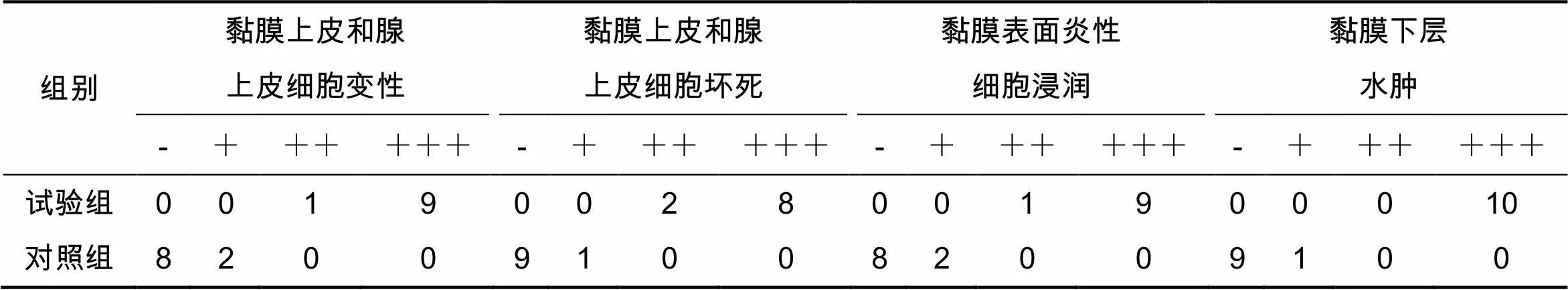
表3 各组小鼠盲肠病理学检查结果
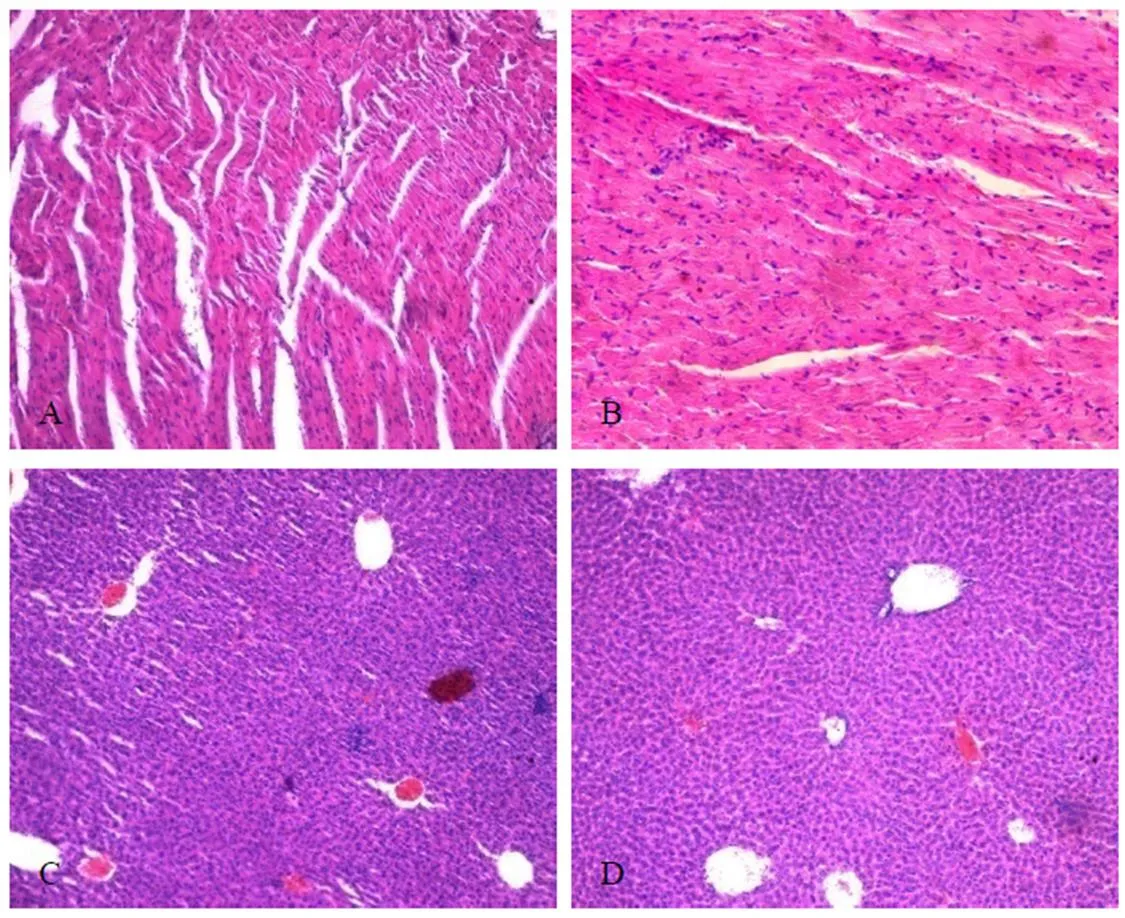
注:A:试验组心脏病理组织切片图(100×);B:对照组心脏病理组织切片图(100×);C:试验组肝脏病理组织切片图(100×);D:对照组肝脏病理组织切片图(100×);E:试验组脾脏病理组织切片图(100×);F:对照组脾脏病理组织切片图(100×);G:试验组肾脏病理组织切片图(100×);H:对照组肾脏病理组织切片图(100×);I:试验组盲肠病理组织切片图(100×);J:对照组盲肠病理组织切片图(100×)
2.4 免疫组织化学观察
感染36 h后试验组与对照组相比,镰形艾美耳球虫阳性区域主要分布在黏膜上皮、固有层、黏膜下层和肠腔中,对照组未见镰形艾美耳球虫阳性区域(图2)。说明镰形艾美耳球虫在早期主要侵染小鼠盲肠的黏膜层和黏膜下层。
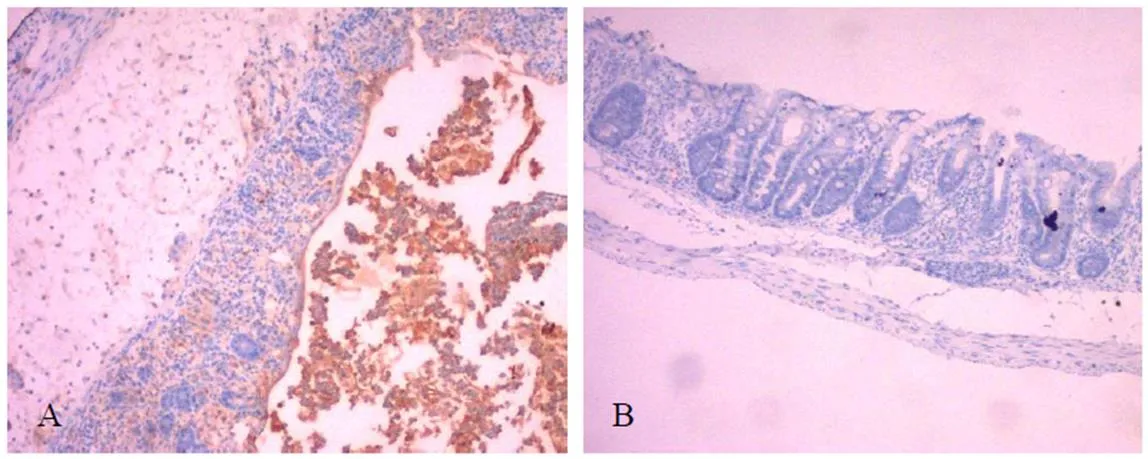
图2 各组盲肠免疫组化图
注:A:试验组盲肠免疫组化图(100×);B:对照组盲肠免疫组化图(100×)
3 讨论
镰形艾美耳球虫隶属于顶复门(Apicomplexa)、孢子虫纲(Sporozoasida)、球虫亚纲(Coccidiasina)、真球虫目(Eucoccidiorida)、艾美耳亚目(Eimeriorina)、艾美耳科(Eimeriidae)、艾美耳属(),潜隐期为7 d,症状明显期10~16 d[7-8]。卵囊经口感染后,先在体内进行无性生殖,感染16 h后,盲肠和结肠的肠腺上皮细胞内含有成熟的第一代裂殖体;感染32 h后,盲肠和结肠的肠腺上皮细胞内有第二代裂殖体[8]。研究发现,感染36 h后,镰形艾美耳球虫的虫体不断进行无性繁殖,对盲肠的肠黏膜造成损伤,导致黏膜上皮和腺上皮细胞变性、坏死、脱落,黏膜下层水肿,炎性细胞浸润至黏膜层(图1I-J)。对于其他器官,没有发现眼观和镜检的可见病理变化(图1A-H)。免疫组化观察,发现镰形艾美耳球虫早期感染也主要侵染盲肠的黏膜层和黏膜下层(图2)。这些都与前人的研究相符合,说明镰形艾美耳球虫早期感染的主要部位是盲肠,造成小鼠肠道黏膜层的严重损伤,其他器官不存在损伤,可以作为候选的疫苗载体进行研究。
艾美耳球虫用作疫苗活载体具有以下几方面优势:第一,相对于病毒和细菌,艾美耳球虫基因组较大,约60 Mb[9],可供外源基因插入的潜在位点较多。Su等利用转座子对柔嫩艾美耳球虫进行转染,获得了稳定转染球虫群体,并且通过genome-walking的方法发现插入位点具有TTAA特征,进一步从基因水平解析球虫作为疫苗载体的价值[10]。第二,艾美耳球虫是真核生物,可以像宿主细胞对表达出的外源蛋白进行化学化修饰,而不影响蛋白的抗原活性。Kurth等对大鼠尼氏球虫()进行了体外瞬时转染和体内稳定转染,并利用柔嫩艾美尔球虫的MIC-1调控序列实现了黄色荧光蛋白和药物筛选基因DHFR在鼠球虫中的转染[11]。第三,球虫活卵囊疫苗已经商品化,能够激发宿主产生良好的群体免疫保护效果(保护率>90%[12])。第四,球虫疫苗可口服接种,简单易行,适用大规模的群体饮水或拌料免疫。第五,球虫的繁殖周期较短,感染属于自限性,在生成卵囊以后即排到体外,不会引起免疫耐受问题,且生物安全性较高,不存在跨种间传播的威胁,田间应用时也不会出现所谓“散毒”的局面。第六,球虫寄生于肠上皮细胞内,不同阶段虫体对肠黏膜上皮细胞反复入侵,能激发宿主产生较强的黏膜免疫和细胞免疫应答,不仅能够激发宿主对球虫表达的外源蛋白产生免疫反应,而且也能使宿主产生针对球虫自身的免疫反应,起到一苗多用的效果[1-4]。此外,艾美耳球虫感染能够激活宿主肠道上调TLR1LA、TLR3、TLR4、TLR5、TLR15、TLR21的表达,并启动 MyD88 信号通路来诱导先天性免疫应答[13-15]。因此,艾美耳球虫作为一种新型的模式生物,具有活疫苗载体的功能,通过改造镰形艾美耳球虫的致病基因,减轻对宿主肠道的损伤,使镰形艾美耳球虫成为一种新型抗原载体,用于进一步研究抗原与宿主免疫细胞之间的相互作用,具有更为广阔的应用前景。
[1] Tang X,Yin G,Qin M,et al. Transgenicas a vaccine vehicle:expressing TgSAG1 elicits protective immunity againstinfections in chickens and mice[J]. Sci Rep,2016,6:29379.
[2] Clark J D,Oakes R D,Redhead K,et al.species parasites as novel vaccine delivery vectors:anti-protective immunity induced by- delivered CjaA[J]. Vaccine,2012,30(16):2683-2688.
[3] Huang X,Zou J,Xu H,et al. Transgenicexpressing enhanced yellow fluorescent protein targeted to different cellular compartments stimulated dichotomic immune responses in chickens[J]. J Immunol,2011,187(7):3595-3602.
[4] Qin M,Tang X,Yin G,et al. Chicken IgY Fc expressed byenhances the immunogenicity of[J].2016,9:164.
[5] Qin M,Liu X Y,Tang X M,et al. Transfection ofwith yellow fluorescent protein as reporter and the endogenous development of the transgenic parasite[J]. PLos One, 2014,9(12):e114188.
[6] Shi T,Tao G,Bao G,et al. Stable transfection ofand investigation of its life cycle,reproduction and immunogenicity[J]. Front Microbiol,2016,7:807.
[7] Schito M L,Barta J R,Chobotar B. Comparison of four murinespecies in immunocompetent and immunodeficient
mice[J]. J Parasitol,1996,82(2):255-262.
[8] Dawn Owen.(Eimer,1870)in specific pathogen free and gnotobiotic mice[J]. Parasitology,1975,71:293-303.
[9] Shirley M W,Ivens A,Gruber A,et al. Thegenome projects:a sequence of events[J].Trends Parasitol,2004,20(5):199-201.
[10] Su H L,Liu X Y,Yan W C,et al.transposon-mediated transgenesis in the apicomplexan parasite[J]. Plos one,2012,7(6):e40075.
[11] Kurth M,Entzeroth R. Reporter gene expression in cell culture stages and oocysts of(Coccidia,Apicomplexa)[J]. Parasitology Research,2009,104(2):303-310.
[12] Suo X,Zhang J X,Li Z G,et al. The efficacy and economic benefits of Supercox,a live anticoccidial vaccine in a commercial trial in broiler chickens in China[J]. Vet Parasitol,2006,142(1/2):63-70.
[13] Zhang L,Liu R,Ma L,et al:expression profiling of toll-like receptors and associated cytokines in the cecum of infected day-old and three-week old SPF chickens[J].Exp Parasitol,2012,130(4):442-448.
[14] Sumners L H,Miska K B,Jenkins M C,et al. Expression of toll-like receptors and antimicrobial peptides duringinfection in chickens[J]. Exp Parasitol,2011,127(3):714-718.
[15] Zhou Z,Wang Z,Cao L,et al. Upregulation of chicken TLR4,TLR15 and MyD88 in heterophils and monocyte- derived macrophages stimulated within vitro[J]. Exp Parasitol,2013,133(4):427-433.
责任编辑:宗淑萍
On the pathogenicity of early infection ofin mice
JIA Ni-na, YUAN Shun-zi, CHE Li-xia, ZHANG Li-ping, YANG Wen, REN ChaoCorresponding Author
(College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China)
In order to study the pathogenicity of early infection ofin mice,was invading by oral infection in the treatment group, while the control group was established with non-coccidia infection. Then the clinical symptoms, autopsy lesions, organ index, organ pathological histology and immunohistochemical characterization of cecum were observed for 36 hours to learn about the pathogenicity of early infection ofin mice. The results showed that in the early stage of infection,maily damaged mucosal tissues of intestinal tract which caused degeneration, necrosis and shedding of epithelial and glandular epithelial cells, edema in strata submucosum, inflammatory cells infiltrating the mucosa but no visible pathological damage to other organs. According to immunohis chemical observation, the infections of mucosa and submucosa in the early stage were also observed. Hence,will be a candidate vaccine vector, which did not damage all the organs except cecum.
; pathogenicity; mice; organ index; immunohistochemistry; histopathological sections
S852.72+3
A
1008-5394(2018)01-0054-05
10.19640/j.cnki.jtau.2018.01.012
2017-04-25
大学生创新创业训练计划项目(201610061008,201710061045);天津农学院高校教师教育改革创新引导发展项目(20171003);国家自然科学基金重点项目(31330076)
贾妮娜(1996-),女,本科在读,研究方向为基础兽医学。E-mail:820369011@qq.com。
任超(1986-),女,实验师,硕士,研究方向为基础兽医学。E-mail:chaoren04050110@163.com。

