短梗霉筛选鉴定及溶氧对其发酵的影响
刘 滨,于海峰
(1.齐鲁工业大学食品科学与工程学院,山东济南 250353;2.中国科学院过程工程研究所生化工程国家重点实验室,北京100190)
短梗霉(Aureobasidiumspp.)是一种形态特征受环境影响显著的生活史复杂的腐生真菌。其分布范围非常广泛,通常分布于土壤、植物、木材、混凝土、墙壁的表面[1]。在盐碱地[2]、沿海水域、南极洲水域的海洋沉积物[3]及红树林沼泽[4]中也都发现有短梗霉的存在。短梗霉归属于半知菌门(Deuteromycotina)、丛梗孢目(Moniliates)、短梗霉菌属(Aureodacidium)。短梗霉属被划分为三个种:出芽短梗霉(A.pullulans)、A.leucospermi和A.proteae。
短梗霉的发酵产物主要有聚苹果酸[5](Poly malic acid,PMLA)及苹果酸[67]、普鲁兰多糖[89]、黑色素[10]、重油[1112]等。其中,聚苹果酸是以苹果酸为唯一单体聚合而成的新型生物可降解聚酯型聚合物[13],可作为新型药物载体与微胶囊材料、生物医学材料、食品包装材料等,其单体物苹果酸酸味清爽持久,作为酸味剂和风味增强剂广泛应用于高档饮料、调味品、糖果等食品中;在食品保藏方面,苹果酸还具有抗菌性及保鲜性,常用于果蔬及其制品的保鲜防腐,延长食品的贮存期与货架期;此外,苹果酸在生物炼制工程中是重要的四碳化合物[14]。
目前文献中大多以出芽短梗霉(A.pullulans)作为研究对象,对于短梗霉属中的其他种报道较少,因此,为扩大短梗霉属研究范围及为短梗霉合成聚苹果酸的代谢提供新菌种,本文通过分离筛选获得两株短梗霉菌株,其中ipe3为以聚苹果酸为主要发酵产物的出芽短梗霉,ipe5为以苹果酸为主要发酵产物的短梗霉,ipe5发酵产生苹果酸具有时间短,生产效率高的特点。文献中关于短梗霉发酵产酸的条件大都采用温度25 ℃、pH6.0条件。但发酵过程中对溶氧的控制存在较大的差异,从10%到90%不等[1517]。Cao[18]等、Xia等[19]均报道了出芽短梗霉(A.pullulans)在70%溶氧条件下聚苹果酸产量达到最大值。由此为依据,本文对比短梗霉在高溶氧(70%)与低溶氧(10%)条件下聚苹果酸及苹果酸产量的差别,以期为短梗霉溶氧调控发酵提供参考。
1 材料与方法
1.1 材料与仪器
筛菌样品 实验所用的样本取自中科院过程所周边的新鲜树叶、落叶、土壤及腐殖叶;马铃薯 购自北京超市发连锁股份有限公司;苹果酸标准品 纯度>99%,美国SigmaAldrich公司;琼脂 分析纯,北京化学试剂公司;胰蛋白胨 分析纯,Oxoid公司;亚甲基蓝 分析纯,天津市津科精细化工研究所;葡萄糖、甘露醇、硝酸钠、磷酸二氢钾、七水硫酸镁、柠檬酸、氯化钾、碳酸钙 均为分析纯,西陇科学股份有限公司;硫酸 分析纯,北京化工厂。
真菌基因组提取试剂盒、PCR胶回收试剂盒 北京三博远志生物技术有限公司;高速冷冻离心机 德国sigma公司;生物传感分析仪SBA40C 山东省科学院生物研究所;高效液相色谱仪(High Performance Liquid Chromatography,HPLC)LC20A 日本岛津公司;色谱柱Aminex®HPX87H 美国BioRad公司;发酵罐BioFio®110 美国NBS公司;Perkin Elmer GeneAmp 9600 PCR仪 ABI公司;ABI 3730核酸分析仪 ABI公司;电泳仪 北京市六一仪器厂;LDZX75KBS蒸汽式灭菌锅 上海申安医疗器械厂;FA2004电子天平 梅特勒托利多仪器有限公司。
1.2 实验方法
1.2.1 培养基的制备 富集培养基:甘露醇10%,NaNO30.1%,KH2PO40.05%,MgSO4·7H2O 0.02%,柠檬酸0.2%。
筛选培养基:葡萄糖12%,NaNO30.1%,KH2PO40.01%,KCl 0.05%,MgSO4·7H2O 0.02%,琼脂1.5%,亚甲基蓝0.002%。
保藏培养基(葡萄糖马铃薯培养基):马铃薯20%,葡萄糖2%,琼脂2%。
摇瓶种子培养基:葡萄糖8%,NaNO30.2%,KH2PO40.01%,MgSO4·7H2O 0.02%,KCl 0.05%,胰蛋白胨0.1%,121 ℃灭菌20 min。
发酵培养基:葡萄糖15%,NaNO30.2%,KH2PO40.01%,MgSO4·7H2O 0.02%,KCl 0.05%,胰蛋白胨1.5%。胰蛋白胨与其他成分分开灭菌,接种前再混在一起。摇瓶发酵培养基中加3% CaCO3。
1.2.2 菌株的筛选
1.2.2.1 富集 称取10 g样本置于富集培养基中进行富集培养,培养条件:25 ℃,120 r/min,培养48 h[20]。
1.2.2.2 初筛 用微量移液枪吸取100 μL富集培养液,梯度稀释6倍后,涂布于含有亚甲基蓝的筛选培养基上,25 ℃恒温培养箱中倒置培养4 d,选取菌落周围有透明圈,菌落呈黑色的菌株进行划线培养分离纯化。
1.2.2.3 复筛 挑取一环菌株接种于100 mL种子培养基中,25 ℃、120 r/min振荡培养2 d。待种子液培养完成后,按10%接种量接入发酵培养基中25 ℃、120 r/min振荡培养4 d(与上罐发酵时间一致),发酵结束后检测发酵液中聚苹果酸含量。
1.2.3 斜面种子培养方法 取一环经复筛后确定产生聚苹果酸的纯化菌株,划线于已灭菌的保藏培养基斜面上,25 ℃培养5 d至斜面均匀布满菌体,收集后保藏于4 ℃冰箱。
1.2.4 摇瓶种子培养方法 用接种环均匀挑取大小一致的斜面种子接种于100 mL种子培养基中,25 ℃,120 r/min振荡培养2 d。每次实验摇瓶种子做四个平行,上发酵罐前选取两瓶种子液充分混合,接入发酵罐后测定发酵初始(0 h)菌体浓度,保证初始菌体浓度为0.5 g/L。
1.2.5 2.7 L发酵培养方法 将200 mL摇瓶种子转接于121 ℃灭菌20 min的2.7 L发酵罐内,发酵培养基装液量1.8 L,发酵过程中维持pH恒定为6.0,发酵温度25 ℃,初始通气量3 L/min,发酵过程中维持溶氧恒定为70%和10%。
溶氧电极的校正[18]:101.325 kPa,25 ℃下,将在饱和亚硫酸钠溶液中稳定值标定为DO电极的零点(DO 0%);接种前,当培养基温度为25 ℃,pH为6.0时,将通气量调整为5,转速1000 r/min时标定为培养基中的最大DO 100%。在发酵过程中,溶氧的测定值为在标定零点和饱和浓度的相对值。
1.2.6 菌种鉴定 用真菌基因组提取试剂盒提取基因组,选取ITS1:TCCGTAGGTGAACCTGC GG ITS4:TCCTCCGCTTATTGATATGC为通用引物,进行18S rDNA的PCR扩增。
35 μL反应体系:DNA模板2 μL,10 μmol/L ITS1 1 μL,10 μmol/L ITS4 1 μL,Taq 0.5 μL,10×buffer 3.5 μL,dd H2O 26.3 μL,空白对照不加入DNA模板。
PCR扩增条件:95 ℃预变性2 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min。用1.5%琼脂糖凝胶电泳分离PCR产物,用PCR胶回收试剂盒纯化,纯化产物经北京三博远志生物技术有限公司测序。测序结果在GenBank中进行比对,选取近似菌种序列,用MEGA6软件构建系统发育树。
1.2.7 菌体浓度的测定 发酵过程中每隔12 h取样,6 mL发酵液在10000 r/min下离心10 min,上清液用于其他成分的测定,沉淀物分别用6 mL超纯水洗涤三次,90 ℃下烘干至恒重,称量计算菌体浓度。
1.2.8 苹果酸及聚苹果酸浓度的测定 苹果酸浓度采用HPLC分析,聚苹果酸浓度由水解液和上清液中苹果酸浓度差值获得。聚苹果酸水解方法[15]:分别取1 mL上清液与1 mL 2 mol/L硫酸放入水解反应釜中,在90 ℃下反应12 h,反应结束后用2 mL,2 mol/L氢氧化钠中和反应液,用HPLC测定苹果酸的含量[21],色谱柱为Aminex®HPX87H,流动相:2.5 mmol/L H2SO4,流速0.6 mL/min,柱温50 ℃。流动相减去未水解上清液中苹果酸的含量即为聚苹果酸的含量。
1.2.9 残糖浓度的测定 用安装有葡萄糖氧化酶膜的SBA40C生物传感仪测定葡萄糖浓度。取经离心后的上清液,将上清液稀释200倍,测定时首先注射25 μL标准液进行标定,标定结束后用取样针吸取25 μL待测液进行测定。
1.2.10 发酵性能计算
1.2.10.1 菌体浓度

式(1)
式(1)中:X2指菌体和离心管重量(mg);X1指空离心管重量(mg)。
1.2.10.2 糖酸转化率
式(2)
式(2)中,Px指糖酸转化率(g/g),X2指发酵某一时间点时酸浓度(g/L),X1指发酵初始时酸浓度(g/L),G1指发酵初始时培养基中葡萄糖浓度(g/L),G2指发酵某一时间点时培养基中葡萄糖浓度(g/L)。
1.2.10.3 菌体得率
式(3)
式(3)中,Py指菌体得率(g/g),X2指发酵某一时间点时酸浓度(g/L),X1指发酵初始时酸浓度(g/L),B2指发酵某一时间点时菌体浓度(g/L),B1指发酵初始时菌体浓度(g/L)。
1.2.10.4 生产强度
式(4)
式(4)中,PZ指生产强度[g/(L·h)],X2指发酵某一时间点时酸浓度(g/L),X1指发酵初始时酸浓度(g/L),t指发酵时间(h)。
1.2.10.5 葡萄糖消耗速率
式(5)
式(5)中,Pn指葡萄糖消耗速率[g/(L·h)],X1指发酵初始时培养基中葡萄糖浓度(g/L),X2指发酵某一时间点时培养基中葡萄糖浓度(g/L),t指发酵时间(h)。
1.3 数据分析
采用Origin 2017软件作图,MEG6软件构建分子进化树。
2 结果与分析
2.1 菌株筛选
从新鲜树叶、落叶、土壤、腐殖叶的样本中经富集培养基富集培养后,在亚甲基蓝(Methylene Blue,MB)筛选培养基上呈现有透明圈的菌落共计18株,选取出现透明圈的菌株进行划线分离。将经过划线分离获得单菌落的菌株进行摇瓶复筛,发现能够合成聚苹果酸的菌株共有两种,并将其分别命名为ipe3、ipe5。

图1 亚甲基蓝培养基初步筛选菌落Fig.1 Primary screening of fungus by MB medium
2.2 分子生物学鉴定
2.2.1 菌株ipe3 18s rDNA基因序列 测序结果如下:

2.2.2 菌株ipe5 18s rDNA基因序列 测序结果如下:

将ipe5的18srDNA序列进行BLAST比对,发现该菌株仅能鉴定到短梗霉属,与Aureobasidiumiranianum、Aureobasidiumpullulans、Aureobasidiummelanogenum等同源性有 96%。将ipe5的ITS序列提交到GenBank得到登录号为KY621468。
2.3 基于18S rDNA序列分析的系统发育树的构建
用MEGA 6构建分子进化树,采用Neighbor-Joining法的Complete Deletion模式建树,用Bootstrap进行检验,并重复1000次构建系统发育树,见图2。
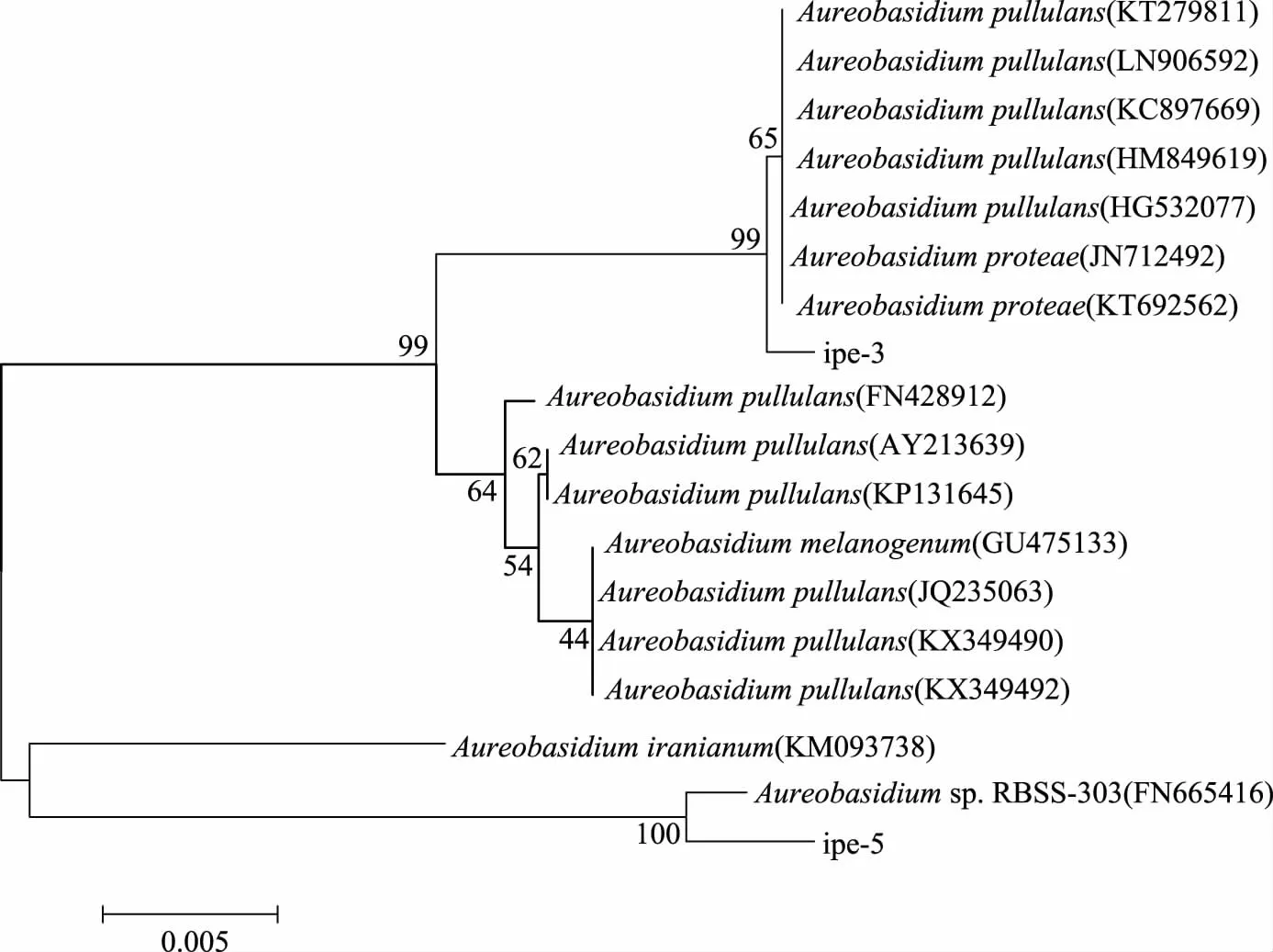
图2 ipe3、ipe5系统进化树Fig.2 The tree of phylogenetic evolution of ipe3,ipe5
2.4 ipe3、ipe5发酵性能测定
2.4.1 ipe3、ipe5 70%溶氧发酵 ipe3发酵性能曲线如图3a及3c所示,在整个发酵周期内碳源充足,菌体生长没有明显的稳定期,发酵初始葡萄糖浓度为167 g/L,发酵结束时,培养基中葡萄糖剩余量为18.75 g/L,葡萄糖消耗速率为1.54 g/(L·h),菌体浓度为46.57 g/L。发酵产物聚苹果酸,其产量、糖酸转化率、菌体得率、生产强度分别为10.027 g/L、0.0681 g/g、0.2223 g/g、0.104 g/(L·h)。发酵产物苹果酸,其产量、糖酸转化率、菌体得率、生产强度分别为5.7 g/L、0.038 g/g、0.13 g/g、0.06 g/(L·h)。Manitchotpisit等[22]从泰国和冰岛地区分离筛选出芽短梗霉,结果发现聚苹果酸的最低产量为4 g/L,最高产量为11 g/L。Ma等[23]从红树林沼泽中分离出一株高产聚苹果酸的短梗霉菌株Aureobasidium sp. P6,该菌株最高可产118.3 g/L的Ca2+PMLA,本文分离得到的出芽短梗霉ipe3聚苹果酸产量为10.027 g/L,属于聚苹果酸低产菌,这为聚苹果酸合成代谢途径的研究提供了菌种。
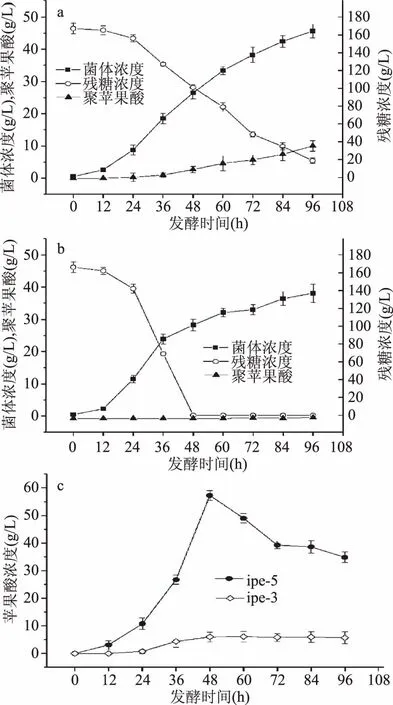
图3 ipe3(a)、ipe5(b)70%溶氧下发酵性能及苹果酸含量(c)Fig.3 Fermentation properties of ipe3(a),ipe5(b)and the malic acid content(c)under 70% dissolved oxygen
ipe5的生长曲线如图3b及3c所示,在整个发酵周期内,菌体生长没有明显的稳定期,发酵初始葡萄糖浓度为166 g/L,在发酵48 h时培养基中葡萄糖已消耗完全,葡萄糖消耗速率为3.46 g/(L·h),培养基中苹果酸产量达到最大值为57.24 g/L,苹果酸糖酸转化率、菌体得率、生产强度分别为0.3447 g/g、2.14 g/g、1.19 g/(L·h)。48 h之后发酵产物苹果酸浓度降低,这是因为L苹果酸会直接进入TCA循环,作为能源物质和碳源,用于菌体生长及代谢合成。发酵结束时,ipe5聚苹果酸产量为0.3 g/L,苹果酸产量为34.86 g/L。
生物法合成苹果酸主要有三种方式:第一种方式是通过一步发酵法直接利用葡萄糖发酵合成苹果酸,此方法苹果酸的生产菌大多是曲霉菌属[24](Aspergillus)、青霉菌属[14](Penicillium)、结合酵母属[24](Zygosaccharomyces)、酿酒酵母[25](Saccharomycescerevisiae)或者以大肠杆菌、酵母菌、枯草芽孢杆菌等微生物应用代谢工程技术构建产生苹果酸的基因工程菌[26]。第二种方式是利用延胡索酸酶将延胡索酸转化为苹果酸,此方法应用了细胞固定化技术,将能够产生延胡索酸酶的菌如酿酒酵母[27](Saccharomycescerevisiae)、贝酵母[28](Saccharomycesbayanus)等。第三种方式是微生物合成聚苹果酸,通过将短梗霉的发酵产物聚苹果酸水解获得单体苹果酸。Zhang等[15]分离筛选得到一株高产聚苹果酸出芽短梗霉菌株ZD3d,经10 L发酵罐发酵后获得57.2 g/L聚苹果酸,生产强度为0.35 g/(L·h)。Zou等[29]分离筛选获得一株出芽短梗霉ZX10菌株,经10 L发酵罐发酵获得41.2 g/L聚苹果酸并经水解后获得47.3 g/L苹果酸,苹果酸生产强度为0.49 g/(L·h)。本文发现的短梗霉 ipe5是能够通过一步发酵法直接合成苹果酸的短梗霉菌株,且具有发酵时间短,生产强度高的特点,生产强度可达1.19 g/(L·h)。由于苹果酸是聚苹果酸合成的前体物质,目前有关短梗霉合成与分泌聚苹果酸的机制尚未完成清楚,高产苹果酸低产聚苹果酸菌株ipe5的发现,为探究短梗霉由苹果酸合成聚苹果酸的关键途径提供了菌种支持。
2.4.2 ipe3、ipe5 10%溶氧发酵 ipe3在10%溶氧条件下发酵性能如图4a及4c所示,通过与70%溶氧条件下发酵性能对比可以发现,10%溶氧条件下菌体浓度为41.34 g/L,较70%溶氧条件降低了11.23%。10%溶氧条件下发酵培养基中初始葡萄糖浓度为165.5 g/L,发酵结束时葡萄糖剩余量为70.25 g/L,葡萄糖消耗速率为0.99 g/(L·h),较70%溶氧条件下葡萄糖消耗速率降低了35.71%。10%溶氧条件下聚苹果酸产量、糖酸转化率、菌体得率、生产强度分别为5.85 g/L、0.0614 g/g、0.1319 g/g、0.061 g/(L·h),较70%溶氧条件分别降低了41.66%、9.84%、40.67%、41.35%。10%溶氧条件下苹果酸产量、糖酸转化率、菌体得率、生产强度分别为2.13 g/L、0.22 g/g、0.052 g/g、0.022 g/(L·h),较70%溶氧条件下分别降低了62.63%、42.11%、56.67%、62.71%。
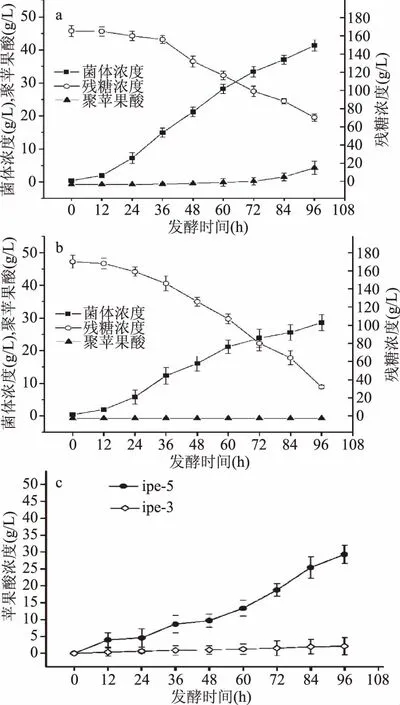
图4 ipe3(a)、ipe5(b)10%溶氧下发酵性能及苹果酸含量(c)Fig.4 Fermentation properties of ipe3(a),ipe5(b)and the malic acid content(c)under 10% dissolved oxygen
ipe5在10%溶氧条件下发酵性能如图4b及4c所示,通过与70%溶氧条件下发酵性能对比可以发现,发酵48 h时,10%溶氧条件下菌体浓度为16.08 g/L,较70%溶氧条件降低了43.06%;葡萄糖浓度从最初的166 g/L下降至126 g/L,葡萄糖消耗速率为0.83 g/(L·h),较70%溶氧条件葡萄糖消耗速率降低了76.01%;其苹果酸产量、糖酸转化率、菌体得率、生产强度分别为9.7 g/L、0.2205 g/g、0.6194 g/g、0.2021 g/(L·h),较70%溶氧条件分别降低了83.05%、36.03%、71.06%、83.02%。发酵结束时,10%溶氧条件下苹果酸产量为29.30 g/L,较70%溶氧条件降低了15.95%,ipe5在10%溶氧条件下不积累聚苹果酸。
由以上结果可以看出ipe3与ipe5在10%溶氧条件下聚苹果酸及苹果酸的产量及各种发酵指标较70%溶氧条件下的产量及发酵指标均出现降低的趋势。因此可以说明低溶氧发酵条件抑制短梗霉发酵产酸。此趋势与Xia等[19]关于溶氧对A.pullulansZD3d聚苹果酸产量的影响表现出相同的现象。这可能是由于溶氧降低导致生物体能量代谢降低,葡萄糖利用速率降低,进而影响生物体生长和代谢产物的积累[30]。ATP在细胞内是重要的能量物质,为细胞的合成代谢提供了驱动力,在有氧发酵过程中,溶氧水平将直接影响来源于呼吸链反应中产生的ATP含量,在合适的溶氧水平下细胞内ATP的产生与消耗趋于平衡[31]。由于出芽短梗霉发酵的最佳溶氧水平为70%[18],因此低于此溶氧水平,细胞代谢速率降低,葡萄糖消耗速率降低,进而影响胞内整体ATP水平的供应,在ATP供应不足的情况下,短梗霉合成苹果酸及聚苹果酸的速率下降。
3 结论
从自然界中分离筛选获得2株短梗霉菌株,经初筛、复筛、分子生物学鉴定,确定为出芽短梗霉和短梗霉。
利用2.7 L发酵罐对两株野生菌进行发酵性能测定,发现在高溶氧条件(70%)下,ipe3聚苹果酸及苹果酸产量分别为10.027 g/L、5.7 g/L;ipe5聚苹果酸产量为0.3 g/L,苹果酸产量最高为57.24 g/L。低溶氧条件(10%)下,ipe3聚苹果酸及苹果酸产量分别为5.85 g/L、2.13 g/L,较70%溶氧条件下聚苹果酸及苹果酸产量分别降低了41.66%、62.63%;ipe5发酵48 h苹果酸产量为9.7 g/L,较70%溶氧条件下苹果酸产量降低了83.05%,发酵结束时苹果酸产量为29.30 g/L,较70%溶氧条件下苹果酸产量降低了15.95%。因此ipe5为能够通过一步发酵法直接大量合成苹果酸的短梗霉菌株,且具有发酵时间短,生产强度高的特点,生产强度可达1.19 g/(L·h),而低溶氧发酵(10%)造成短梗霉酸产量降低,生产强度下降。
[1]Manitchotpisit P,Leathers T D,Peterson S W,et al. Multilocus phylogenetic analyses,pullulan production and xylanase activity of tropical isolates ofAureobasidiumpullulans[J]. Mycological Research,2009,113(10):11071120.
[2]GundeCimerman N,Zalar P,Hoog S D,et al. Hypersaline waters in salternsnatural ecological niches for halophilic black yeasts[J]. Fems Microbiology Ecology,2000,32(3):235240.
[3]Zhang X,Hua M,Song C,et al. Occurrence and diversity of marine yeasts in Antarctica environments[J]. Journal of Ocean University of China,2012,11(1):7074.
[4]Chi Z M,Liu T T,Chi Z,et al. Occurrence and diversity of yeasts in the mangrove ecosystems in fujian,Guangdong and Hainan provinces of China[J]. Indian Journal of Microbiology,2012,52(3):346353.
[5]Liu S J,Steinbüchel A. Production of poly(malic acid)from different carbon sources and its regulation inAureobasidiumpullulans[J]. Biotechnology Letters,1997,19(1):1114.
[6]Zou X,Yang J,Tian X,et al. Production of polymalic acid and malic acid from xylose and corncob hydrolysate by a novelAureobasidiumpullulansYJ 611 strain[J]. Process Biochemistry,2016,51(1):1623.
[7]Chi C,Zhou Y,Meng L,et al. Polymalic acid fermentation byAureobasidiumpullulansfor malic acid production from soybean hull and soy molasses:Fermentation kinetics and economic analysis[J]. Bioresource Technology,2016,223:166174.
[8]Lazaridou A,Roukas T,Biliaderis C G,et al. Characterization of pullulan produced from beet molasses byAureobasidiumpullulansin a stirred tank reactor under varying agitation[J]. Enzyme and Microbial Technology,2002,31(12):122132.
[9]崔玉海,童群义. 响应面法优化短梗霉多糖培养条件[J]. 食品与发酵工业,2008,34(3):6669.
[10]Gadd G M. Melanin production and differentiation in batch cultures of the polymorphic fungusAureobasidiumpullulans[J]. Fems Microbiology Letters,1980,9(3):237240.
[11]Manitchotpisit P,Price N P J,Leathers T D,et al. Heavy oils produced byAureobasidiumpullulans[J]. Biotechnology Letters,2011,33(6):11511157.
[12]Liu Y Y,Chi Z,Wang Z P,et al. Heavy oils,principally longchain nalkanes secreted byAureobasidiumpullulansvar. melanogenum strain P5 isolated from mangrove system[J]. Journal of Industrial Microbiology and Biotechnology,2014,41(9):13291337.
[13]Lee B S,Holler E. Betapoly(Lmalate)production by nongrowing microplasmodia ofPhysarumpolycephalum. Effects of metabolic intermediates and inhibitors[J]. Fems Microbiology Letters,2000,193(1):6974.
[14]Wang Z P,Wang G Y,Khan I,et al. Highlevel production of calcium malate from glucose byPenicilliumsclerotiorumK302[J]. Bioresource Technology,2013,143(17):674677.
[15]Zhang H,Cai J,Dong J,et al. Highlevel production of poly(βL:malic acid)with a new isolatedAureobasidiumpullulansstrain[J]. Appl Microbiol Biotechnol,2011,92(2):295303.
[16]Gibbs P A,Seviour R J. Does the agitation rate and/or oxygen saturation influence exopolysaccharide production byAureobasidiumpullulansin batch culture?[J]. Applied Microbiology & Biotechnology,1996,46(56):503510.
[17]Wecker A,Onken U. Influence of dissolved oxygen concentration and shear rate on the production of pullulan byAureobasidiumpullulans[J]. Biotechnology Letters,1991,13(3):155160.
[18]Cao W,Qi B,Zhao J,et al. Control strategy of pH,dissolved oxygen concentration and stirring speed for enhancingβpoly(malic acid)production byAureobasidiumpullulansipe1[J]. Journal of Chemical Technology and Biotechnology,2013,88(5):808817.
[19]Xia J,Liu X,Xu J,et al. Simultaneously enhanced production of poly(βmalic acid)and pullulan using a dissolved oxygen shift(DOshift)control strategy[J]. Journal of Chemical Technology and Biotechnology,2017,92:14641471.
[20]Nagata N,Nakahara T,Tabuchi T. Fermentative Production of Poly(βLmalic acid),a Polyelectrolytic Biopolyester,byAureobasidiumsp[J]. Bioscience Biotechnology and Biochemistry,2008,57(4):638642.
[21]闫道江,王彩霞,周杰民,等. 酿酒酵母产苹果酸的还原TCA路径构建及发酵调控[J]. 生物工程学报,2013,29(10):14841493.
[22]Manitchotpisit P,Skory C D,Peterson S W,et al. Poly(βL-malic acid)production by diverse phylogenetic clades ofAureobasidiumpullulans[J]. Journal of Industrial Microbiology and Biotechnology,2012,39(1):125132.
[23]Ma Y,Wang G Y,Liu G L,et al. Overproduction of poly(βmalic acid)(PMA)from glucose by a novelAureobasidiumsp. P6 strain isolated from mangrove system[J]. Applied Microbiology and Biotechnology,2013,97(20):89318939.
[24]Taing O,Taing K. Production of malic and succinic acids by sugartolerant yeastZygosaccharomycesrouxii[J]. European Food Research and Technology,2007,224(3):343347.
[25]Neufeld R J,Peleg Y,Rokem J S,et al. lMalic acid formation by immobilized Saccharomyces cerevisiae amplified for fumarase[J]. Enzyme and Microbial Technology,1991,13(12):991996.
[26]周丽,崔文璟,刘中美,等. 基于代谢工程策略合成L苹果酸研究进展[J]. 食品工业科技,2015,36(10):383388.
[29]Zou X,Zhou Y,Yang S T. Production of polymalic acid and malic acid by Aureobasidium pullulansfermentation and acid hydrolysis[J]. Biotechnology and bioengineering,2013,110(8):21052113.
[30]赵宇,陈忠敏. 微生物发酵过程中溶氧的影响及其调控[J]. 食品与发酵科技,2016,52(4):1519.
[31]Hara K Y,Akihiko K. ATP regulation in bioproduction[J]. Microbial Cell Factories,2015,14(1):198207.

