Taqman- 探针荧光定量PCR鉴定副溶血弧菌方法的建立*
侯兵兵,陈昌国,李 娜,赵强元,陈秋圆,刘新萍,董优优
(中国人民解放军海军总医院检验科,北京 100048)
副溶血弧菌(vibrioparahaemolyticus,VP)于1953年最早发现于日本并于1963年正式命名[1],该菌具有较强的嗜盐性[2],对人主要引起食物中毒、急性肠炎,少数情况下可引起败血症[3~5]。与沙门菌和志贺菌类似,副溶血弧菌通过食源性途径引起的中毒事件受到广泛关注[6,7]。在我国广东省,副溶血弧菌导致食源性疾病疫情发生率为29.22%,是沿海地区主要的食源性致病菌之一[8]。
副溶血弧菌根据其血清型可分为非致病性菌株和致病性菌株,其中高致病性血清型共有14种[1]。耐热直接溶血素(thermostable direct hemolysin,TDH)基因和TDH相关溶血素(TDH- related hemolysin,TRH)基因是检测副溶血弧菌的常见分子靶点[9,10],但有报道指出副溶血弧菌分离株中TDH基因和TRH基因有缺失的现象,会造成假阴性结果。副溶血弧菌毒素调控基因(toxin regulations,toxR)是近年来在副溶血弧菌中新发现的毒素调控基因,与副溶血弧菌的致病性有着密切关系,且在弧菌中同源性较低。在本次研究中,我们针对toxR基因相对保守区设计荧光定量引物和Taqman- 荧光探针,建立Taqman- 探针荧光定量PCR检测副溶血弧菌的方法,结果报道如下。
1 材料与方法
1.1实验菌株本实验使用的菌株包括:副溶血弧菌ATCC- VPJS421,溶藻弧菌ATCC- 17749,创伤弧菌ATCC- CMCP6,梅氏弧菌ATCC- Vm8,弗尼斯弧菌ATCC- Vfns1,粪肠球菌ATCC- 29212,金黄色葡萄球菌ATCC- 25293,腐生葡萄球菌ATCC- BAA750,霍氏肠杆菌ATCC- 700323,铜绿假单胞菌ATCC- 27853,大肠埃希氏菌ATCC- 25922,菌株均为本科室保存。
1.2仪器与试剂荧光定量PCR仪为上海宏石公司SLAN- 96P real time PCR System生产,SYBR○RGreen QPCR Master Mix 购自天根生物科技有限公司;引物及Taqman探针由北京奥科鼎盛生物科技有限公司合成,按照引物合成单要求进行后期处理。
1.3方法
1.3.1细菌核酸粗提物制备:将菌种从-80℃冰箱取出后置37℃水浴快速复温,复温后的菌种保存液接种在硫代硫酸盐柠檬酸盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS)和哥伦比亚血平板上,置37℃孵箱培养12 h。用无菌接种环取适量细菌至1.5 ml离心管中,加入100 μl核酸裂解液后室温裂解15 min,100℃恒温金属浴加热10 min,室温13 000 r/min离心5 min(离心半径=9.5 cm),取上清作为模板。
1.3.2引物及Taqman- 探针设计:在NCBI网站输入基因名称获取基因序列,运用生物软件Beacon Designer 7和Primer Premier 5.0进行荧光定量PCR引物及Taqman荧光探针设计,探针5’端标记ROX,3’端标记BHQ2。上游引物:5’- CGCTTTCTTCAGACTCAA- 3’,下游引物:5’- CAAGGATTCACAGCAGAA- 3’,荧光探针:ROX- CCTGCTTCTGATAACAATGACGCC- BHQ2。
1.3.3PCR反应体系及扩增条件:取1 μl提取液上清为模板,以toxR特异性引物及Taqman- 探针进行荧光定量PCR检测。PCR反应体系为:2× Mix 10 μl,引物对1μl,Taqman- 探针0.5 μl,模板1 μl,ddH2O 7.5 μl。PCR反应条件为:95℃5 min;94℃20 s~62℃30 s收集荧光,40个循环。
1.3.4引物浓度的优化:上下游引物浓度分别配置成20,15,10 nmol/L工作液进行荧光定量PCR检测,扩增条件同前。
1.3.5探针浓度的优化:合成的荧光探针按照合成单要求加入ddH2O配成母液,然后取5 μl探针母液至95 μl ddH2O中作为工作液。在20 μl PCR反应体系中分别加入1,0.5 μl荧光探针,扩增条件同前。
1.3.6特异度评价:以优化后的反应体系检测副溶血弧菌标准菌株及其他10种细菌的标准株。
1.3.7灵敏度评价:以副溶血弧菌标准菌株系列浓度梯度为模板(102~10- 4mg/L),每个浓度梯度取1 μl核酸为模板,以优化后的反应体系和反应条件进行荧光定量PCR。以出现典型扩增曲线并在循环数内出现Ct值为阳性。
2 结果
2.1实验参数的优化
2.1.1引物浓度的优化:经过多次实验引物最佳浓度约为10 nmol/L,经2 g/dl凝胶电泳显示引物二聚体较少且扩增效率能够满足实验要求,见图1。
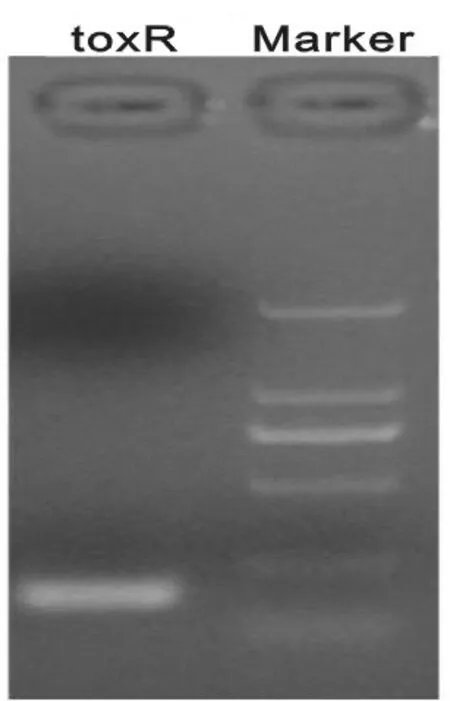
图1 PCR产物2 mg/dl凝胶电泳图
2.1.2探针浓度的优化:实验结果显示,20 μl PCR反应体系中加入0.5 μl荧光探针的反应曲线较体系中加入1 μl荧光探针的效果更好,这与之前研究结果一致[11],见图2。因此,优化后的副溶血弧菌Taqman- 探针荧光定量PCR反应条件为:20μl体系(ddH2O 7.5 μl,2× Mix 10 μl,模板1 μl,引物对1 μl,探针0.5 μl)。95℃5 min;94℃20 s~62℃30 s收集荧光,40个循环。

图2 不同浓度的探针PCR扩增曲线
2.2Taqman- 探针荧光定量PCR反应体系评价
2.2.1特异度评价:用优化后的反应体系检测副溶血弧菌标准菌株及其他10种细菌的标准菌株,以副溶血弧菌的标准菌株为阳性对照。结果除副溶血弧菌标准株阳性扩增外,其它10种细菌标准株均无阳性扩增。因此,该方法的特异度为100%。见图3~图4。
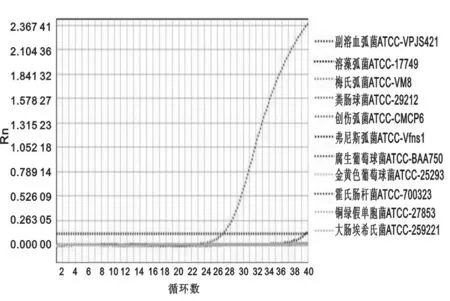
图3 副溶血弧菌标准株与其他10种细菌PCR扩增曲线

注:1.溶藻弧菌ATCC- 17749;2.创伤弧菌ATCC- CMCP6;3.梅氏弧菌ATCC- Vm8;4.弗尼斯弧菌ATCC- Vfns1;5.粪肠球菌ATCC- 29212;6.金黄色葡萄球菌ATCC- 25293;7.腐生葡萄球菌ATCC- BAA750;8.霍氏肠杆菌ATCC- 700323;9.铜绿假单胞菌ATCC- 27853;10.大肠埃希氏菌ATCC- 259221;11.副溶血弧菌ATCC- VPJS421。
图4副溶血弧菌Taqman- 探针荧光定量PCR特异度检测
2.2.2灵敏度评价:以副溶血弧菌标准株核酸系列稀释样本为模板进行荧光定量PCR,当模板浓度为102~10- 1mg/L时,每个浓度均有典型扩增曲线,当模板浓度为10- 2~10- 4mg/L时,每个浓度未出现典型扩增曲线。所以,本研究建立的方法对副溶血弧菌toxR基因的检测灵敏度为10- 1mg/L,有较好的检测灵敏度。见图5。

图5 副溶血弧菌(ATCC- VPJS421)Taqman- 探针荧光定量PCR灵敏度检测
3 讨论
近年来,随着生物化学、免疫学、微生物学、分子生物学技术的快速发展,目前已经有很多技术用于副溶血弧菌的检测,如细菌培养法、培养基显色法、血清学分型鉴定[12]、酶联免疫吸附试验(ELISA)[13]、电化学发光技术[14]、免疫荧光技术[15,16]、免疫印迹[17]、常规PCR,RAPD- PCR,PCR- ELISA,SYBRGreen荧光定量PCR和多重PCR等。然而,常规分离鉴定操作复杂、费时,不能做到早期诊断;免疫学方法其灵敏度和特异度受限且影响因素较多;常规PCR,RAPD- PCR,PCR- ELISA和多重PCR技术均不能进行定量分析,扩增完仍需凝胶电泳进行鉴定,操作繁琐,同时扩增产物易被污染造成假阳性[12]。Taqman- 探针荧光定量PCR技术是在普通荧光定量PCR基础上加入一条特异的荧光探针,具有更高的特异度[11]。
副溶血弧菌TDH基因、TRH基因、gyrB(DNA回旋酶B亚单位)基因以及16S rRNA等都曾被用做副溶血弧菌检测的分子靶点。其中16S rRNA基因保守性极强,其分化程度不够,在鉴定亲缘关系较近的物种间容易出现假阳性;而TDH基因和TRH基因在引起食物中毒的副溶血弧菌分离株中约30.77%副溶血弧菌为阴性[18]。toxR基因由国外学者近年来在副溶血性弧菌中新发现的致病基因,它在弧菌科内序列非常保守,可表达于所有副溶血弧菌中[2],并且不同的弧菌种间toxR基因同源性较低[19]。因此,采用副溶血弧菌toxR基因作为检测靶点比tdh基因、trh基因和gyrB基因及16S rRNA具有明显的优势。
本研究针对副溶血弧菌toxR基因设计特异性引物与Taqman- 探针,建立和优化了实时荧光定量PCR反应体系,并对该体系检测特异度和灵敏度进行了评价,检测时间仅需要50 min。2 mg/dl凝胶电泳结果显示,我们设计的引物不但能够扩增出特异性的条带,并且反应完成后引物二聚体较少,能够满足后续添加Taqman- 探针的实验要求;在进行探针浓度优化时,20 μl PCR反应体系中添加0.5 μl荧光探针的Ct值较添加1.0 μl荧光探针的Ct值小且本底荧光较低,能满足实验要求。本研究建立的实时荧光定量PCR反应体系经过上述优化后为评价该检测系统的特异度和灵敏度,我们采用该反应体系对副溶血弧菌标准株及其它10种常见细菌标准株进行检测,仅副溶血弧菌产生阳性扩增,显示出良好的特异度。为进一步探求该反应体系的检测灵敏度,我们将副溶血弧菌标准株核酸定量后进行系列稀释(浓度范围为:102~104mg/L),发现在核酸浓度为10-1mg/L时能够产生稳定扩增,而10-2mg/L时无稳定扩增,提示该反应体系的检测灵敏度为10-1mg/L。
综上所述,本研究建立的Taqman- 探针荧光定量PCR技术与常规分离培养、常规PCR以及免疫学方法相比,特异度和灵敏度高、检测速度快(检测仅需要50min),适用于副溶血弧菌的快速检测,在副溶血性弧菌诊断上将具有良好的应用前景和应用价值。
参考文献:
[1]韩艳青,侯凤伶,张淑红,等.基于多重PCR的副溶血弧菌大流行菌群及其毒力基因检测方法的建立与评价[J].疾病监测,2016,31(9):750- 754.
Han YQ,Hou FL,Zhang SH,et al.Establishment and evaluation of a novel multiplex PCR assay in detection of pandemic group ofvibrioparahaemolyticusand toxic genes[J].Disease Surveillance,2016,31(9):750- 754.
[2]Chen S,Ge B.Development of a toxR- based loop- mediated isothermal amplification assay for detectingVibrioparahaemolyticus[J].BMC Microbiology,2010,10(41):1- 9.
[3]Zhang L,Orth K.Virulence determinants forVibrioparahaemolyticusinfection[J].Curr Opin Microbiol,2013,16(1):70- 77.
[4]Whitaker WB,Parent MA,Boyd A,et al.TheVibrioparahaemolyticusToxRS regulator is required for stress tolerance and colonization in a novel orogastric streptomycin- induced adult murine model[J].Infect Immun,2012,80(5):1834- 1845.
[5]Pan J,Chen R,Li C,et al.Global analysis of protein lysine succinylation profiles and their overlap with lysine acetylation in the marine bacterium vibrio parahemolyticus[J].J Proteome Res,2015,14(10):4309- 4318.
[6]周方满,谢红意,叶鸿雁,等.临床来源副溶血弧菌毒力基因及耐药性分析[J].现代实用医学,2016,28(7):949- 950.
Zhou FM,Xie HY,Ye HY,et al.Virulence genes and resistance analysis ofVibrioparahaemolyticusisolated from clinical sample[J].Modern Practical Medicine,2016,28(7):949- 950.
[7]Wu S,Wang Y,Duan N,et al.Colorimetric aptasensor based on enzyme for the detection ofVibrioparahemolyticus[J].J Agric Food Chem,2015,63(35):7849- 7854.
[8]张冬生,王铁强,辜洁妮,等.广东省2007~2011年食物中毒事件流行病学特征分析[J].华南预防医学,2013,39(3):74- 76.
Zhang DS,Wang TQ,Gu JN.Epidemiological analysis on food poisoning in Guangdong 2007~2011[J].South China J Prev Med,2013,39(3):74- 76.
[9]Gutierrez West CK,Klein SL,Lovell CR,et al.High frequency of virulence factor genes tdh,trh,and tlh invibrioparahaemolyticusstrains isolated from a pristine estuary[J].Appl Environ Microbiol,2013,79(7):2247- 2225.
[10]Li L,Wong HC,Nong W,et al.Comparative genomic analysis of clinical and environmental strains provides insight into the pathogenicity and evolution ofVibrioparahaemolyticus[J].BMC Genomics,2014,15(1):1135.
[11]陈昌国,侯兵兵,陈秋园,等.Taqman- 探针荧光定量PCR鉴定溶藻弧菌方法的建立[J].实用检验医师杂志,2017,9(1):1- 4.
Chen CG,Hou BB,Chen QY,et al.Establishment of a method for the identification ofVibriopalginolyticusby Taqman- Probe fluorescence quantitative PCR analysis[J].Chin J Clin Pathol,2017,9(1):1- 4.
[12]张倩华.副溶血性弧菌实验室检测研究进展[J].吉林医学,2014,35(25),5720- 5721.
Zhang QH.Research progress on the detection me- thods of the vibrio palginolyticus[J].Jilin Medical Journal,2014,35(25),5720- 5721.
[13]Khawsuk W,Soonklang N,Grams R,et al.Production and characterization of a monoclonal antibody against recombinant glutathione S- transferase(GST) of Fasciola gigantica[J].Asian Pac J Allergy Immunol,2002,20(4):257- 266.
[14]Sun W,Zhang Y,Ju X,et al.Electrochemical deoxyribonucleic acid biosensor based on carboxyl functionalized graphene oxide and poly- L- lysine modified electrode for the detection of tlh gene sequence related toVibrioparahaemolyticus[J].Anal Chim Acta,2012,752(21):39- 44.
[15]Wang L,Zhang J,Bai H,et al.Specific detection ofVibrioparahaemolyticusby fluorescence quenching immunoassay based on quantum dots[J].Appl Biochem Biotechnol,2014,173(5):1073- 1082.
[16]Yi MY,Ling L,Neogi SB,et al.Real time loop- mediated isothermal amplification using a portable fluorescence scanner for rapid and simple detection ofVibrioparahaemolyticus[J].Food Control,2014,41(1):91- 95.
[17]Sakata J,Kawatsu K,Iwasaki T,et al.Production and characterization of a novel monoclonal antibody againstVibrioparahaemolyticusF0F1 ATP synthase’s delta subunit and its application for rapid identification of the pathogen[J].J Microbiol Methods,2012,88(1):77- 82.
[18]骆艳婷,梁景涛,陈爱贞,等.佛山市副溶血弧菌病原学与分子流行病学特征[J].热带医学杂志,2016,16(5):677- 680.
Luo YT,Liang JT,Chen AZ,et al.Etiology and molecular epidemiology ofVibrioparahaemolyticusin Foshan[J].Journal of Trpical Medicine,2016,16(5):677- 680.
[19]黄晨阳,于龙,兰智杰,等.基于toxR基因的PCR检测副溶血性弧菌的方法建立[J].河南预防医学杂志,2013,24(5),327- 330.
Huang CY,Yu L,Lan ZJ,et al.Development of a to- xR- based PCR assay for detectingVibrioparahaemolyticus[J].Henan Journal of Preventive Medicine,2013,24(5):327- 330.

