下丘脑室旁核Epac蛋白在大鼠炎性痛调节过程中的作用及其机制研究
陈彬彬,黄思婷,花景煜,杜 雷,姬宁宁,宋 昱,章功良,张咏梅
(1. 江苏省麻醉学重点实验室,徐州医科大学麻醉学院,江苏 徐州 221002;2. 安徽医科大学基础医学院,安徽 合肥 230032)
疼痛是组织损伤或潜在组织损伤所引起的一种不愉快的主观感受和情感体验。按照国际疼痛研究学会(international association for the study of pain,IASP)的分类,疼痛包括生理性和病理性疼痛,其中病理性疼痛可进一步分为炎症性疼痛、神经病理性疼痛和癌性疼痛等。炎症性疼痛是临床上最常见的一种症状,主要由于周围组织损伤、缺血、缺氧、酸中毒等引起。目前的研究主要集中在外周组织炎症反应[1],外周神经元兴奋性增高[2],中枢兴奋性神经递质大量释放[3],以及胶质细胞或炎症因子敏化[4]等。在炎症痛中,持续刺激外周伤害性感受器,提高了神经元的兴奋性,可以促进背根神经节、脊髓以及相应脑组织痛相关的物质表达[5]。
近年来研究发现,cAMP直接激活的交换蛋白(exchange protein directly activated by cAMP,Epac)在疼痛调节过程中也发挥了重要作用[6]。Epac蛋白是cAMP激活的鸟苷酸交换因子(guanine-nucleotide-exchange factor,GEF),它可以直接作用于下游小G蛋白Rap蛋白,置换和Rap蛋白结合的GDP为GTP,从而激活Rap蛋白[7]。根据RAPGEF3和RAPGEF4基因编码,Epac可分为Epac1和Epac2两种亚型,Epac2根据N端剪辑不同,又可分为Epac2A、Epac2B、Epac2C三种类型[8]。Epac1在全身分布比较广泛,如中枢神经系统、心脏、血管内皮细胞等;Epac2在全身表达部位比较局限[8]。有研究表明,Epac可以通过下游的Rap1、PKC、MEK/ERK、GRK2等信号分子介导疼痛反应[9]。MEK是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)激酶,包括MEK1和MEK2两种亚型,可介导多种生理病理功能,如在大鼠结肠炎肠黏膜通透性[10]以及血管平滑肌细胞增殖[11]中发挥了重要作用。且已有研究表明,在炎症性疼痛模型中,外周伤害性感觉神经元中表达升高的Epac蛋白可以通过下游MEK/ERK信号通路,直接或间接发挥着伤害性刺激激活神经元的作用[12]。
炎症性疼痛是一种损伤性应激反应,下丘脑作为神经内分泌调节的重要枢纽站,其中室旁核(paraventricular nucleus,PVN)在应激及疼痛调节中发挥着重要的作用[13]。因此,本研究采用一种常用的动物疼痛模型——完全弗氏佐剂(complete Freund’s adjuvant,CFA)诱导的炎性痛模型,采用蛋白质印迹的方法观察炎症痛条件下下丘脑室旁核Epac和p-MEK1/2的蛋白表达变化,使用Epac激动剂8p-CPT作用后,观察其行为学和分子水平改变,为进一步理解炎性痛的发病机制及探讨Epac蛋白在炎性痛中的作用提供实验依据。
1 材料
1.1实验动物健康成年SD大鼠64只,♂,体质量230~250 g,由山东济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20140007。大鼠置于昼夜(12 h/12 h)节律光照条件下,室温(23±1)℃,自由饮水和摄食,所有大鼠实验前静养1周。所有实验均遵守《实验动物使用规范》。
1.2试剂抗Epac1抗体(Lot:GR29965-14)和抗Epac2抗体(Lot:GR127767-1)均购自Abcam;抗p-MEK1/2抗体(9154S)购自Cell Signaling Technology;抗GAPDH抗体(Cat.No:AC001)购自ABclonal;碱性磷酸酶标记的山羊抗兔二抗购自北京中杉金桥生物技术有限公司;8p-CPT-2′-O-Me-cAMP购自Santa Cruz Biotechnology;CFA购自Sigma;BCIP/NBT碱性磷酸酶显色试剂盒购自碧云天生物技术研究所。
1.3仪器热痛敏刺激仪(IITC series 8-390)购自中国医学科学院生物工程研究所;机械痛测试仪(ZH)购自淮北立华生物仪器设备有限公司。
2 方法
2.1CFA炎症性疼痛模型的制备与实验分组将SD大鼠随机分为对照组和CFA模型组,每组6只。大鼠固定,用微量注射器吸取100 μL CFA注入大鼠左侧后肢足底中心皮下,建立炎症性疼痛模型;生理盐水对照组于相同位置注射100 μL生理盐水。模型建立成功的标志为大鼠局部出现典型的外周炎症症状,包括注射局部红、肿以及疼痛表现等,持续时间超过1周。首先进行大鼠热缩足反射潜伏期(thermal withdrawal latency,TWL)和机械缩足反射阈值(paw mechanical withdraw threshold,PMWT)基础值的测定,此后于足底注射后1、3、5、7、9、11、13 d进行TWL检测,足底注射后6、8、10、12、14 d进行PMWT检测。根据行为学以及蛋白检测结果,在CFA炎症性疼痛模型建立后,对大鼠进行下丘脑室旁核核团给药,分为室旁核微量注射生理盐水组(Saline)和给药(8p-CPT)组,每组6只,分别PVN微量注射0.3 μL 0.9%生理盐水或8p-CPT(1 g·L-1)。
2.2下丘脑室旁核核团注射CFA致炎后d 3,大鼠七氟烷吸入麻醉后,将头部固定于大鼠脑立体定位仪上,暴露颅骨,双氧水清洁颅骨表面,参考Watson & Paxinos大鼠脑图谱,结合本课题组对大鼠(230~250) g PVN核团定位摸索,确定核团坐标为:ML=±0.4 mm,AP=-1.4 mm,DV=7.7 mm[13]。用针尖外径为0.3 mm的微量注射器向核团内注射,1 min内注射完毕,留针5 min以防药液流出,统一选取右侧PVN进行注射。注射后20 min、1 h、2 h检测热痛阈。
2.3TWL的测定在同一时间段、同一室温、同一湿度下进行测定。按照Hargreaves法,将大鼠放置于3 mm厚的15 cm×15 cm×15 cm的有机玻璃箱中,待大鼠在其中适应30 min安静后,用热痛敏刺激仪照射大鼠左后肢足底后外侧。从照射开始至大鼠出现抬腿回避的时间为TWL;光源刺激强度恒定不变,自动切断时间为25 s,以防止组织损伤。每只动物连续测定5次,测量间隔3 min,取其中3次比较平稳的数据平均值为大鼠TWL。
2.4PMWT的测定在安静环境下将大鼠置入透明的有机玻璃箱中,其底为金属丝制成的网状格垫。同一时间段,先将大鼠放入箱中,使之适应30 min直至大鼠对陌生环境保持安静(不在笼里走来走去、不自我舔舐为止)。采用von Frey filaments刺激大鼠左侧掌跖部无毛处,Von Frey filaments呈“S”型,作用时间6~8 s,缓慢用力,出现抬足、躲避或舔足动作为阳性反应,每次刺激至少间隔30 s。测量时,选取中间值10.0 g作为起始,若缩足反应为阴性,则选用刺激强度呈对数递增的相邻von Frey filaments继续刺激;若缩足反应为阳性,则选择相邻递减的刺激强度给予刺激。如此反复,以第1个转折点的前一点为起点,连续6次的刺激结果为最终缩足反应模式。若缩足反应呈持续阳性则为5次刺激,缩足反应呈持续阴性则为4次刺激,刺激次数最多为9次;最大力度为26 g,大于此值时记为26 g,最小力度为4 g,小于此值时记为4 g。采用内推法计算诱发大鼠出现50%机械缩足反应的刺激强度作为机械痛阈,其公式为:50% threshold(g)=(10[Xf+κδ])/10 000(Xf为最后一次刺激强度;κ为不同刺激方式的系数,在内推法的表格中查找;δ为各刺激强度取对数后间距的平均值,δ=0.18)。
2.5Westernblot检测行为学测试结束后,10%水合氯醛(3 mL·kg-1)腹腔注射麻醉大鼠后取脑,分离出双侧室旁核。将取出的室旁核放入预冷的裂解液中,在冰上使用电动匀浆器进行匀浆,每个样本匀浆3次,每次10 s,间隔5 s冷却,充分裂解后离心15 min,取上清液, BCA法对裂解后的蛋白浓度进行检测,配平,随后加入5×上样缓冲液,放入沸水中煮沸15 min使蛋白变性。用10% SDS~PAGE电泳分离蛋白,通过湿转方式将蛋白转移到PVDF膜上。5%脱脂牛奶封闭2 h后,以相应的检测蛋白抗体4℃孵育过夜,TBST缓冲液洗膜5 min×3次;用碱性磷酸酶标记的二抗室温孵育2 h,再次洗涤,TBST缓冲液洗膜5 min×3次,BCIP/NBT碱性磷酸酶显色试剂盒显色,以Image J软件进行图像分析。

3 结果
3.1CFA诱导炎症性疼痛行为学改变与对照组相比,CFA组的TWL和PMWT基础值均无统计学意义(P>0.05)。与对照组相比,大鼠左侧足底皮下注射CFA后d 1、3、5、7、9、11 TWL明显降低(P<0.01),d 13 TWL基本恢复至正常水平(Fig 1A);注射后d 6、8、10、12 PMWT明显降低(P<0.05,Fig 1B)。在此过程中大鼠患足伴有红肿、行走困难、提缩患爪等一系列保护性行为。
3.2CFA炎性痛大鼠下丘脑室旁核Epac1、Epac2和p-MEK1/2蛋白表达情况如Fig 2所示,与对照组相比,CFA炎性痛大鼠下丘脑室旁核Epac1蛋白表达于d 3开始降低,且在d 3和d 9差异有显著性(P<0.05),而Epac2蛋白表达则无明显变化;p-MEK1/2蛋白表达于d 3明显降低(P<0.05)。
3.3PVN内注射8p-CPT对大鼠痛行为学及p-MEK1/2蛋白表达的影响CFA炎性痛大鼠于d 3,PVN内注射Epac非特异激动剂8p-CPT后,与生理盐水组相比,8p-CPT组大鼠的TWL明显升高(P<0.05),这一效应在给药后20~30 min达到最大,到2 h衰减到给药前水平(Fig 3A)。给予激动剂30 min后,室旁核p-MEK1/2蛋白表达较生理盐水组明显升高,差异有统计学意义(P<0.05);给药2 h后,室旁核p-MEK1/2蛋白表达基本恢复至给药前水平(Fig 3B)。
4 讨论
Epac蛋白是cAMP下游信号分子,可以介导cAMP多种效应,在中枢神经系统发挥促神经轴突生长[14]、神经递质释放[15]、神经元分化与重塑以及突触传递等功能[9]。有研究表明,在外周感觉神经元中Epac蛋白表达升高可促进长时程炎症性疼痛,通过有效的干预手段使Epac表达恢复正常,可抑制疼痛持续性发展[12]。
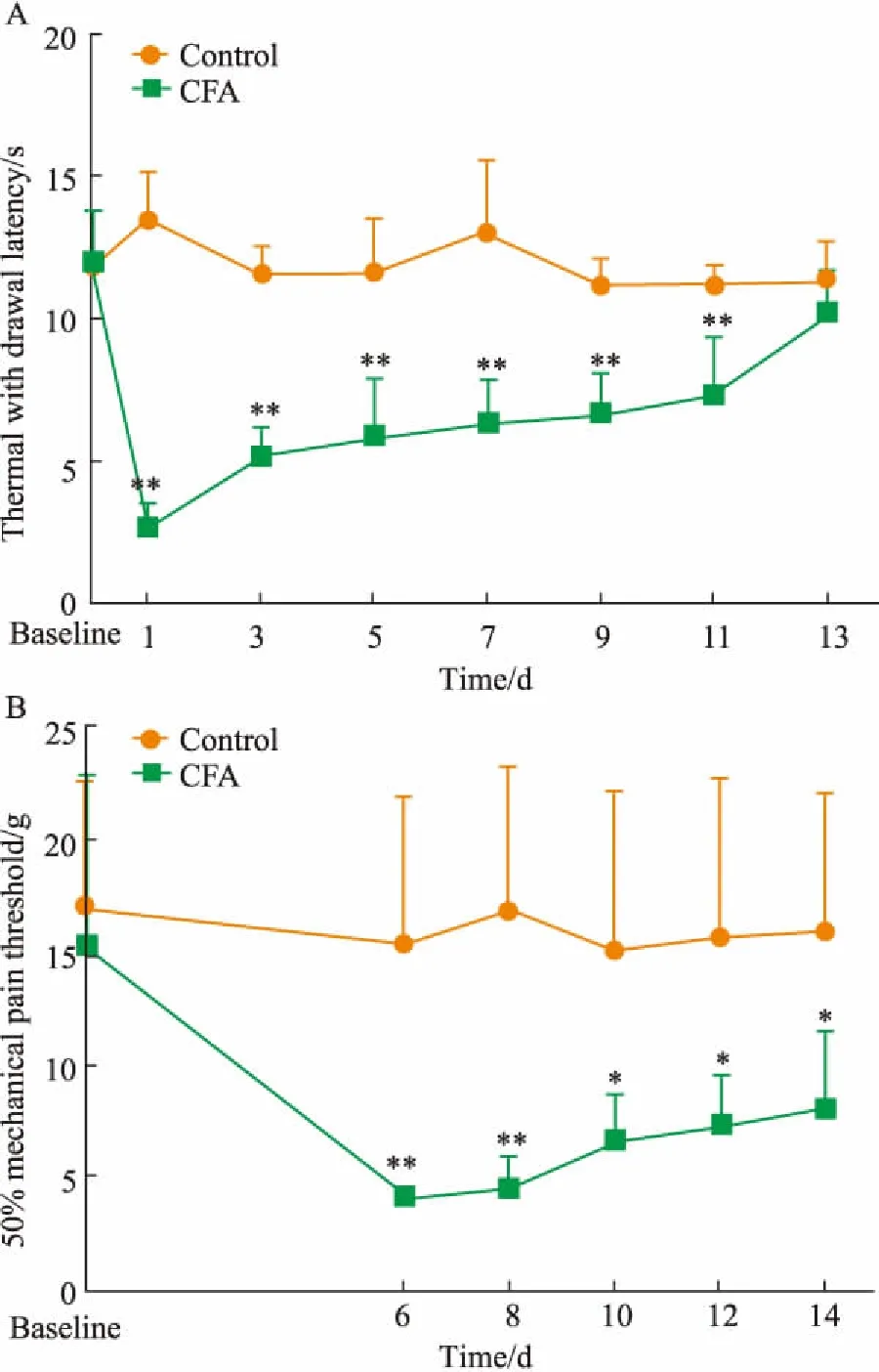
Fig 1 Effects of CFA administration on TWL(A) and PMWT(B) in SD rats
*P<0.05,**P<0.01vscontrol group
我们前期的研究发现[13],幼年经过结直肠扩张应激后可致成年大鼠发生慢性内脏痛敏表现,且这一作用可能和室旁核促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)神经元敏化作用有关,敏化的CRH神经元可分泌大量CRH,并激活其胞膜CRHR1。CRHR1是G蛋白偶联受体,其被激活时胞内cAMP、Epac、PKA等相关信号分子的表达量或激活情况可能发生改变。在炎症性疼痛模型中对此相关研究甚少,因此,本实验采用CFA诱导的炎性痛模型,该模型成功模拟了炎性痛局部红、肿、热、痛等症状,并且可维持一段时间。结果证实,大鼠CFA致炎后d 1 TWL即降低,直到d 11维持在较低水平,d 13 基本恢复到正常水平,而PMWT于d 14仍维持在较低水平;在d 3室旁核Epac1和p-MEK1/2蛋白表达均降低,并可维持一段时间,这与已有报道致炎后外周感觉神经元Epac蛋白表达水平升高正好相反[2],这可能与外周和中枢在炎性痛调节过程中分别发挥的不同作用有关,在此过程中,室旁核p-MEK1/2表达可能受到多种上游信号分子影响;而致炎后Epac另一种亚型Epac2蛋白表达在各时间点并无明显变化,因此,我们认为,在CFA致炎过程可能参与发挥作用的Epac类型是Epac1蛋白。CFA致炎后d 3室旁核注射Epac非特异性激动剂8p-CPT 20~30 min后镇痛效果最佳,1 h尚具有明显的镇痛效果,至2 h基本恢复到给药前水平,这可能与药物代谢有关。与生理盐水组相比,8p-CPT组室旁核p-MEK1/2蛋白表达明显升高,2 h后8p-CPT组p-MEK1/2蛋白水平恢复至给药前水平,这和行为学结果相一致。故下丘脑室旁核Epac1-MEK1/2信号通路可能参与了CFA所致的慢性炎症性疼痛的发展过程。
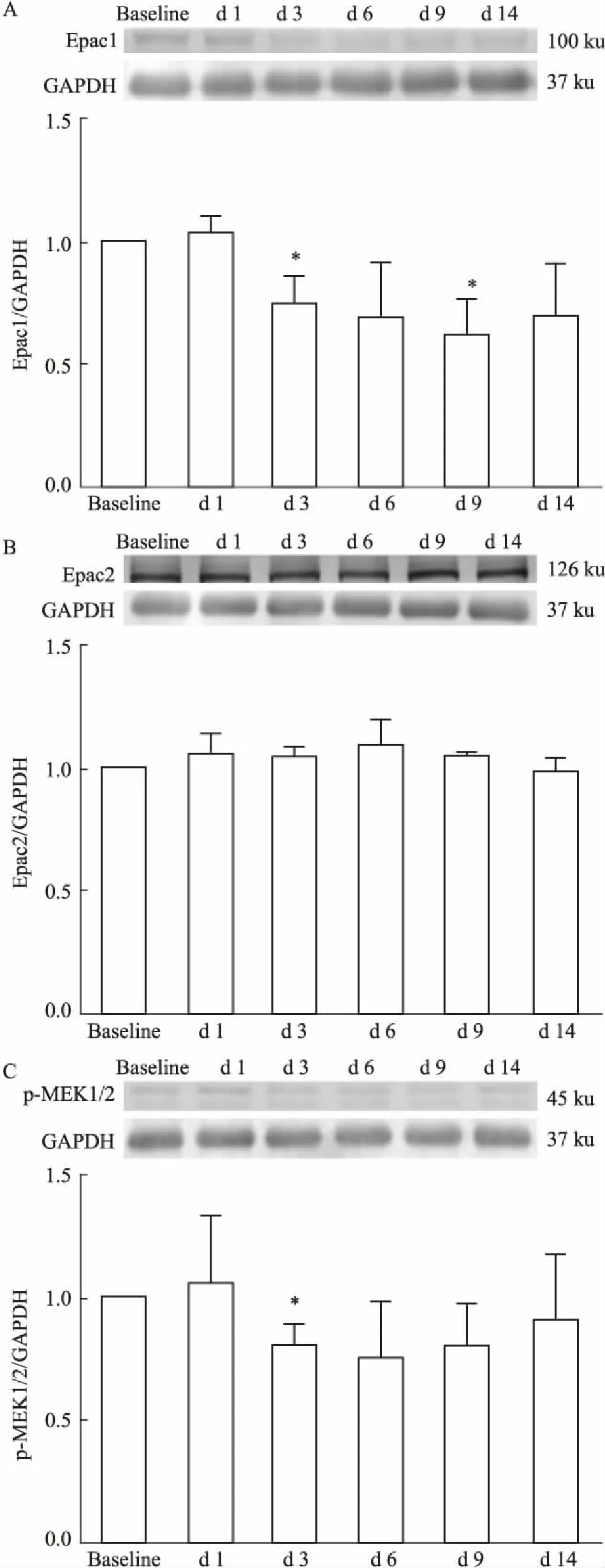
Fig 2 Expression of Epac1(A), Epac2 (B) and p-MEK1/2(C) in PVN in CFA treated rats
*P<0.05vsbaseline
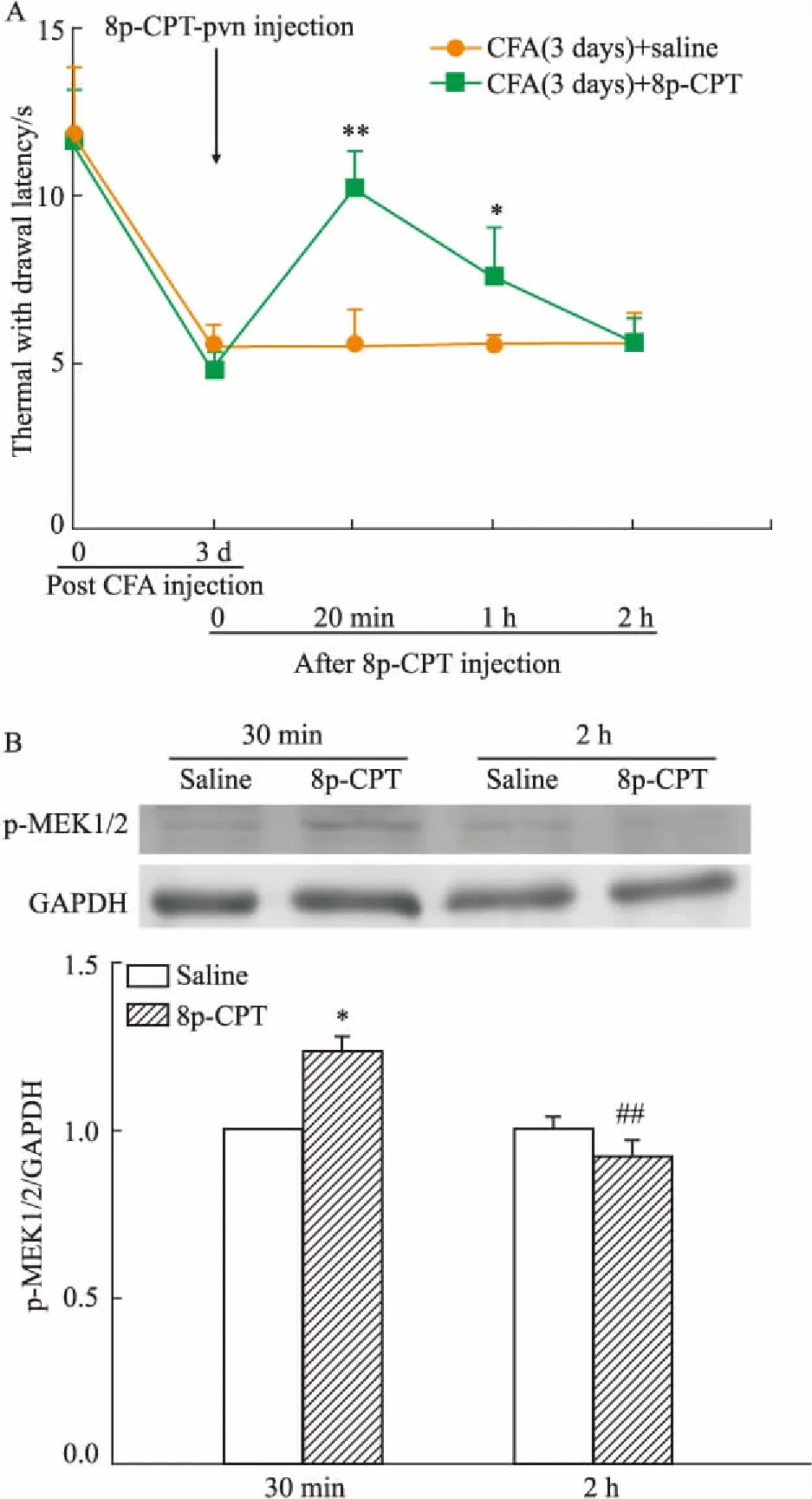
Fig 3 Changes of TWL(A) and expression of p-MEK1/2 protein(B) after injecting Epac non-specific agonist 8p-CPT-2'-O-Me-cAMP in PVN on 3rd post CFA injection
*P<0.05,**P<0.01vssaline group;##P<0.01vs30 min 8p-CPT group.
综上所述,我们认为CFA致炎后,于d 3开始进入慢性炎症期,下丘脑室旁核作为神经内分泌调节中枢,在外周持续性炎症痛刺激下其功能发生失调,这可能与室旁核神经元发生敏化有关,从而导致室旁核对外周痛刺激反应性增强,其胞内的分子机制可能与下丘脑室旁核Epac1蛋白表达降低有关。降低的Epac1蛋白通过对下游信号分子MEK1/2的激活效应减弱,介导了慢性炎症性疼痛过程,本研究将为临床慢性炎性痛的治疗提供一定的理论基础和治疗靶点。
参考文献:
[1]Rafieian-Kopaei M, Shakiba A, Sedighi M, et al. The analgesic and anti-inflammatory activity of linum usitatissimum in Balb/c mice[J].EvidBasedComplementaryAlternMed, 2017,22(4):892-6.
[2]Wang H, Heijnen C J, van Velthoven C T, et al. Balancing GRK2 and EPAC1 levels prevents and relieves chronic pain[J].ClinInvest, 2013,123(12):5023-34.
[3]Li K, Cai B, Li C, Zhang X. Presynaptic inhibition of nociceptive neurotransmission by somatosensory neuron-secreted suppressors[J].SciChinaLifeSci, 2017,60(9):1013-8.
[4]Antal M. Interleukin-1 receptor type 1 is overexpressed in neurons but not in glial cells within the rat superficial spinal dorsal horn in complete Freund adjuvant-induced inflammatory pain[J].Neuroinflammation, 2017,14(1):125.
[5]Vaughn A H, Gold M S. Ionic mechanisms underlying inflammatory mediator-induced sensitization of dural afferents[J].JNeurosci, 2010,30(23):7878-88.
[6]Gu Y, Wang C, Li G, et al. EXPRESS: F-actin links Epac-PKC signaling to purinergic P2X3 receptors sensitization in dorsal root ganglia following inflammation[J].MolPain, 2016, 12. doi: 10.1177/1744806916660557.
[7]De Rooij J, Zwartkruis F J, Verheijen M H, et al. Epac is a Rap1 guanine-nucleotide-exchange factor directly activated by cyclic AMP[J].Nature, 1998,396(6710):474-7.
[8]Chen H, Wild C, Zhou X, et al. Recent advances in the discovery of small molecules targeting exchange proteins directly activated by cAMP (Epac)[J].JMedChem, 2014,57(9):3651-65.
[9]Breckler M, Berthouze M, Laurent A C, et al. Rap-linked cAMP signaling Epac proteins: compartmentation, functioning and disease implications[J].CellSignal, 2011,23(8):1257-66.
[10] 丁少桢, 丁浩, 梅俏, 等. 同型半胱氨酸调控MEK-ERK-MLCK通路影响结肠炎大鼠肠黏膜通透性的实验研究[J]. 中国药理学通报,2016,32(4): 498-502.
[10] Ding S Z, Ding H, Mei Q, et al. Effect of homocysteine on the intestinal permeability by regulating MEK-ERK-MLCK signal transduction in experimental colitis rats[J].ChinPharmacolBull, 2016,32(4): 498-502.
[11] 赵京山, 方明星, 郭浅妤, 等. 羟基红花黄色素A通过影响PCNA表达和MEK-ERK1/2 信号通路抑制大鼠血管平滑肌细胞增殖[J]. 中国药理学通报,2015,31(7): 984-8.
[11] Zhao J S, Fang M X, Guo Q Y, et al. Hydroxysafflor yellow A inhibits VSMCs proliferation via PCNA and MEK-ERK1/2[J].ChinPharmacolBull, 2015,31(7): 984-8.
[12] Eijkelkamp N, Wang H, Garza-Carbajal A, et al. Low nociceptor GRK2 prolongs prostaglandin E2 hyperalgesia via biased cAMP signaling to Epac/Rap1, protein kinase Cepsilon, and MEK/ERK [J].JNeurosci, 2010,30(38):12806-15.
[13] Zhang G, Yu L, Zhang Y M, et al. Activation of corticotropin-releasing factor neurons and microglia in paraventricular nucleus precipitates visceral hypersensitivity induced by colorectal distension in rats[J].BrainBehavImmun, 2016,55:93-104.
[14] Murray A J, Shewan D A. Epac mediates cyclic AMP-dependent axon growth, guidance and regeneration[J].MolCellNeurosci, 2008,38(4):578-88.
[15] Van Kolen K, Dautzenberg F M, Verstraeten K, et al. Corticotropin releasing factor-induced ERK phosphorylation in AtT20 cells occurs via a cAMP-dependent mechanism requiring EPAC2[J].Neuropharmacology, 2010,58(1):135-44.

