线粒体治疗在线粒体相关疾病治疗中的应用及展望
张华菁,赵孟楠,付 琛,付爱玲
(西南大学药学院,重庆 400715)
线粒体是哺乳动物细胞内重要的“工厂”,能生产ATP和多种生物合成中间体。同时,其作为细胞生理功能网络中的一个重要节点,能参与到许多细胞生理生化过程中,如Ca2+稳态、凋亡、胞内信号传导等。因此,线粒体功能障碍可以引发包括神经退行性病变和代谢性疾病在内的一系列疾病。通过保护和恢复线粒体的功能,可以使细胞恢复正常功能并延缓疾病进程[1]。然而,在线粒体疾病的发生发展过程中,线粒体往往受到了不可逆的损伤,所以线粒体保护剂或稳定剂的作用非常有限。此外,也有许多研究表明线粒体在肿瘤的形成与发生过程中具有十分重要的作用,针对线粒体治疗癌症也成为了目前的一个研究热点。
目前,已有多个实验室观察到,线粒体可以在不同细胞间进行转移,这种现象被命名为线粒体传递(mitochondrial transfer)[2]。同时,我们实验室的研究结果以及许多文献表明,分离纯化的线粒体可快速、直接进入到哺乳动物细胞中,并在受体细胞内正常地发挥自身的功能。这种向体内外细胞中进行线粒体传递的方法,被称为线粒体移植(mitochondrial transplantation)[3]。而使用线粒体作为治疗药物,通过移植线粒体以替换细胞内原有的缺陷线粒体,从而恢复细胞内正常的线粒体功能的方法,被称为线粒体治疗(mitotherapy)。该方法为线粒体相关疾病的治疗提供了一条具有潜力的新途径。
1 外源线粒体能够直接进入体外培养的细胞
1982年,Clark等[4]从耐受氯霉素的细胞中,提取纯化出含有抗氯霉素基因的线粒体,并将该线粒体与对氯霉素敏感的细胞共孵育2周,结果发现原本对氯霉素敏感的细胞表现出了对氯霉素抗性。这证明外源线粒体能够进入细胞并发挥作用。此外,该实验还提示外源线粒体可能是通过内吞作用进入细胞。令人遗憾的是,该实验结果一直未能引起关注。直至2007年,Katrangi等[5]将小鼠肝脏线粒体与缺乏线粒体DNA的人非小细胞肺癌A549细胞(A549 ρ0 cells)共孵育,结果表明,异源的鼠线粒体可进入到线粒体缺陷的人细胞中,并且可以明显恢复后者的呼吸功能。
尽管已经观察到了外源线粒体可直接进入细胞这一事实,但这种现象的可靠性依旧引起了很大争议,甚至有部分文献报道在共孵育过程中无法检测到分离的线粒体进入细胞[6]。近年来,随着显微镜观测技术的进步和发展,已有多个实验室报道能够观察到线粒体可直接、快速地进入体外培养的细胞。例如,Kitani等[7-8]通过红色荧光蛋白DsRed和绿色荧光蛋白(green fluorescence protein, GFP)对线粒体进行荧光标记,随后将荧光标记的线粒体与被破坏了线粒体DNA(mitochondrial DNA, mtDNA)的细胞进行共孵育,结果表明线粒体可以被该细胞摄取并恢复细胞的活力,其作用可以持续数日。我们实验室将从人肝癌细胞HepG2中提取的线粒体与人神经母细胞瘤SH-SY5Y细胞进行共孵育,结果证实HepG2线粒体可以进入SH-SY5Y细胞,见Fig 1[9]。以上结果均证实了外源线粒体可直接进入另一细胞。
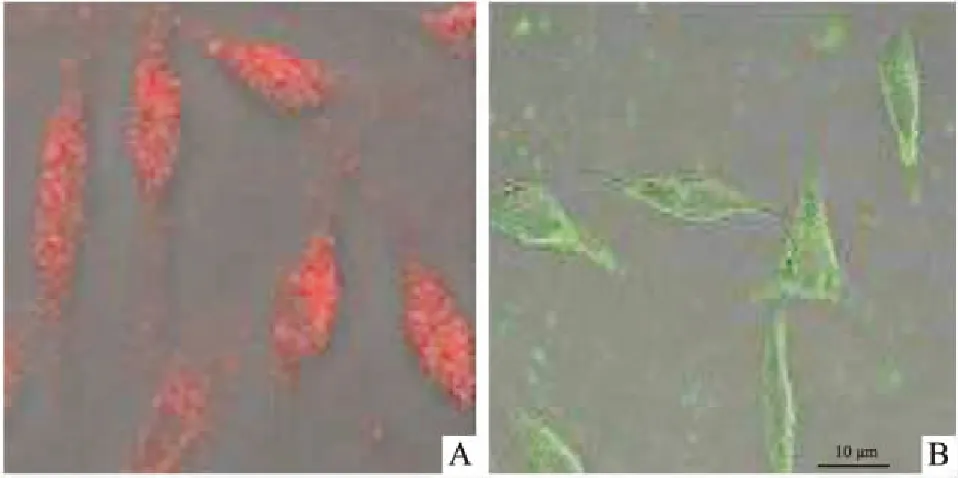
Fig 1 Mitochondria entered SH-SY5Y cells
A: Exogenous mitochondria were pre-stained with Mitotracker Red CMXRos; B: Exogenous mitochondria were isolated from pCMV/mito/GFP-transduced HepG2 cells.
尽管如此,线粒体进入细胞的机制仍尚需进一步的确定。有研究认为,细胞通过向外伸展的细胞膜摄取外源线粒体,而这种摄取可被巨胞饮抑制剂阿米洛利所阻断,网格蛋白抑制剂则对此没有影响,提示线粒体可能是通过巨胞饮途径进入细胞[10]。此外,线粒体结构的完整性是决定线粒体是否被摄取的关键。如果线粒体外膜被破坏或者膜蛋白功能受损,线粒体则不能进入细胞。这就对线粒体的提取分离、纯化过程有较高要求。我们实验室的经验为线粒体的提取需要在低温(0~4℃)、60 min内完成;并且线粒体在放置时活力会快速下降,需现提现用。
2 不同细胞间线粒体的传递
健康细胞向其他细胞传递细胞器,可增加细胞间联系、促进受体细胞生长和增殖。例如外体(exosome)在细胞间的传递促进了细胞间RNA和蛋白质的交换,从而调节特定受体细胞中的分子信号[11]。目前,已有多个实验室观察到了线粒体在细胞间的传递,这使得人们对于细胞间的信息联系以及细胞损伤恢复机制有了更深刻的认识。
Rustom等[12]研究了大鼠嗜铬细胞瘤细胞(PC12)以及人胚胎肾细胞(HEK293)和正常大鼠肾细胞之间,通过隧道纳米管(tunneling nanotubes, TNTs)进行的选择性细胞器传递。TNTs主要由F-肌动蛋白构成,并且各种细胞间的TNTs类似结构有着不同的构型,这表明其具有多种亚类结构。同时,实验也提示TNTs在细胞间是普遍存在的,它在细胞正常生理活动中具有重要的意义[13]。TNTs的发现改变了人们对细胞间线粒体的水平传递的认知,随后的一系列研究均证明了线粒体的传递在动物体内是属于普遍事件,可出现于诸多生理病理状态中[2]。
2.1干细胞中的线粒体向线粒体受损细胞的传递间充质干细胞(mesenchymal stem cells, MSC)是一种具有自我更新和分化能力的原型成体干细胞,其在组织间广泛分布,参与体内多种生理过程。近年来的研究显示,MSC在组织再生等治疗方面有着良好的前景[14]。
在MSC修复组织功能的研究中,有报道MSC还能通过传递线粒体的方式修复其他受损的细胞。例如,将小鼠骨髓间充质干细胞(mouse bone mesenchymal stem cells,mBMSCs)和人间充质干细胞(human bone mesenchymal stem cells, hBMSCs)分别通过气道对小鼠进行滴注,使其进入由脂多糖诱导的急性肺损伤模型的肺组织中[15]。在显微镜下可观察到,mBMSCs和hBMSCs均能与肺上皮细胞形成间隙连接通道,线粒体由此进入受损的肺上皮细胞,从而明显地消除肺部损伤。如果间隙连接通道无法形成,或者线粒体的功能不完整,MSCs则无法对肺损伤产生治疗效果。
为验证多功能干细胞衍生间充质干细胞(human derived MSC,iPSC-MSCs)的线粒体传递效果,Zhang等[16]将iPSC-MSCs与蒽环霉素损伤的心肌细胞进行共培养,并以BMSCs作为实验对照。结果表明,iPSC-MSCs在线粒体的传递方面要优于BMSCs。进一步的研究显示,其传递的优越性是由于内源性Rho GTPase 1(MIRO1)和TNF-αIP2高表达,后者使得iPSC-MSCs对于肿瘤坏死因子α(tumor necrosis factor α, TNF-α)诱导的TNTs的响应更为灵敏,从而更易产生TNTs,利于线粒体进行传递的进行。
2.2肿瘤细胞间以及肿瘤细胞与正常细胞间的线粒体传递肿瘤是在不同因素的作用下,细胞生长失去控制,以至于产生异常增生而形成的疾病。而线粒体作为参与细胞生长的重要细胞器,在肿瘤的生长、侵袭等过程中有着一定的作用。目前,有很多关于线粒体在肿瘤的病理过程中的作用的假说,但肿瘤细胞线粒体的传递仍是一个充满未知的领域。
Lu等[17]将2种不同的膀胱癌细胞RT4和T24进行共培养,观测到了两种细胞间TNTs的存在,见Fig 2。进一步的研究显示,线粒体从T24到RT4细胞是自发的单向传递,并且迁移后的线粒体分布与RT4细胞中的原始线粒体一致,这意味着迁移的线粒体可能与原始线粒体进行了融合。他们还发现,受体膀胱癌细胞中的Akt和mTOR通路被激活,下游介质数量增加,其侵袭能力在体内和体外实验中均被证明得到增强。Pasquier等[18]通过3D培养以及肿瘤外植体培养,证明TNTs会在多种癌细胞之间,以及基质细胞和癌基质细胞系之间产生。实验结果表明,线粒体的交换会优先在内皮细胞和癌细胞之间发生。癌细胞获得内皮细胞传递的线粒体后,会具有更强的化学药物耐受性。
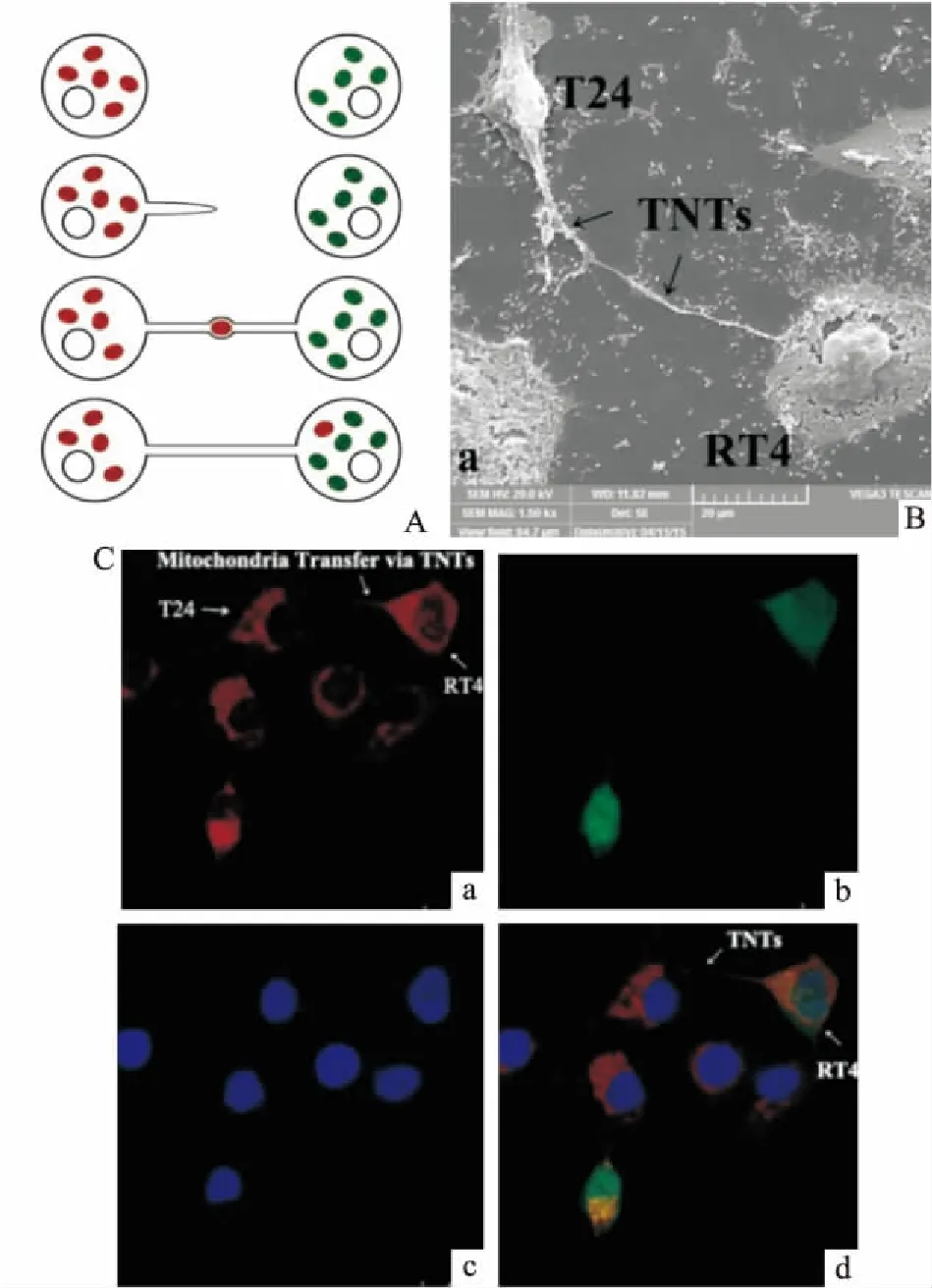
Fig 2 Mitochondria transfer by TNTs.
A: Representation of TNTs-mediated mitochondria transfer; B: TNTs (black arrows)observed between T24 cells andRT4 cells; C: Spontaneous mitochondria trafficking from T24 cells to RT4 cells obtained by capturing “double positive” (red and green) RT4 cells under fluorescence microscopy.
2.3星形胶质细胞的线粒体向神经元细胞的传递线粒体传递的现象不仅存在于干细胞、癌细胞等细胞之间,现有证据表明神经细胞间也存在着类似的现象。星形胶质细胞是神经胶质细胞中的一种,具有引导神经元移动、提供神经元所需营养等重要功能。受损线粒体会从神经元细胞向星形胶质细胞进行传递,并在星形胶质细胞中通过溶酶体自噬途径降解[19]。
近期,Hayakawa等[20]发现小鼠星形胶质细胞可以通过分泌囊泡,释放功能性线粒体进入神经元细胞。他们收集含有上述囊泡的培养基,并将囊泡中的线粒体用膜电位依赖性荧光染料(MitoTracker Red CMXRos)进行标记。随后,将该培养基与通过葡萄糖损伤的神经元进行共培养。一段时间后,神经细胞中可观察到荧光颗粒,同时神经元内ATP等生物能量数值小幅增加。机制研究表明,该释放过程是由钙依赖性机制介导的,其中涉及到CD38和循环ADP核糖信号。小鼠的瞬时局灶性脑缺血可以诱导星形胶质细胞线粒体进入相邻的神经细胞,由此增强神经细胞的存活信号。
3 线粒体治疗在动物体内的应用
3.1局部注射或冠状动脉灌注治疗心肌缺血/再灌注由于心肌细胞特殊的生理功能,其胞内线粒体的含量要高于其他细胞。心肌细胞缺血以及再灌注过程会对线粒体带来严重的损伤,最终导致心肌细胞坏死[21]。将功能完整的线粒体移植入受损的心肌细胞,将为心肌缺血及再灌注损伤的治疗提供新的方法。
近期临床试验报道,从患者自身肌肉组织中分离出的线粒体,能够进行自体的线粒体治疗[3,22]。由于心肌缺血在临床上具有突发性,而普通的线粒体提取方法耗时偏长(60~90 min)。实验人员重新设计了一种多次过滤单次离心的分离方案,使线粒体的提取能够在30 min内完成。随后,立即将分离的线粒体局部注射入受损的心肌组织中,并监测心肌细胞的改善情况。研究结果证明,自体线粒体治疗可以增强细胞活力和心肌缺血后功能的恢复。并且,通过冠状动脉进行线粒体灌注可以使线粒体在10 min内迅速地分布整个心脏,从而可以更快地为缺血/再灌注损伤的心脏提供保护作用。这种自体线粒体治疗的技术已经在儿科患者体内进行了临床试验[23]。报告显示,治疗后的患者没有出现明显的不良反应,以及心律不齐、血肿等并发症。在治疗后的数日内,患者心室功能均得到了有效的改善。这初步证明了该技术在临床应用的可行性。
3.2静脉注射线粒体治疗多器官的线粒体疾病外源线粒体通过静脉给予小鼠后,可快速分布到小鼠多个组织器官,并且没有明显的不良反应。这意味着线粒体治疗可用于治疗涉及多组织病变的线粒体相关疾病。
帕金森病(Parkinson’s disease, PD)是一种常见的中老年神经退行性疾病,其发病机制与线粒体功能障碍有着密切的联系。将外源线粒体静脉注射到PD模型小鼠中,动物行为学和生化指标结果显示,外源性线粒体能明显改善PD模型小鼠的症状,其机制与增加电子传递链活性、降低活性氧自由基水平、阻止细胞凋亡和坏死等有关[8]。在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)模型小鼠中,外源性线粒体可明显消除肝脏脂质淤积、降低血清转氨酶活性和胆固醇水平、减轻NAFLD模型小鼠肝脏的氧化损伤,从而恢复肝细胞的正常功能,见Fig 3[24]。以上结果均表明,外源性线粒体在体内对疾病具有治疗应用价值。
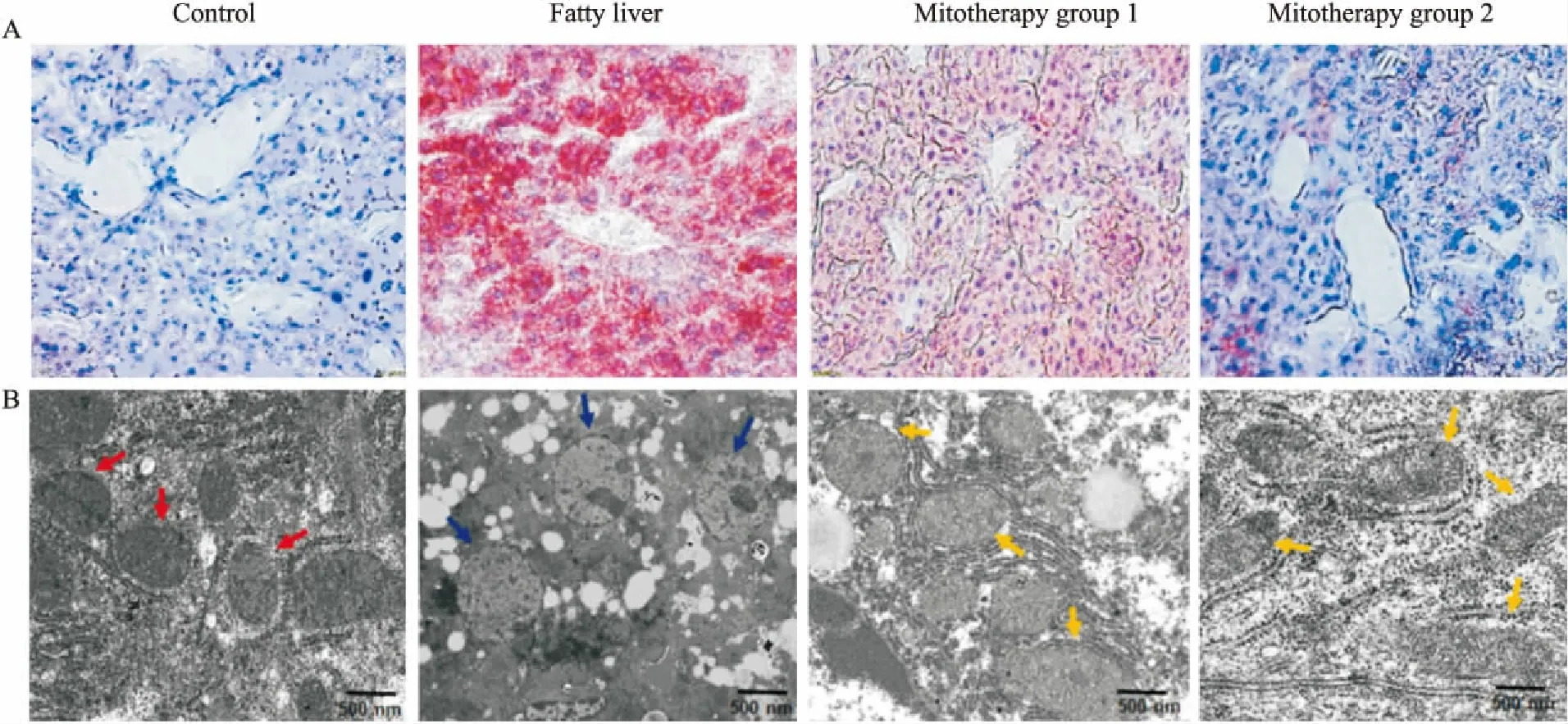
Fig 3 Mitotherapy for nonalcoholic fatty liver disease
Pathological changes of the liver tissues of the mice treated with high-fat diets and mitochondria. A: Liver tissues were stained with Oil Red O. The excessive accumulation of lipid droplets in mouse liver appeared after the mice were fed with high-fat diet. Mice in mitotherapy group 1 were intravenously injected mitochondria three times in 9 days (once in 3 days), while mice in mitotherapy group 2 received mitochondria six times in 18 days. Representative photomicrographs (×200). B: Ultrathin sections for mitochondrial observation under TEM. The red arrows pointed to normal mitochondria, while the blue one to the swelling mitochondria, and the yellow ones to the restored mitochondria.
4 线粒体治疗的毒性和免疫反应
适当剂量的线粒体可发挥治疗作用,但当线粒体浓度过高时,则会产生细胞毒性。且受到损伤的线粒体没有提高细胞活力的作用,例如,经超声和(或)冻融的破碎的线粒体对体外培养的细胞没有任何影响;通过静脉注射到小鼠体内时,则会加重对乙酰氨基酚诱导的肝损伤。
目前,已经证明了从自身分离的线粒体静脉注射到人体后,机体对自身的线粒体不产生免疫反应[3]。例如,从患者自身分离的线粒体重新注射到患者体内后,并不产生免疫反应,血清中也没有检测到免疫相关的细胞因子水平的提高。已知线粒体在体内产生自身抗体的主要原因,在于线粒体丙酮酸脱氢酶E2亚基、侧链2含氧酸脱氢酶、2-含氧戊二酸脱氢酶的氧化修饰,最终造成机体产生自主免疫反应。结构和功能正常的同物种线粒体或跨物种的线粒体是否能对机体产生免疫反应,尚需要实验进行验证。
5 总结与展望
目前的证据已证明,线粒体传递是普遍存在的现象。或许该现象是线粒体在进化过程中形成的一种特殊的细胞间物质和信息联系模式。线粒体传递现象与多种生理病理现象息息相关,如肿瘤的形成与发展等。在不同的条件下,其传递的机制方法也各有不同。线粒体治疗作为线粒体移植的治疗应用,具有广阔的应用前景。尤其在线粒体疾病的治疗方面,由于临床症状的多样性,现阶段还没有有效的治疗方案,但线粒体疾病的共同特征是线粒体受损而导致其功能障碍。线粒体治疗能够有效地替换或补充受损的线粒体,为细胞提供能量,并恢复正常的生理功能。这种把细胞器作为药物的治疗方法目前已在动物实验和临床试验中得到了验证,可能不久将会得到应用的重视和进一步的推广应用。
参考文献:
[1]付爱玲. 靶向哺乳动物细胞线粒体的核酸转运[J]. 中国药理学通报, 2016,32(1):1-4.
[1]Fu A L. Targeting delivery nucleic acid into mammalian mitochondria[J].ChinPharmacolBull, 2016,32(1):1-4.
[2]Berridge M V, McConnell M J, Grasso C, et al. Horizontal transfer of mitochondria between mammalian cells: beyond co-culture approaches[J].CurrOpinGenetDev, 2016,38:75-82.
[3]McCully J D, Levitsky S, Del Nido P J, et al. Mitochondrial transplantation for therapeutic use[J].ClinTranslMed, 2016,5(1):16.
[4]Clark M A, Shay J W. Mitochondrial transformation of mammalian cells[J].Nature, 1982,295(5850):605-7.
[5]Katrangi E, D'Souza G, Boddapati S V, et al. Xenogenic transfer of isolated murine mitochondria into human rho0 cells can improve respiratory function[J].RejuvenationRes, 2007,10(4):561-70.
[6]Chang J C, Liu K H, Chuang C S, et al. Treatment of human cells derived from MERRF syndrome by peptide-mediated mitochondrial delivery[J].Cytotherapy, 2013,15(12):1580-96.
[7]Kitani T, Kami D, Matoba S, et al. Internalization of isolated functional mitochondria: involvement of macropinocytosis[J].JCellMolMed, 2014,18(8):1694-703.
[8]Kitani T, Kami D, Kawasaki T, et al. Direct human mitochondrial transfer: a novel concept based on the endosymbiotic theory[J].TransplantProc, 2014,46(4):1233-6.
[9]Shi X, Zhao M, Fu C, et al. Intravenous administration of mitochondria for treating experimental Parkinson's disease[J].Mitochondrion, 2017,34:91-100.
[10] Kesner E E, Saada-Reich A, Lorberboum-Galski H. Characteristics of mitochondrial transformation into human cells[J].SciRep, 2016,6:26057.
[11] Syn N, Wang L, Sethi G, et al. Exosome-mediated metastasis: from epithelial-mesenchymal transition to escape from immunosurveillance[J].TrendsPharmacolSci, 2016,37(7):606-17.
[12] Rustom A, Saffrich R, Markovic I, et al. Nanotubular highways for intercellular organelle transport[J].Science, 2004,303(5660):1007-10.
[13] Gerdes H H, Carvalho R N. Intercellular transfer mediated by tunneling nanotubes[J].CurrOpinCellBiol, 2008,20(4):470-5.
[14] Williams A R, Hare J M. Mesenchymal stem cells: biology, pathophysiology, translational findings, and therapeutic implications for cardiac disease[J].CircRes, 2011,109(8):923-40.
[15] Islam M N, Das S R, Emin M T, et al. Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury[J].NatMed, 2012,18(5):759-65.
[16] Zhang Y, Yu Z, Jiang D, et al. iPSC-MSCs with high intrinsic MIRO1 and sensitivity to TNF-alpha yield efficacious mitochondrial transfer to rescue anthracycline-induced cardiomyopathy[J].StemCellRep, 2016,7(4):749-63.
[17] Lu J, Zheng X, Li F, et al. Tunneling nanotubes promote intercellular mitochondria transfer followed by increased invasiveness in bladder cancer cells[J].Oncotarget, 2017,8(9):15539-52.
[18] Pasquier J, Guerrouahen B S, Al Thawadi H, et al. Preferential transfer of mitochondria from endothelial to cancer cells through tunneling nanotubes modulates chemoresistance[J].JTranslMed, 2013,11:94.
[19] Davis C H, Kim K Y, Bushong E A, et al. Transcellular degradation of axonal mitochondria[J].ProcNatlAcadSciUSA, 2014,111(26):9633-8.
[20] Hayakawa K, Esposito E, Wang X, et al. Transfer of mitochondria from astrocytes to neurons after stroke[J].Nature, 2016,535(7613):551-5.
[21] Honda H M, Korge P, Weiss J N. Mitochondria and ischemia/reperfusion injury[J].AnnNYAcadSci, 2005,1047:248-58.
[22] Cowan D B, Yao R, Akurathi V, et al. Intracoronary delivery of mitochondria to the ischemic heart for cardioprotection[J].PLoSOne, 2016,11(8):e0160889.
[23] Emani S M, Piekarski B L, Harrild D, et al. Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury[J].JThoracCardiovascSurg, 2017,154(1):286-9.
[24] Fu A, Shi X, Zhang H, et al. Mitotherapy for fatty liver by intravenous administration of exogenous mitochondria in male mice[J].FrontPharmacol, 2017,8:241.

