血浆游离DNA水平检测在胃癌诊断、转移中的应用价值
虞静芳,李翔翔,沈昊,沈国荣
(苏州市吴江区第一人民医院,江苏苏州 215000)
胃癌是消化系统的恶性肿瘤,20%的胃癌首诊时已发生转移。远端脏器的转移会严重降低手术和治疗效果,导致预后不良,5年生存率降低。近年来,有关游离DNA(cf-DNA)在恶性肿瘤诊断和预后中作用的研究越来越多。Kim等[1]研究发现,cf-DNA水平在胃癌组中显著高于对照组,提示cf-DNA定量在胃癌诊断中有一定意义。Umetani等[2]在乳腺癌的研究中发现,淋巴结转移越多,分期越晚,患者cf-DNA的水平越高,提示cf-DNA定量在判断肿瘤转移中可能也有一定的价值。推测cf-DNA检测可以作为诊断肿瘤和判断转移的一个敏感指标。本研究观察了胃癌患者血浆cf-DNA水平,探讨其在胃癌诊断及转移中的应用价值。现报告如下。
1 资料与方法
1.1 临床资料
收集2015年1月~2016年6月我院原发性胃癌初诊患者81例(胃癌组),其中男56例、女25例,年龄32~86岁、中位年龄65岁。其中无转移38例、仅腹部淋巴结转移26例、远端脏器转移17例。胃癌组临床检测指标中性粒细胞计数(NE#)3.55(2.48,4.95)×109/L,淋巴细胞百分比(LY%)0.28(0.22,0.33),平均血小板体积(MPV)10.70(9.95,11.70)fL,D-二聚体(D-D)0.56(0.17,1.32)mg/L,纤维蛋白原降解产物(FDP)2.20(1.00,5.50)mg/L,前白蛋白(PAB)198.80(157.28,227.53)mg/L,白球比(A/G)1.70(1.50,1.90),超敏C反应蛋白(hs-CRP)2.09(0.51,8.44)mg/L。按国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)胃癌TNM分期标准(2010)进行分期,入选病例均经组织病理学确诊。排除乙型肝炎、HIV等病毒感染性疾病,无系统性红斑狼疮、类风湿关节炎等免疫性疾病,无白血病等血液系统恶性肿瘤,无急性感染或创伤。选取同期门诊体检健康者43例作为对照组,其中男28例、女15例,年龄35~76岁、中位年龄65岁。胃癌组与对照组性别、年龄比较差异无统计学意义。本研究通过苏州市吴江区第一人民医院医学伦理委员会认证,受试者均知情同意。
1.2 血浆cf-DNA检测
[1].2.1血浆cf-DNA的提取分别取两组外周血3 mL于EDTA抗凝管中,1 600 r/min离心10 min,取上清后16 000 r/min离心10 min,取上清置于-80 ℃冰箱中保存备用。按照微量血液基因组提取试剂盒(德国QIAGEN公司,批号:151030957)说明书(QIAamp DNA Blood Mini Kit,Qiagen)提取cf-DNA,提取分装后置于-80 ℃保存。
[1].2.2标准品的制备提取人基因组DNA作为标准品,由紫外分光光度计测量其原始浓度,倍比稀释其浓度至400、40、4、0.4、0.04 ng/mL。内参采用ALU重复序列(115 bp),引物序列上游:5′-CCTGAGGTCAGGAGTTCGAG-3′,下游:5′-CCCGAGTAGCTGGGATTACA-3′。根据标准品的浓度梯度PCR仪自动分析绘制标准曲线,得出标准曲线的回归方程为Y=-3.368X+16.50,Ct值(循环数)与模板起始浓度对数值之间具有较好的线性关系(r=1)。
[1].2.3血浆cf-DNA定量检测于ABI V7DX实时荧光定量PCR仪上扩增提取的DNA,质粒标准品,阴性对照(ddH2O),PCR总体系为20 μL:SYBR Green Real Master Mix(北京天根公司,批号:P4412)9 μL,200 nmol/L上、下游引物各1 μL,ddH2O 7 μL,模板2 μL。反应条件:94 ℃预变性1 min;94 ℃ 30 s,62 ℃ 20 s,72 ℃ 30 s, 45个循环,86 ℃ 5 s。根据质粒标准品的标准曲线对115 bp的ALU内参基因进行定量分析,将Ct值带入回归方程得出各样本的起始模板浓度,每份样本均做3个复孔,结果取平均值。
1.3 血清CEA、CA724、CA199水平检测
用促凝管收集患者外周血标本3 mL,4 000 r/min离心10 min取血清进行检测,肿瘤标志物CEA、CA724、CA199测定采用雅培I2000-2仪器(美国雅培公司)。
1.4 统计学方法
采用SPSS19.0统计软件。不符合正态分布数据结果以中位数(M)及四分位数(P25,P75)表示,两组间比较采用非参数检验Mann-WhitneyU检验,多组间比较采用非参数检验Kruskal-WallisH检验;采用u检验比较CEA、CA724、CA199、cf-DNA对胃癌诊断效能的ROC曲线下面积;胃癌发生远处转移的危险因素分析采用单因素和多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组血浆cf-DNA、CEA、CA724、CA199水平比较
胃癌组血浆cf-DNA水平高于对照组(P<0.01)。胃癌组肿瘤标志物水平均高于对照组,但差异无统计学意义(P均>0.05)。见表1。

表1 两组cf-DNA、CEA、CA724、CA199水平比较[M(P25,P75)]
2.2 CEA、CA724、CA199、cf-DNA对胃癌的诊断效能比较
CEA、CA724、CA199、cf-DNA诊断胃癌的ROC曲线下面积分别为0.575、0.531、0.524、0.857,cf-DNA诊断效能较CEA、CA724、CA199高(u分别为4.799、5.670、5.446,P均<0.01),CEA、CA724、CA199两两比较差异无统计学意义。当cf-DNA值取6.09 ng/mL时,诊断胃癌的敏感性为0.679,特异性为0.932。
2.3 不同临床病理特征的胃癌患者血浆cf-DNA水平比较
见表2。
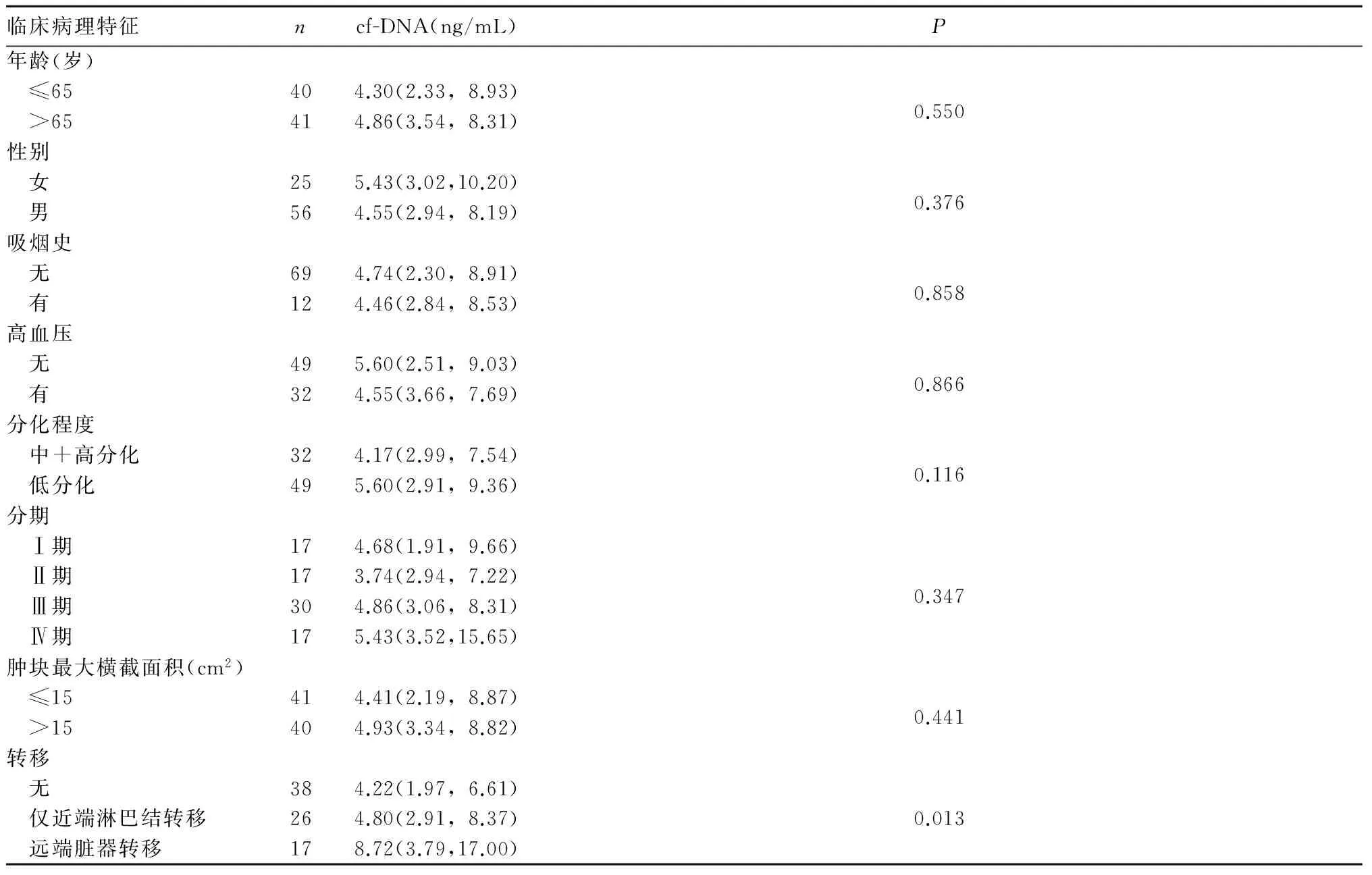
表2 不同临床病理特征的胃癌患者血浆cf-DNA水平比较[M(P25,P75)]
2.4 胃癌发生远处转移的危险因素
对单因素分析筛选出的有意义的因素进行多因素回归分析,结果表明,血浆cf-DNA水平(OR=4.178,95%CI:1.309~13.332)和PAB水平(OR=0.958,95%CI:0.971~1.000)是胃癌发生远处转移的独立危险因素(P均<0.05)。见表3。
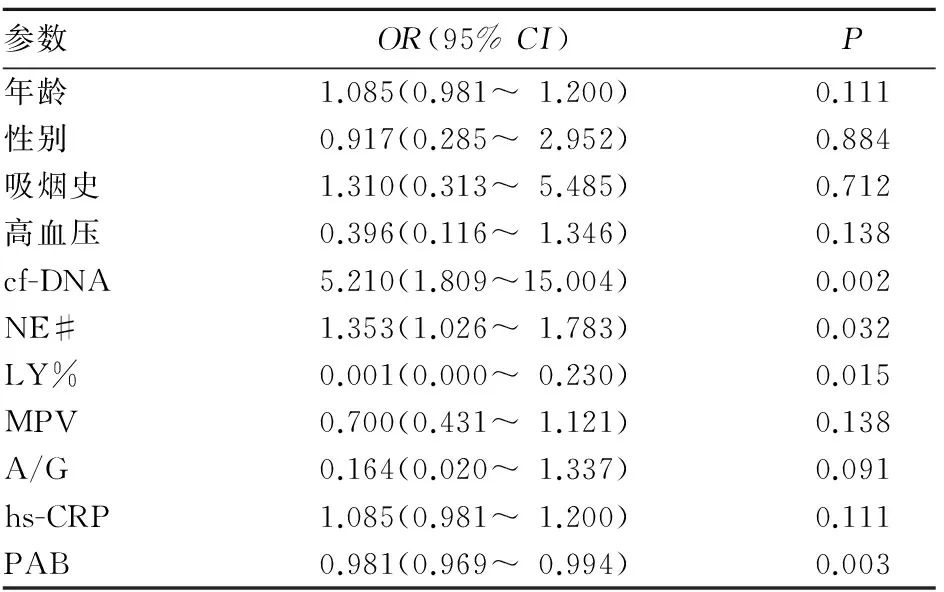
表3 胃癌发生远处转移的危险因素单因素分析结果
3 讨论
循环cf-DNA是存在于外周血液、脑脊液等体液中的胞外DNA。近年研究发现,血液中cf-DNA在自身免疫性疾病、炎症、恶性肿瘤等疾病中都一定程度地升高。研究发现,肿瘤患者血浆cf-DNA水平是正常人的3~5倍,并且这些cf-DNA存在与肿瘤相关的分子遗传学改变[1]。在血浆cf-DNA的定量方面,ALU内参基因由于较编码基因甲基化更少,也更稳定[2],因此本实验选用115 bp的ALU基因片段对胃癌患者血浆cf-DNA水平进行定量检测。本研究结果也表明,胃癌组cf-DNA水平高于对照组,与胃癌传统的肿瘤标志物CEA、CA199、CA724比较,其对胃癌的诊断价值最高,提示cf-DNA可以作为胃癌诊断潜在的肿瘤标志物。
胃癌转移患者的5年生存率一般低于20%[3~5],判断胃癌是否转移对患者的治疗和预后尤为重要。近年研究表明,外周血cf-DNA水平与癌症的远处转移密切相关。Agostini等[6]发现,cf-DNA水平与乳腺癌淋巴结转移相关;黄宝丽等[7]的研究也提示,cf-DNA水平与非小细胞肺癌远处转移有关。本研究进一步探讨了血浆cf-DNA水平和胃癌临床病理特征的关系,结果表明,cf-DNA水平在胃癌有无转移之间差异有统计学意义,在无转移、仅近端淋巴结转移、远端脏器转移三者之间随病情加重而升高。提示cf-DNA水平可能与机体的肿瘤负荷相关,转移情况越严重,肿瘤细胞释放或者机体肿瘤负荷状态下细胞坏死释放的DNA片段越多。可见,cf-DNA可作为判断胃癌转移的潜在肿瘤标志物。
相关研究表明,临床检测指标NE#[8,9]、LY%[8]、MPV[10~12]、D-D[13]、FDP[14]、A/G、PAB、hs-CRP[15]与机体肿瘤负荷相关,这些指标在伴和不伴转移的肿瘤患者中有显著差异,提示这些指标在胃癌的转移、侵袭和进展中可能有一定的应用价值。本研究同时检测分析这些指标,单因素回归分析结果表明,NE#、LY%、cf-DNA、PAB是胃癌远处转移的危险因素,远端脏器转移患者NE#显著升高。其可能的原因是胃癌转移引起肿瘤负荷增加,导致患者的慢性炎症加重,中性粒细胞升高[9]。肿瘤的侵袭扩散破坏机体的免疫功能可能是导致淋巴细胞降低的原因。进一步多因素回归分析结果表明,cf-DNA和PAB水平是胃癌发生远处转移的独立危险因素。PAB传统上是一种营养蛋白质指标,机体在急性炎症、恶性肿瘤等疾病状态下,PAB水平也会有不同程度的降低,但其在肿瘤进展和转移中的价值没有得到足够的认识。本研究提示二者或可以联合应用预测胃癌的远处转移,评价机体的肿瘤负荷。
综上所述,胃癌患者血浆cf-DNA水平升高,其可用于胃癌的诊断、转移判断。
参考文献:
[1] Kim K, Shin DG, Park MK, et al. Circulating cell-free DNA as a promising biomarker in patients with gastric cancer: diagnostic validity and significant reduction of cfDNA after surgical resection[J]. Ann Surg Treat Res, 2014,86(3):136-142.
[2] Umetani N, Giuliano AE, Hiramatsu SH, et al. Prediction of breast tumor progression by integrity of free circulating DNA in serum[J]. J Clin Oncol, 2006,24(26):4270-4276.
[3] 林益振,蒋相霞,陈翔,等.D-D、CRP联合肿瘤标志物检测对胃癌早期诊断的价值[J].中国卫生检验杂志,2014,24(5):695-698.
[4] 钟敏钰.血清骨钙素检测在女性肿瘤骨转移患者诊治中的临床意义[J].中国卫生检验杂志,2013,23(5):1225-1227.
[5] 张金锋.血清胃蛋白酶原及肿瘤标志物对胃癌的诊断价值[J].中国卫生检验杂志,2014,24(15):2229-2231.
[6] Agostini M, Enzo MV, Bedin C, et al. Circulating cell-free DNA: A promising marker of regional lymphonode metastasis in breast cancer patients[J]. Cancer Biomark, 2012,11(2-3): 89-98.
[7] 黄宝丽,李翔翔,王琳,等.非小细胞肺癌患者血浆游离DNA含量和完整性检测的临床意义[J].临床检验杂志,2015,33(8):602-605.
[8] Tomochika S, Iizuka N, Watanabe Y, et al. Increased serum cell-free DNA levels in relation to inflammation are predictive of distant metastasis of esophageal squamous cell carcinoma[J]. Exp Ther Med, 2010,1(1):89-92.
[9] Hussain SP, Harris CC. Inflammation and cancer: an ancient Link with novel potentials[J]. Int J Cancer, 2007,121(11):2373-2380.
[10] Kilincalp S, Ekiz F, Basar O, et al. Mean platelet volume could be possible biomarker in early diagnosis and monitoring of gastric cancer[J]. Platelets, 2014,25(8):592-594.
[11] Hsu HC, Lee YM, Tsai WH, et al. Circulating levels of thrombopoietic and inflammatory cytokines in patients with acute myeloblastic leukemia and myelodysplastic syndrome[J]. Oncology, 2002,63(1):64-69.
[12] 熊玉娟,胡朝晖,刘本荣.血浆循环DNA水平与血常规指标的关联分析[J].生物技术通讯,2012,23(4):577-580.
[13] Kwon HC, Oh SY, Lee S, et al. Plasma levels of prothrombin fragment F1+2, D-dimer and prothrombin time correlate with clinical stage and lymph node metastasis in operable gastric cancer patients[J]. Jpn J Clin Oncol, 2008,38(1):2-7.
[14] 陈明.纤维蛋白原降解产物和D-二聚体在大肠癌伴随肝转移中的诊断价值[J].中国肿瘤临床与康复,2014,21(3):273-275.
[15] 杨冉,韩金利.血清CRP水平与食管癌临床病理特征的相关性[J].中国实用医药,2015,10(17):56-57.

