Sphk1在舌鳞状细胞癌组织中的表达及其对舌癌细胞生物学行为的影响
张惠敏,吴德报,向旭,杨立,沈军
(1天津医科大学,天津300000;2天津市口腔医院)
口腔鳞状细胞癌(OSCC)在口腔癌中所占比例高达90%[1],其中又以舌鳞状细胞癌(TSCC)最常见。TSCC恶性度高、侵袭性强,患者预后差,5年生存率仅50%左右[2]。因此,迫切需要寻找新的高效的TSCC诊断与治疗分子标记物。鞘氨醇激酶(Sphk)是调节鞘脂代谢的关键因子,在人体中有Sphk1和Sphk2两种亚型,其中Sphk1具有癌基因特性,参与肿瘤形成,在多种肿瘤中过表达,并与患者的预后密切相关[3,4]。目前,关于Sphk1在TSCC发生发展过程中作用的报道较少。2016年5月~2017年4月,我们应用免疫组化法检测Sphk1在TSCC中的表达,并分析其表达水平与临床病理特征的关系,同时采用Sphk1抑制剂N,N-二甲基鞘氨醇(DMS)干预舌癌Tca8113P160细胞,观察其对舌癌细胞增殖、迁移及侵袭能力以及上皮间质转化(EMT)相关蛋白E-cadherin、N-cadherin表达的影响,探讨Sphk1在TSCC发生发展过程中的作用及机制。
1 资料与方法
1.1 临床资料
随机选取2006~2017年于天津市口腔医院行手术治疗的TSCC患者标本50例,口腔白斑病标本28例,同期切取的癌旁正常舌黏膜标本(距原发灶边缘≥1.5 cm)10例。TSCC患者术前均未行放化疗及其他辅助治疗,术后均经病理证实。根据UICC(2002)TNM分期标准确定临床分期,Ⅰ+Ⅱ期18例,Ⅲ+Ⅳ期32例。36例同期行颈淋巴清扫术,其中颈淋巴转移25例,均未发现远处器官转移。
1.2 细胞培养方法
舌癌Tca8113P160细胞由天津市口腔医院中心实验室传代保存。向细胞中加入含10%胎牛血清的RPMI-1640完全培养基,37 ℃、5% CO2培养箱内传代培养。收集对数生长期细胞用于实验。
1.3 TSCC、白斑及正常舌黏膜组织中Sphk1表达检测
采用免疫组化染色法。将TSCC、白斑及正常舌黏膜石蜡标本切片,经烘片、脱蜡至水后微波热修复抗原(枸橼酸抗原修复液),血清封闭30 min;加入一抗,4 ℃过夜;加二抗,DAB显色,PBS水洗终止显色;苏木素复染,封片,留镜检。高倍镜下,每张切片随机选取5个视野计阳性细胞数,取均值。根据阳性细胞百分比计分:<25%计1分,26%~50%计2分,51%~74%计3分,>74%计4分;根据细胞染色强度计分:未着色或呈淡黄色为0分,棕黄色为1分,棕褐色为2分;两项计分乘积0~3为低表达,4~8为高表达。以上工作由两位富有经验的病理医师采用双盲法判定。
1.4 细胞增殖能力观察
采用CCK-8法。取Tca8113P160细胞悬液,接种于96孔培养板,每组设6个复孔。细胞贴壁生长达孔底60%时,将细胞分为DMS组和对照组,DMS组加入5、10、20、50、100 μmol/L DMS,对照组加入无药物培养基,分别干预24、48、72 h,结束后,每孔加入10 μL CCK-8溶液,孵育2 h。另设空白对照组,加入培养基和CCK-8溶液,不加入细胞。使用酶标仪于450 nm波长处测定OD值。
1.5 细胞迁移、侵袭能力观察
采用Transwell实验。迁移实验:将Tca8113P160细胞按6×105/孔接种于6孔培养板,将细胞分为DMS组和对照组。以细胞24 h的DMS药物半抑制浓度(IC50)23.26 μmol/L作为DMS组的干预浓度,对照组加入无药物培养基。培养24 h后,加入胰酶消化重悬,调整细胞密度为2×105/mL。取200 μL接种于Transwell小室上室,下室加入500 μL含20%胎牛血清的培养基。培养24 h后取出小室,固定、染色,显微镜下随机选取10个视野计细胞数。侵袭实验:将Matrigel胶用RMPI-1640培养基按1∶8稀释,铺于Transwell小室的上室面,其余步骤同迁移实验。
1.6 细胞中Sphk1、E-cadherin、N-cadherin蛋白表达检测
采用Western blotting法。细胞接种于培养皿,将细胞分为DMS组和对照组,干预措施同Transwell实验。提取总蛋白,BCA法测定蛋白浓度;SDS-PAGE凝胶电泳,转PVDF膜;封闭1 h后加入一抗,4 ℃过夜,TBST洗膜;加二抗,室温孵育70 min;化学发光法显色,定影。Image J图像处理软件分析灰度值。目的蛋白相对表达量=目的蛋白条带灰度值/同一样本内参条带的灰度值。
1.7 统计学方法
2 结果
2.1 TSCC、白斑及正常舌黏膜组织中Sphk1表达比较
Sphk1主要表达于细胞胞质,阳性部位主要呈淡黄色、棕黄色至深褐色。Sphk1在TSCC、白斑及正常舌黏膜组织中的高表达率分别为62.0%、42.9%、0,TSCC组织高于白斑及正常舌黏膜组织(P均<0.01)。
2.2 不同临床病理特征患者Sphk1表达情况比较
临床分期Ⅲ+Ⅳ期、有淋巴结转移、T3+T4分期、中低分化程度患者的Sphk1高表达比例分别高于临床分期Ⅰ+Ⅱ期、无淋巴结转移、T1+T2分期、高分化程度患者(P均<0.05);不同性别、年龄、吸烟、饮酒情况患者Sphk1高表达比例比较差异无统计学意义(P均>0.05)。见表1。
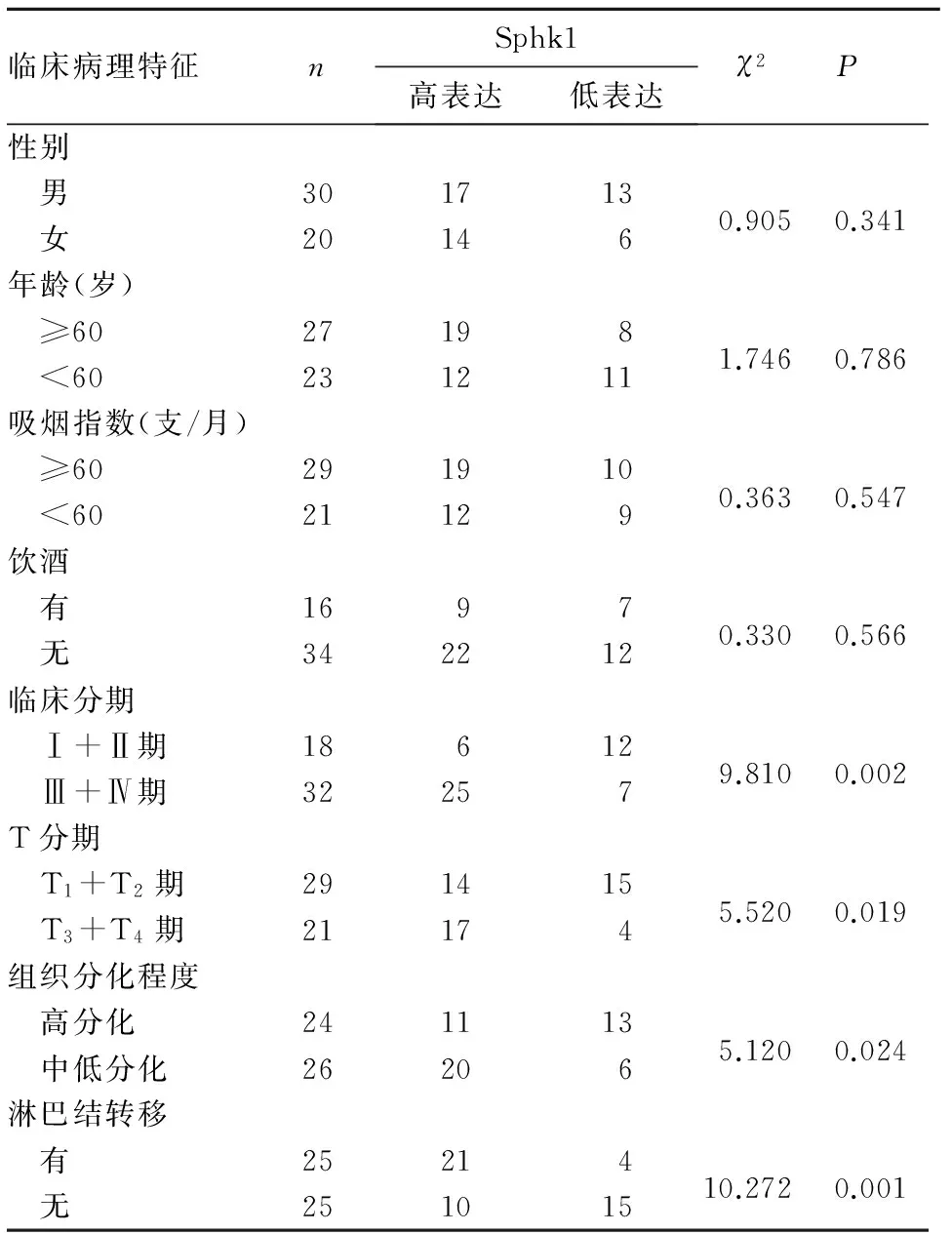
表1 不同临床病理特征患者Sphk1表达情况比较(例)
2.3 两组细胞增殖能力比较
DMS组24、48、72 h细胞增殖OD值均低于同期对照组(P均<0.05)。见表2。

表2 两组细胞OD值比较
注:与对照组比较,*P<0.05,**P<0.01。
2.4 两组细胞迁移及侵袭能力比较
迁移实验显示,DMS组穿膜细胞数为(176.17±19.75)个,对照组为(279.83±23.45)个;侵袭实验显示,DMS组穿膜细胞数为(128.00±13.78)个,对照组为(209.67±18.82)个。DMS组穿膜细胞数均较对照组减少(P均<0.01)。
2.5 两组细胞中Sphk1、E-cadherin、N-cadherin蛋白表达比较
与对照组相比,DMS组Sphk1、N-cadherin蛋白表达减少,E-cadherin蛋白表达增加(P均<0.05)。见表3。

表3 两组细胞中Sphk1、E-cadherin、N-cadherin蛋白表达比较
注:与对照组比较,*P<0.01。
3 讨论
研究发现,鞘脂具有信号调节作用,在肿瘤细胞代谢过程中发挥重要作用。目前,研究较多的鞘脂分子主要有神经酰胺(Cer)和鞘氨醇1-磷酸(S1P)。Cer主要抑制细胞增殖、促进细胞凋亡;而S1P与之相反,主要促进细胞增殖、抑制细胞凋亡。Cer与S1P在细胞内相互转化,并处于动态平衡,二者的平衡状态决定细胞的存亡,这种平衡状态被称为“鞘脂-变阻器”。Sphk1是鞘脂-变阻器的关键调控因子,可使Cer转化为S1P从而促进细胞存活[5]。大量研究表明,Sphk1具有癌基因特性,其活化与一系列肿瘤细胞生物学特性关系密切。过表达Sphk1的NIH3T3纤维组织母细胞在裸鼠中能够形成肿瘤[6];转染MCF-10A正常乳腺上皮细胞使其过表达Sphk1后,细胞的增殖和侵袭能力明显增强[7]。另外,敲除Sphk1基因可致实验鼠血液内S1P水平减低,干扰Akt-mTOR信号传导通路并显著抑制4-NQO的致癌作用[8];使用Sphk1抑制剂DMS或Sphk1 shRNA下调Sphk1表达均能显著抑制结肠癌细胞的增殖、迁移及侵袭能力[9]。以上研究表明,Sphk1在肿瘤的发生发展过程中发挥重要作用。目前有关TSCC与Sphk1关系的研究较少,Sphk1在TSCC发生发展中的作用及机制尚不清楚。
本研究结果显示,正常舌黏膜、白斑及TSCC组织中Sphk1的表达依次增强,且其高表达与TSCC患者的临床分期、淋巴结转移、T分期及组织学分级相关,说明随着TSCC恶性程度加剧,Sphk1表达水平升高。Li等[10]检测了142例鼻咽癌组织中Sphk1表达情况,发现有93例组织中Sphk1高表达,且其表达与肿瘤临床分期、T分期、淋巴结转移及远处转移和局部复发情况密切相关。Song等[11]发现,Sphk1在非小细胞肺癌原发灶中的表达水平较正常组织明显升高,且其表达随着肿瘤临床分期、T分期的增加和淋巴结转移而增强。本研究结果与其一致。提示Sphk1与TSCC的发生发展密切相关,其过表达可能导致细胞恶性转化。
本研究进一步从细胞水平探讨Sphk1对TSCC的作用及机制,采用Sphk1特异性抑制剂DMS抑制其表达,检测其表达下调对Tca8113P160细胞增殖、迁移及侵袭能力的影响。异常增殖是肿瘤细胞恶性生物学行为之一,Sphk1可通过诱导Cer转化为S1P进而促进肿瘤细胞增殖。本研究结果显示,Sphk1活性被DMS抑制后,Tca8113P160细胞的增殖能力减弱。Zhao等[12]发现,头颈癌JHU-22细胞中Sphk1活性被抑制后,细胞内Cer积聚,进一步抑制Bcl-2活化,促进肿瘤细胞凋亡,抑制细胞增殖。由此推测,舌癌细胞的增殖能力减弱可能与Sphk1活性被抑制后,细胞内Cer水平增高有关,但具体机制还有待进一步探讨。
侵袭及转移是TSCC细胞的主要特征之一,Sphk1在肿瘤细胞的侵袭和转移过程中发挥重要作用[13]。本研究结果显示,在迁移及侵袭实验中,Sphk1表达下调后,穿膜细胞数较对照组均减少,说明下调Sphk1表达后细胞的迁移及侵袭能力受到明显抑制。另外,EMT在OSCC侵袭及转移过程中起关键性作用。EMT发生的标志是上皮标记物E-cadherin的表达减少或丧失,伴随N-cadherin、Vimentin等间质标记物的表达上调[14]。Liu等[15]发现,过表达Sphk1的肝癌HepG2细胞可通过自噬溶酶体通路促进E-cadherin降解,增加N-cadherin表达,诱导EMT发生,进而促进细胞迁移及侵袭。诸葛春风等[16]采用DMS抑制结肠癌细胞Sphk1表达,发现Vimentin表达下调,而E-cadherin水平上调,细胞EMT发生逆转,同时削弱了细胞的迁移能力。由此推测,Sphk1下调介导的迁移、侵袭抑制作用可能与EMT相关。本研究显示,下调Sphk1表达后,EMT相关蛋白E-cadherin表达升高、N-cadherin表达下降。说明Sphk1下调介导的Tca8113P160细胞迁移及侵袭能力下降与EMT相关。
综上所述,Sphk1在TSCC组织中呈高表达,其表达下调后细胞的增殖、迁移和侵袭能力均受到抑制,其介导的细胞迁移和侵袭能力的降低可能与EMT相关。通过进一步探讨Sphk1在TSCC发生发展过程中的作用机制,有望为TSCC的诊断与治疗提供新的靶点。
参考文献:
[1] Bagan J, Sarrion G, Jimenez Y. Oral cancer: Clinical features[J]. Oral Oncol, 2010,46(6):414-417.
[2] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[3] Pitson SM, Powell JA, Bonder CS. Regulation of sphingosine kinase in hematological malignancies and other cancers[J]. Anti-cancer Agents Med Chem, 2011,11(9):799-809.
[4] Heernan-Stroud LA, Obeid LM. Sphingosine kinase 1 in cancer[J]. Adv Cancer Res, 2013,117:201-235.
[5] 张彩霞,何红伟,邵荣光.鞘氨醇激酶与肿瘤[J].药学学报,2013,48(7):971-978.
[6] Xia P, Gamble JR, Wang L, et al. An oncogenic role of sphingosine kinase[J]. Curr Biol, 2000,10(23):1527-1530.
[7] Zheng XD, Zhang Y, Qi XW, et al. Role of Sphk1 in the malignant transformation of breast epithelial cells and breast cancer progression[J]. Indian J Cancer, 2014,51(4):524.
[8] Shirai K, Kaneshiro T, Wada M, et al. A role of sphingosine kinase 1 in head and neck carcinogenesis[J]. Cancer Prev Res, 2011,4(3):454-462.
[9] Liu SQ, Su YJ, Qin MB, et al. Sphingosine kinase 1 promotes tumor progression and confers malignancy phenotypes of colon cancer by regulating the focal adhesion kinase pathway and adhesion molecules[J]. Int J Oncol, 2012,42(2):617-626.
[10] Li W, Tian Z, Qin H, et al. High expression of sphingosine kinase 1 is associated with poor prognosis in nasopharyngeal carcinoma[J]. Biochem Biophys Res Commun, 2015,460(2):341-347.
[11] Song L, Xiong H, Li J, et al. Sphingosine kinase-1 enhances resistance to apoptosis through activation of PI3K/Akt/NF-κB pathway in human non-small cell lung cancer[J]. Clin Cancer Res, 2011,17(7):1839-1849.
[12] Zhao Y, Ling ZQ, Hao YB, et al. MiR-124 acts as a tumor suppressor by inhibiting the expression of sphingosine kinase 1 and its downstream signaling in head and neck squamous cell carcinoma[J]. Oncotarget, 2017,8(15):25005-25020.
[13] Pan J, Tao YF, Zhou Z, et al. An novel role of sphingosine kinase-1 (SPHK1) in the invasion and metastasis of esophageal carcinoma[J]. J Transl Med, 2011,9:157.
[14] 徐香兰,韩冰,钟启平,等.RNA干扰沉默HIF-1α基因对舌癌Tca8113细胞侵袭和迁移的影响[J].山东医药,2013,53(43):5-8.
[15] Liu H, Ma Y, He HW, et al. SPHK1 (sphingosine kinase 1) induces epithelial-mesenchymal transition by promoting the autophagy-linked lysosomal degradation of CDH1/E-cadherin in hepatoma cells[J]. Autophagy, 2017,13(5):900-913.
[16] 诸葛春风,刘诗权,谭林,等.Sphk1和FAK对人结肠癌HCT116细胞上皮间质转化的影响[J].中国病理生理杂志,2016,32(3):439-444.

