乳酸菌对矮牵牛生长和生理性状的影响
周 游 ,李海梅 ,,赵金山 ,,邹晓霞
矮牵牛(Petunia hybrid a)属茄科(Solanaceae)碧冬茄属(Petunia),为常作一、二年生栽培的多年生草本,原产南美,现今在世界各地都有广泛栽培,花朵大而多,颜色丰富,花期较长,是优良的花坛和种植钵花卉[1]。近年来,矮牵牛的消费市场日趋活跃,以播种和扦插繁殖为主的繁殖方式造成了以矮牵牛为代表的速生花卉出现了品种退化的问题,越冬能力下降、形态畸变、花径变小等现象屡见不鲜,严重影响了花卉的观赏价值[2,3]。为提高其观赏性,化肥的施用量成倍增加,虽取得一定成效,但严重污染了环境,长远来看,亦不利于植物的持续栽培利用[4]。
乳酸菌是发酵糖类主要产物为乳酸的一类无芽孢、革兰染色阳性细菌的总称,凡是能从葡萄糖或乳糖的发酵过程中产生乳酸的细菌统称为乳酸菌[5]。乳酸菌作为益生菌,是公认的安全级(Generally Recognized as Safe,GRAS)菌株[6]。 研究发现,乳酸菌等菌肥对植物的生长及品质均有一定的促进作用[7-9]。考虑到乳酸菌等菌肥作用于植物机理的复杂性和多变性,虽已有一定数量的研究表明乳酸菌应用在农作物和水果等植物上,菌肥的作用效果明显,但将菌肥应用在提高花卉的观赏性方面的研究甚少。为此,试验研究不同浓度的乳酸菌制剂对矮牵牛生长和生理指标的影响,确定乳酸菌制剂施用的最适浓度范围,以期为矮牵牛观赏性状及品质的提升及乳酸菌新型复合肥料的施用与推广提供科学依据。
1 材料与方法
1.1 试验材料
以一年生矮牵牛为试验对象,采用盆栽,塑料花盆盆口直径15 cm,盆土配比为园土∶草炭=3∶1,每盆基质约1.0 kg,每盆栽植1株花苗。乳酸菌制剂选用产品“禾宜生”农作物专用微生物制剂,主要成分为乳酸菌及其代谢产物,活菌数≥1.0×109CFU/mL。
1.2 试验方法
采用盆栽试验,将浓度(肥水体积比)为1∶300、1∶500、1∶700、1∶900 的乳酸菌制剂浇施于矮牵牛根部,以清水处理的作对照,每个浓度处理8盆,共40盆,随机区组排列,其他养护管理措施均相同。
1.2.1矮牵牛生长指标的测定 浇施乳酸菌制剂约一个月后,于4月初开始测量矮牵牛各项生长指标。矮牵牛通过各项生理反应积累营养物质,这些物质会在其株高、冠幅、茎粗、最大单叶面积和开花数等指标上有所体现[10],故选择这些生长指标进行测定。
株高:用卷尺测量其基部到顶部之间的距离;冠幅:用卷尺测量植株两侧之间最宽的距离;茎粗:用游标卡尺在距离根部3 cm处测量其枝条的直径;最大单叶面积:选取植株上最大叶片,用Yaxin-1241便携式叶面积仪进行测定。
1.2.2矮牵牛生理指标的测定 叶绿素含量的测定采用乙醇-丙酮浸泡法[11];相对含水量的测定采用称重法;可溶性蛋白质含量的测定采用考马斯亮蓝G-250比色法[12];可溶性糖含量的测定采用蒽酮比色法[13]。
1.3 数据分析
采用Excel 2016和SPSS 22.0进行数据整理和分析,并用Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 乳酸菌对矮牵牛生长指标的影响
2.1.1对株高的影响 不同浓度乳酸菌制剂对矮牵牛株高的影响不同(图1),除浓度1∶700处理之外,其他各浓度乳酸菌制剂处理后的矮牵牛株高均明显高于对照。浇施乳酸菌制剂后,于4月3日首次测量矮牵牛株高,其中1∶900处理较CK提升了14.56%,达到11.80 cm,提升幅度最大,说明在生长前期,低浓度的乳酸菌制剂更有利于矮牵牛株高的增长。之后,随着矮牵牛生长的加快,对养分的需求逐渐增加,5月1日,浇施浓度为1∶300处理株高增长量最大,之后达到 19.90 cm,较对照组提升了 21.34%,浇施浓度为1∶500的试验组次之,较对照组提升了20.73%,浇施浓度为1∶700的处理株高增长量最小,低于对照组4.27%。不同浓度乳酸菌对矮牵牛株高的影响作用分别表现为 1∶300处理>1∶500处理>1∶900 处理>CK>1∶700 处理。
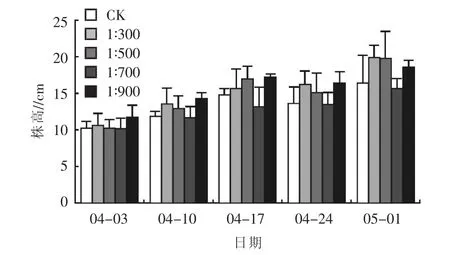
图1 不同浓度乳酸菌制剂对矮牵牛株高的影响
2.1.2对冠幅的影响 不同浓度乳酸菌制剂对矮牵牛冠幅的影响不同,如图2所示,冠幅的增长量整体表现为随着乳酸菌施用时间的延长而呈现出逐渐减缓的趋势。施用乳酸菌后,浇施浓度为1∶900的处理冠幅增长最大,达到13.20 cm。之后,随着乳酸菌施用时间的推移,各试验组的冠幅增长量总体上逐渐明显高于对照组。限于植物本身品种的生长特性,在试验后期,各组矮牵牛冠幅增长速率均有一定程度的减缓,而浇施乳酸菌制剂浓度为1∶500的处理冠幅并未出现停止增长的情况,达到测量日期内的最大值,为 17.20 cm,分别较对照组、1∶300 处理、1∶700处理和 1∶900 处理提升了 11.69%、8.18%、13.16%和15.44%。总体来看,不同浓度乳酸菌制剂对矮牵牛冠幅的影响作用表现为 1∶500处理>1∶700处理>1∶300 处理>1∶900 处理>CK。

图2 不同浓度乳酸菌制剂对矮牵牛冠幅的影响
2.1.3对茎粗的影响 不同浓度乳酸菌制剂对矮牵牛冠幅的影响不同,如图3所示,横向来看,浇施乳酸菌后,在第一次(4月3日)测定结果中,1∶700与1∶900处理的矮牵牛茎粗之间存在显著差异(P<0.05),而其他处理之间差异不显著。浇施浓度为1∶900的试验组茎粗最大,为0.528 cm。较对照组提升了22.79%。之后,CK组在之后的4个测量日期内均表现出较高水平。纵向来看,CK组除了在4月3日到4月10日期间段表现出较高的增长量,为28.37%,之后的3个日期增长幅度均较小,和1∶900试验组表现较为一致。而1∶500处理在整个测量周期内均保持良好平稳的增长情况,虽然在最终测量日期该组茎粗略低于CK,但增长势是各处理中表现最好的。
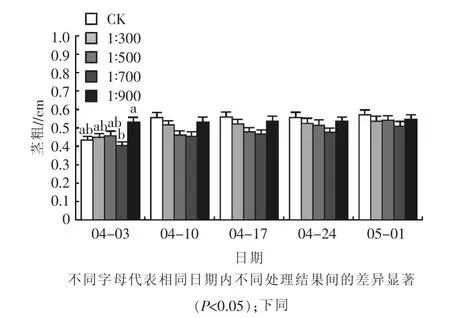
图3 不同浓度乳酸菌制剂对矮牵牛茎粗的影响
2.1.4对最大单叶面积的影响 乳酸菌对矮牵牛最大单叶面积的影响如图4所示,由图4可以看出,在第一次(4月3日)测定结果中,1∶900处理分别与CK 和 1∶700 处理存在显著差异(P<0.05);在第二次(4 月 10 日)测定结果中,1∶700 与 1∶900 处理的矮牵牛最大单叶面积之间存在显著差异,而其他处理之间差异不显著。浇施浓度为1∶900的处理单叶面积最大,且优势明显。说明在生长初期,浇施低浓度的乳酸菌制剂极有利于矮牵牛叶面积的增长。各处理最大单叶面积均在试验中期达到最大值,其中,1∶900处理最大单叶面积最大, 达到 1 466.64 mm2,其次为1∶500处理, 达到1 407.38 mm2, 分别较CK组 1 389.12 mm2提升了 5.58%和 1.31%,而 1∶300 处理的最大单叶面积最小,为1 002.88 mm2,且尚未达到最大值,说明高浓度的乳酸菌制剂反而不利于矮牵牛叶面积的增长。后期1∶500和1∶900处理最终最大单叶面积相似,分别为1 366.88 mm2和1 378.46 mm2, 分别较处理 1 271.90 mm2提升了 7.47%和8.38%。总体来看,不同浓度乳酸菌对矮牵牛最大单叶面积的影响作用分别表现为1∶900处理≥1∶500处理>CK>1∶700 处理>1∶300 处理。

图4 不同浓度乳酸菌制剂对矮牵牛最大单叶面积的影响
2.1.5对开花数的影响 开花数是衡量花卉观赏价值的重要指标之一[14,15]。不同浓度乳酸菌制剂对矮牵牛开花的影响不同,如图5所示,4月3日时各组矮牵牛花朵数为0,处于孕蕾期,4月3日到4月13日进入始花期,开花数排序为1∶900处理>1∶700处理>1∶500 处理=1∶300 处理>CK,故在始花期,浇施乳酸菌制剂较不浇施更有利于矮牵牛开花,浇施乳酸菌制剂的处理中,较低浓度的处理更有利于矮牵牛开花。从4月23日到5月3日,相较于上一测量日,每个浓度处理下的矮牵牛开花数均有增加,且浇施乳酸菌制剂浓度为1∶700的处理开花数最多,该优势一直持续到试验末期。不同浓度乳酸菌制剂对矮牵牛开花数量的影响作用分别表现为1∶700处理>1∶500 处理>1∶300 处理>1∶900 处理=CK。
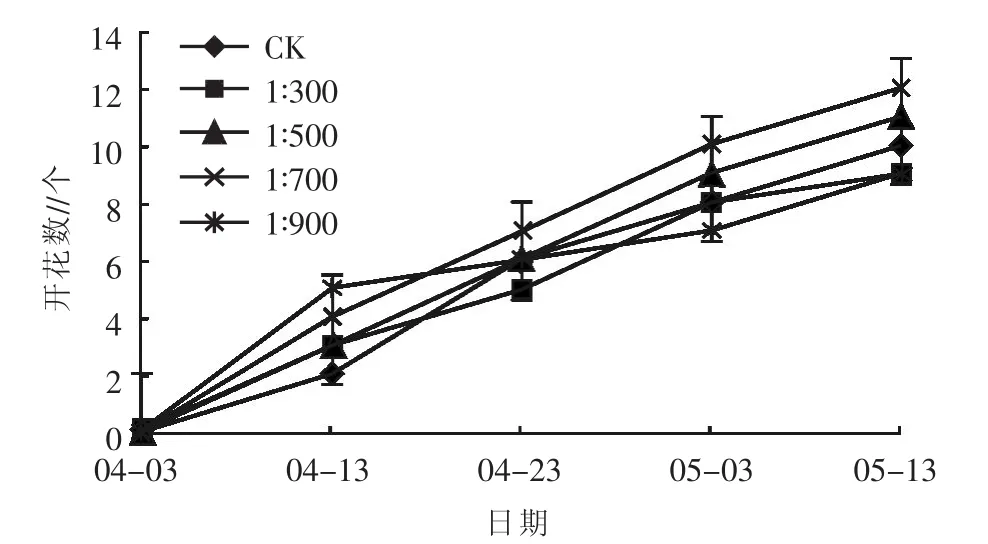
图5 不同浓度乳酸菌制剂对矮牵牛开花数的影响
2.2 乳酸菌对矮牵牛生理指标的影响
2.2.1对叶绿素含量的影响 叶绿素含量是植物营养状况的直接测量指标[16],不同浓度乳酸菌制剂对矮牵牛叶绿素含量的影响不同。如图6所示,同一日期不同浓度乳酸菌制剂处理的矮牵牛叶绿素含量不同。浇施乳酸菌制剂后,矮牵牛生长前期,经乳酸菌制剂处理的叶绿素含量较CK没有明显提高,之后提升效果逐渐增加。4月14日,浇施浓度为1∶300和1∶500的处理叶绿素含量较CK提升明显,分别提高了20.21%和26.25%。之后各浓度乳酸菌制剂处理较CK的优势更加明显,其中,1∶500处理叶绿素含量提升最大,达到 13.730(SPAD),其次为 1∶300 处理,达到 13.430(SPAD),二者分别较 CK(SPAD)提升了 25.27%和 22.54%。提升效果最低的 1∶900 处理也达到 12.160(SPAD),较对照组提升 10.95%,充分说明浇施乳酸菌制剂比不浇施更有利于矮牵牛叶绿素含量的增加。
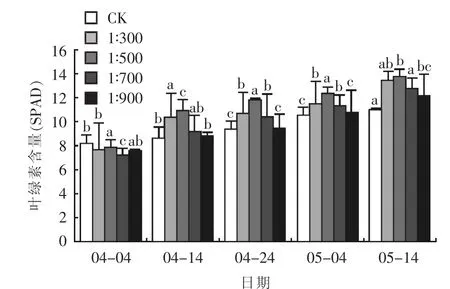
图6 不同浓度乳酸菌制剂对矮牵牛叶绿素含量的影响
2.2.2对相对含水量的影响 叶片相对含水量是指干旱胁迫时叶片含水量与该叶片在水分充分膨胀时所持最大含水量的比值[17]。经过乳酸菌制剂处理后的矮牵牛叶片相对含水量均高于CK(图7),但差别不明显,仅在浇施乳酸菌后的生长初期(4月4日),1∶500处理与其他乳酸菌处理组差异显著,之后差异不显著。矮牵牛的相对含水量随乳酸菌制剂浓度的升高而降低。生长后期,1∶700处理相对含水量提升效果最明显,而1∶500处理矮牵牛相对含水量增加迅速,效果亦十分明显。不同浓度的乳酸菌制剂对矮牵牛相对含水量的影响效果为1∶700处理>1∶900处理>1∶500 处理>1∶300 处理>CK。
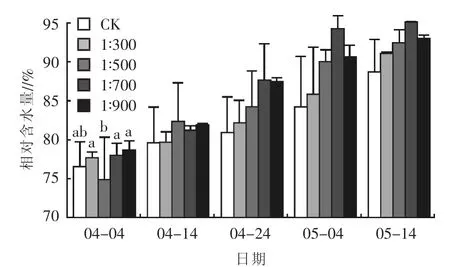
图7 不同浓度乳酸菌制剂对矮牵牛相对含水量的影响
2.2.3对可溶性蛋白质含量的影响 结果表明,同一日期不同浓度乳酸菌制剂处理的矮牵牛可溶性蛋白质含量存在差异。如图8所示,浇施乳酸菌制剂后首次测量,浇施浓度为1∶300的处理可溶性蛋白质含量最高,说明在矮牵牛生长初期,高浓度乳酸菌有利于其可溶性蛋白质的积累。4月14日浇施浓度为1∶500的处理可溶性蛋白质含量提升明显,其后的每一次测量均为最高,最终达到 24.68 μg/g,较对照组提升32.69%,说明在整个生长过程中,浇施浓度为1∶500的处理最有利于矮牵牛可溶性蛋白质含量的增加。其次为浇施浓度为1∶300的处理,在整个测量周期内该组矮牵牛的可溶性蛋白质含量亦均保持在较高水平,最终达到23.15μg/g,较对照组提升了24.46%。不同浓度的乳酸菌制剂对矮牵牛可溶性蛋白质含量的影响效果为 1∶500处理>1∶300处理>1∶700 处理>1∶900 处理>CK。
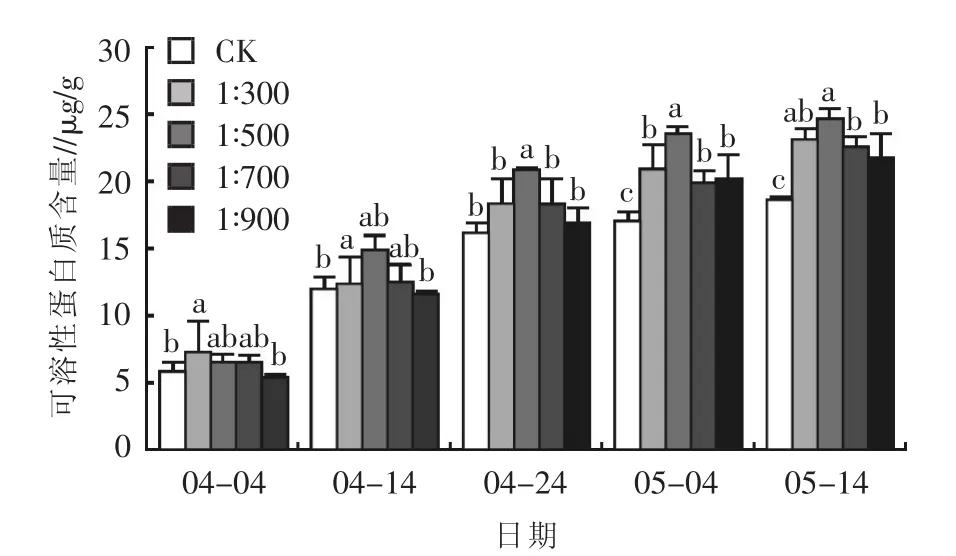
图8 不同浓度乳酸菌制剂对矮牵牛可溶性蛋白质含量的影响
2.2.4对可溶性糖含量的影响 低温胁迫下,可溶性碳水化合物是植物抗寒性的重要保护物质之一[18]。可溶性碳水化合物的积累与植物对低温的适应有关,大量试验表明,非结构性碳水化合物的总量与许多植物冬季抗寒性之间存在着重要关系[19]。不同浓度乳酸菌对矮牵牛可溶性糖含量的影响不同(图9),同一日期不同浓度乳酸菌制剂处理的矮牵牛可溶性糖含量均有不同。在生长初期,浇施浓度为1∶500处理的矮牵牛试验组表现出良好的长势,在各处理组中效果最佳,为 0.303 0 μg/g,其次为 1∶700处理,说明在初期中低浓度的乳酸菌制剂有利于矮牵牛可溶性糖的积累。4月14日,浇施浓度为1∶900处理可溶性糖含量较前一测量日期有明显提升,达到 0.481 5 μg/g,较 CK 提升 35.83%,较前一测量日期提升了76.37%。中后期,浇施浓度为1∶300和1∶500的两试验组可溶性糖含量均有明显提升,其中1∶500 处理提升最快,最终达到 0.772 5 μg/g,较 CK提升了 23.01%, 其次为 1∶300处理, 达到 0.736 5 μg/g,较对照组提升了 17.27%。总体表明,不同浓度乳酸菌制剂对矮牵牛可溶性糖含量的影响效果为1∶500 处理>1∶300 处理>1∶700 处理>1∶900 处理>CK。
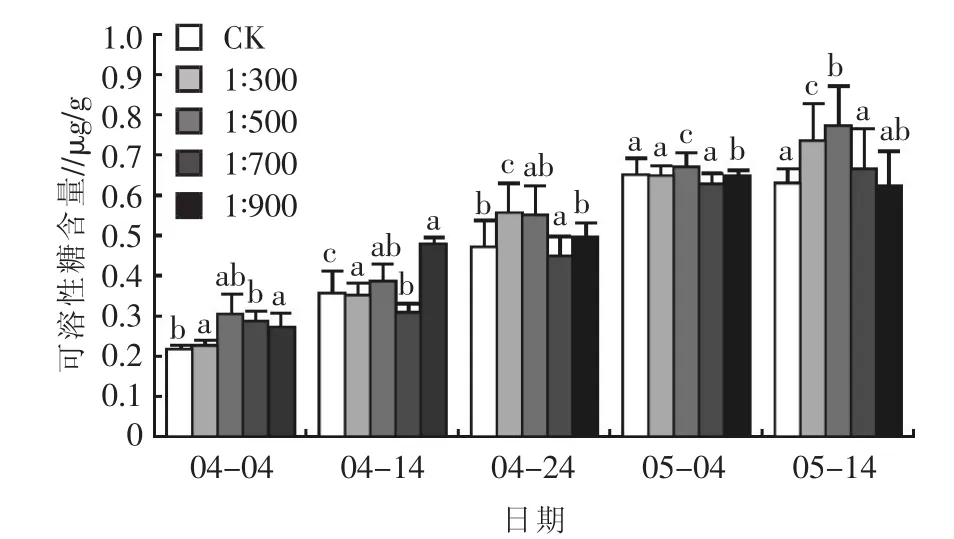
图9 不同浓度乳酸菌制剂对矮牵牛可溶性糖含量的影响
3 小结与讨论
不同浓度的乳酸菌对不同时期的矮牵牛作用效果不同,如在生长初期,施加1∶700浓度的乳酸菌制剂对矮牵牛的开花数和相对含水量的促进效果在各试验组中最佳,而中后期,施加1∶500浓度的乳酸菌促进效果最佳,推测形成这种现象的原因可能是不同时期的植株对养分的吸收、分配及利用程度不同所致[20]。又如冠幅、叶绿素含量、可溶性蛋白质含量和可溶性糖含量方面,在生长初期,浇施浓度为1∶500的处理平均数据要远高于浓度为1∶300处理,而后期,这两组差距逐渐减小,说明虽然浇施乳酸菌制剂使矮牵牛的各项指标均有一定程度的提升,但并非一成不变,随着添加乳酸菌制剂时间的推移,矮牵牛部分指标增加幅度相对减小,且浇施一段时间后个别指标出现不再升高或升高减缓的趋势。
结果表明, 浓度为 1∶500~1∶300 的乳酸菌制剂最有利于矮牵牛的生长及生理性状的提升,总体表现为 1∶500 处理>1∶300 处理>1∶700 处理>1∶900 处理>CK。在实际生产中,可根据不同的育种目标或生产需求来确定栽植矮牵牛所适合的乳酸菌施用方案。此外,针对不同植物继续筛选适合对应植物生长的抗性强的优异菌株,拓展乳酸菌的应用领域,具体还有待进一步研究。
参考文献:
[1] 张玉红.北方地区矮牵牛栽培技术[J].现代化农业,2017(4):38-39.
[2]宋美华.矮牵牛栽培及周年开花的养护技术[J].宁夏农林科技,2013(10):12-13,26.
[3]谢海霞,王恒玺,魏 萍.浅谈花卉品种退化原因及良种保存方法[J].科技视界,2013(20):184,192.
[4]朱有勇,李成云,李正跃,等.农业生物多样性控制病虫害发展研究[A].2012-2013 植物保护学学科发展报告[C].2014.26.
[5]尹胜利,杜 鉴,徐 晨.乳酸菌的研究现状及其应用[J].食品科技,2012(9):25-29.
[6] TRIAS R,BAÑERAS L,MONTESINOS E,et al.Lactic acid bacteria from fresh fruit and vegetables as biocontrol agents of phytopathogenic bacteria and fungi[J].International Microbiology,2008,11(4):231-236.
[7]邵秀丽.复合微生物菌剂制备及在大蒜生产中的应用[J].河南农业学,2010,6(1):21-23.
[8]苏小青,陈慧洁,冯丽贞,等.不同配比菌肥对土壤养分及油茶生长的影响[J].福建林学院学报,2014(4):356-361.
[9]田俊岭,贺广生,王 军,等.生物菌肥对盆栽烟草品质的影响[J].广东农业科学,2016(7):11-17.
[10]李辉.生产无公害农产品的新兴肥料——酵素菌肥[J].河北农业,2003(2):21.
[11]刘家尧,刘 新.植物生理学实验教程[M].北京:高等教育出版社,2013.
[12]王学奎,黄见良.植物生理生化实验原理与技术[M].北京:高等教育出版社,2006.
[13]张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.
[14]龙文秀,林 杉,游 捷,等.施氮量和CAU31系列控释肥对矮牵牛生长和观赏品质的影响[J].河北农业大学报,2004,27(5):22-26.
[15]佘旭东,刘凤君,宋 英,等.蓝藻沼液对矮牵牛生长和观赏品质的影响[J].江苏农业科学,2013,41(12):186-188.
[16]任 锦.光质和CO2浓度对紫背天葵生长及其抗氧化成分合成的影响[D].西安:西北工业大学,2015.
[17]王爱玲,蔡军社,白世践,等.葡萄砧木叶片含水量和相对含水量的研究[J].天津农业科学,2013(2):16-18.
[18]王 丹,宣继萍,郭海林,等.结缕草的抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白季节动态变化的关系[J].草业学报,2011(4):98-107.
[19] LEVITT J.Responses of Plants to Environmental Stress[M].New York:Academic Press,1980.
[20]焦 峰.马铃薯氮素吸收分配特性及高效利用生理机制研究[D].黑龙江大庆:黑龙江八一农垦大学,2012.
——矮牵牛

