云芝发酵液中α-半乳糖苷酶酶学特性的研究*
杜 芳,雷 萍,吴亚召,张文隽,王贺祥
(1.陕西省微生物研究所,陕西 西安 710043;2.农业生物技术国家重点实验室,中国农业大学生物学院,北京 100193)
α-半乳糖苷酶 (α-galactosidase,EC 3.2.1.22)也称蜜二糖酶,是1种外切水解酶,可催化水解非还原性末端以α-1,6键结合的半乳糖苷化合物[1],可用于水解豆科植物中α-半乳糖苷低聚糖,消除豆类制品中由此引起的抗营养因子,促进其他营养物质的消化和吸收,目前广泛应用于饲料业、食品业、医药工业等领域[2]。α-半乳糖苷酶大量分布于植物、微生物和动物中,由于来源不同其理化性质差异也较大[3]。因此,为保证获得高活性和高稳定性的α-半乳糖苷酶,需要研究一些外在因素对该酶的影响,如最适pH和最适反应温度等,并尽量提高酶活稳定性,确保后期应用到食品、饲料等领域中时可以稳定食用。本文研究云芝(Trametes versicolor) 发酵液中α-半乳糖苷酶的理化性质,并筛选提高其酶活稳定性的共溶剂,为该酶制剂的有效生产和应用提供理论依据。
1 材料和方法
1.1 菌种与试剂
云芝菌种来自于陕西省微生物研究所微生物资源中心第三研究室;底物对硝基苯基α-D-吡喃半乳糖苷(pNPG) 购自Sigma公司(N0877);其它试剂均为分析纯。
1.2 培养基
斜面培养基:综合PDA;种子培养基:豆粨粉2%、KH2PO40.1%;发酵培养基:豆粨粉2%、半乳糖1%、MgSO40.1%、KH2PO40.05%。
1.3 云芝液体发酵
1.3.1液体种子培养
250mL三角瓶装入50mL液体种子培养基,加入10粒~15粒玻璃珠,高压灭菌后接入云芝斜面菌种,于26℃、180 r·min-1振荡培养5 d,获得云芝液体菌种。
1.3.2液体发酵培养
250mL三角瓶装入50 mL液体发酵培养基,高压灭菌后接入3%(v·v-1)的云芝液体菌种,于26℃、180 r·min-1振荡培养7 d,获得云芝发酵液。
1.4 α-半乳糖苷酶活性的测定
1.4.1粗酶液的制备
将云芝发酵液用高速冷冻离心机离心10 min得上清液,发酵菌丝球经研磨后低温抽提2 h,离心后得上清液,将2次离心获得的上清液合并即为粗酶液。
1.4.2酶活测定
吸取0.1mL适当稀释后的粗酶液,再加入浓度为10mmol·L-1的底物对硝基苯基α-D-吡喃半乳糖苷0.1 mL,于40℃恒温振荡反应10 min,加入0.8 mL的Na2CO3溶液振荡混匀,终止酶反应,于波长405 nm处测定吸光值。
酶活力单位定义:在一定条件下,每分钟生成1μmol对硝基苯酚的酶量为1个酶活力单位(U)[4]。
1.5 α-半乳糖苷酶理化性质的测定
1.5.1最适pH和pH稳定性的测定
最适pH的测定:配制不同pH的磷酸氢二钠-柠檬酸缓冲液(pH分别为2.0,3.0,4.0,5.0,6.0,7.0、8.0),测定α-半乳糖苷酶在不同pH缓冲液中的酶活,将酶活力最高值计为100%,计算各pH下的α-半乳糖苷酶相对酶活,并绘制酶活变化曲线。
pH稳定性的测定:将适当稀释的酶液与不同pH的磷酸氢二钠-柠檬酸缓冲液在常温下孵育2 h,测定α-半乳糖苷酶活性,测得的最高酶活值计为100%,计算不同pH下的酶活存留率。
1.5.2最适反应温度和温度稳定性的测定
最适反应温度的测定:在不同温度20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃下反应,然后测定α-半乳糖苷酶活性,测得的最高酶活值计为100%,计算不同反应温度下α-半乳糖苷酶的相对酶活,并绘制酶活变化曲线。
温度稳定性的测定:将适当稀释的酶液分别在不同温度下孵育2 h,在最适反应温度下进行酶活性测定,以未保温(4℃)时测得的酶活值计为100%,计算不同反应温度下的酶活存留率。
1.5.3金属离子对α-半乳糖苷酶活性的影响
使用去离子水配制 20 mmol·L-1的 K+、Ca2+、Cu2+、Mg2+、Cd2+、Mn2+、Hg2+、Pb2+、Zn2+、Fe2+、Al3+和Fe3+金属离子溶液,再与α-半乳糖苷酶溶液混合,使各金属离子溶液终浓度分别达到1.25 mmol·L-1、2.5 mmol·L-1、5 mmol·L-1和 10 mmol·L-1,于 4℃下孵育2 h,然后测定酶活性,以去离子水与α-半乳糖苷酶溶液混合测得的酶活计为100%,计算各种金属离子溶液中α-半乳糖苷酶的相对酶活。
1.5.4不同保护剂对α-半乳糖苷酶的影响
以一定比例将不同类型的保护剂与α-半乳糖苷酶溶液混合,60℃水浴1 h,取出后立即冰浴,稀释一定倍数测定酶活力,以未保温(4℃)、未加保护剂测得的酶活值计为100%,计算不同保护剂下的酶活存留率。
2 结果与分析
2.1 pH对云芝α-半乳糖苷酶活性的影响
pH对云芝α-半乳糖苷酶活性的影响结果,见图1。
从图1A中可以看出,当缓冲液pH为3.0时α-半乳糖苷酶活性最高,以此计为100%;pH为2.0时α-半乳糖苷酶相对酶活性为60%,此时并未失活;随着缓冲液pH的不断升高,α-半乳糖苷酶活性持续降低,当缓冲液pH为7.0时,相对酶活降低为10%,pH8.0时几乎检测不到酶活。从图1B中可以看出,α-半乳糖苷酶溶液在缓冲液pH2.0~5.0范围内酶活存留率依然在80%以上,说明α-半乳糖苷酶极耐酸性。因此,云芝发酵液中α-半乳糖苷酶的最适pH为3.0,在酸性条件下酶活稳定性最好。

图1 云芝α-半乳糖苷酶pH的特性Fig.1 pH properties ofα-galactosidase from Trametes versicolor
2.2 温度对云芝α-半乳糖苷酶活性的影响
反应温度对云芝α-半乳糖苷酶活性的影响结果见图2。
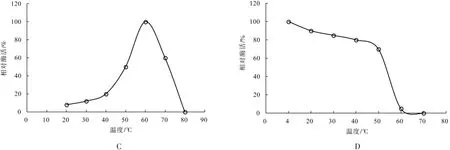
图2 云芝α-半乳糖苷酶温度的特性Fig.2 Temperature properties ofα-galactosidase from Trametes versicolor
从图2C可以看出,随着反应温度的逐渐升高,α-半乳糖苷酶活性持续增加,在60℃时酶活达到最大值,以此计为100%;随着反应温度升至70℃时,α-半乳糖苷酶相对酶活降低为60%,当温度为80℃时蛋白质发生了变性,此时几乎检测不到酶活。
从图2D中可以看出,当温度低于50℃时α-半乳糖苷酶活性比较稳定,相对酶活在70%以上;随着温度的升高酶活性有降低的趋势,在60℃时酶活性迅速降至5%,反应温度为70℃时α-半乳糖苷酶已失去活性。因此,云芝发酵液中α-半乳糖苷酶的最适反应温度为60℃,而且在较大温度范围内酶活性依然保持稳定,说明该酶耐热性较好。
2.3 金属离子对云芝α-半乳糖苷酶活性的影响
不同浓度的不同种类金属离子对云芝α-半乳糖苷酶活性的影响结果见表1,以未加金属离子测得的酶活计为100%。
从表1中可以看出,Fe3+对酶活性的抑制作用最强,当离子浓度为10 mmol·L-1时几乎检测不到酶活,Fe3+浓度降低至1.25 mmol·L-1时酶活性才恢复到68%;Pb2+对酶活性的抑制作用也较强,当其浓度为10mmol·L-1时酶活性降低至13%,随着Pb2+浓度的逐渐减小,对酶活的抑制作用也随之降低;Cd2+、Cu2+、Hg2+对α-半乳糖苷酶活性也有一定的抑制作用,酶活性降低20%~50%,Ca2+、Mg2+、Zn2+和Fe2+等离子对α-半乳糖苷酶活性影响不明显。
2.4 不同保护剂对云芝α-半乳糖苷酶热稳定性影响
不同保护剂对云芝α-半乳糖苷酶活性的影响结果见表2。

表1 金属离子对α-半乳糖苷酶活性的影响Tab.1 Effect ofmetal ion onα-galactosidase
从表2中可以看出,除添加山梨酸钾不利于α-半乳糖苷酶的热稳定性以外,其它保护剂均对α-半乳糖苷酶热稳定性有较好的保护效果,酶活保留率均高于对照组(54.18%);其中保护效果最好的是甘露醇,其次是海藻糖、蜜二糖、棉籽糖、L-半胱氨酸、甘油和黄原胶等。
从表2中还可以看出,同一种保护剂不同浓度对α-半乳糖苷酶热稳定性的保护作用也不同,添加浓度2 mmol·L-1的甘露醇、海藻糖、乳糖、抗坏血酸、棉籽糖、蜜二糖、L-半胱氨酸、CaCl2·2H2O、白蛋白、NaCl和明胶,酶活保留率高于添加浓度1 mmol·L-1;添加浓度 1mmol·L-1巯基乙醇效果好于添加浓度2 mmol·L-1,添加10%甘油酶活保留率高于20%,其次是0.2%黄原胶、0.3%黄原胶。
3 讨论
通过对云芝发酵液中α-半乳糖苷酶酶学性质的研究发现,α-半乳糖苷酶最适反应pH为3.0,并且极耐酸性,在pH2.0~5.0之间酶活性依然保持在80%以上;最适反应温度为60℃,在低于60℃条件下该酶稳定性良好,但是随着温度上升至60℃,酶活性骤然降低,说明随着温度的升高,蛋白质已经开始变性丧失活性,但是在很大温度范围内(20℃~70℃)酶活性依然保持稳定,说明该酶是1种耐热的α-半乳糖苷酶。
金属离子对云芝α-半乳糖苷酶的影响结果显示,Pb2+和Fe3+对其酶活性有较强的抑制作用,随着金属离子浓度的升高,抑制作用越来越明显,Cd2+、Cu2+、Hg2+致使α-半乳糖苷酶活性降低20%~50%,其他金属离子对该酶活性的抑制作用不明显。

表2 不同保护剂对α-半乳糖苷酶热稳定性的影响Tab.2 Effectof different protective agents on the thermostabilityofα-galactosidase
酶成品中常需要加入糖类、甘油、多元醇、氨基酸及其衍生物等共溶剂,以改变酶溶液的热力学性质,提高酶的稳定性,保存酶活[5]。本文研究发现在云芝α-半乳糖苷酶溶液中加入几种不同的共溶剂,对α-半乳糖苷酶热稳定性都有较好的保护效果,其中效果最好的是甘露醇,其次是海藻糖、蜜二糖、棉籽糖、L-半胱氨酸、甘油和黄原胶等;不同浓度保护剂对α-半乳糖苷酶热稳定性的保护作用不同,添加浓度2 mmol·L-1的甘露醇、海藻糖、乳糖、抗坏血酸、棉籽糖、蜜二糖、L-半胱氨酸、CaCl2·2H2O、白蛋白、NaCl和明胶,酶活保留率高于添加浓度 1 mmol·L-1;添加浓度 1 mmol·L-1巯基乙醇效果好于添加浓度2mmol·L-1,10%甘油酶活保留率高于20%,其次是0.2%黄原胶、0.3%黄原胶。保护云芝α-半乳糖苷酶稳定性的共溶剂的筛选,可为提高该酶生产和储存中酶活稳定性提供一定的应用价值。
参考文献:
[1]杨志强,师昆景,于锋.饲用α-半乳糖苷酶酶活稳定性的研究[J].饲料工业,2011,32(14):26-29.
[2]杨冠东,刘芳,李荷.α-半乳糖苷酶的研究进展概况[J].现代食品科技,2006,22(3):275-279.
[3]赵晴潇,魏群.产α-半乳糖苷酶菌株的筛选、酶学特性和固定化研究[J].东北电力大学学报,2015,35(3):77-81.
[4]Rezessy-SzabóJM,Nguyen QD,Hoschke Á,et al.A novel thermostableα-galactosidase from the thermophilic fungusThermomyces lanuginosusCBS 395.62/b:Purification and characterization[J].Biochimica Et Biophysica Acta General Subjects,2007,1770(1):55-62.
[5]苏俊,张国政,刘忠华,等.蛋白质在分离纯化中保持稳定的方法及应用[J].天津轻工业学院学报,2002(1):21-24.

