玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究
姚彦坡 丁 丹 张友青 常晓娇 董李学 张立田 杜瑞焕 孙长坡
(唐山市畜牧水产品质量监测中心1,唐山 063000) (湖北省黄冈市农产品质量安全检测中心2,黄冈 435400) (河北省迁安市植保站3,迁安 063000) (国家粮食局科学研究院4,北京 100037)
玉米是我国主要粮食作物,同时也是重要的饲料原材料。玉米在生长、储藏和转运过程中容易受到霉菌毒素的污染,特别是黄曲霉毒素,这将严重影响到玉米农产品的质量安全。如何解决玉米霉菌毒素污染问题,已成为一个亟待解决的世界性难题。黄曲霉毒素是由黄曲霉或寄生曲霉产生的次生真菌代谢产物,是一类理化性质相当稳定、结构极其相似的剧毒性、高致癌性和高污染性真菌毒素[1],每年给玉米、水稻、油菜、小麦、大豆及花生等农作物的生产带来高达数百亿美元损失[2,3]。人或家畜食用受黄曲霉毒素污染的农产品后会导致机体病变,严重者甚至死亡。因此,加强玉米、水稻、花生等农产品中黄曲霉毒素污染的防控刻不容缓。
黄曲霉毒素对玉米的污染主要发生在储藏时期,但黄曲霉菌对玉米的侵染主要发生在田间生长时期,因此,防控好黄曲霉菌对田间玉米的侵染至关重要。目前,对玉米生长时期黄曲霉菌侵染的防治没有理想的措施,主要以化学防治为主。由于化学防治污染环境,防治成本较高,并且导致大量的农产品药残问题,所以,寻找一种对人体健康、对环境友好的防控措施势在必行。生物防治是近年来发展速度较快的一种病害治理措施,由于不污染环境、防病机理多样、杀菌谱广、不影响农产品品质,因而备受广大研究人员和科技人员青睐[4]。目前,国内玉米内生拮抗菌的研究主要针对玉米根腐病和纹枯病等病害,对黄曲霉菌侵染及毒素污染的研究鲜有报道。本实验以黄曲霉菌及毒素为研究对象,从健康的玉米籽粒中分离内生细菌,并采用活体方法筛选拮抗细菌,研究其抗菌活性,以期为玉米黄曲霉毒素污染的防控瓶颈问题的解决探索新的途径。
1 材料与方法
1.1 材料
1.1.1供试菌株及植物 黄曲霉菌株由中国农业科学院油料作物研究所质标室提供。内生细菌自河北、山东、山西及吉林等黄曲霉菌侵染严重病区的健康玉米籽粒内分离获得。
1.1.2供试玉米品种:郑单958,唐山市农业科学院玉米研究室提供。
1.2 实验方法
1.2.1内生细菌的分离、纯化及保存
玉米内生细菌的分离参照Dey等[5]方法。选取河北、山东、山西及吉林等省份健康玉米籽粒,将称重后的玉米籽粒在无菌三角瓶中用3%次氯酸钠溶液浸泡5~8 min,用无菌水冲洗5次,最后沥干水分。用镊子夹住玉米籽粒后用无菌剪刀将其分成3~5等份,把玉米放入LB培养基平板中,然后放置于28 ℃恒温培养箱进行培养,认真观察菌落每天的生长情况,及时挑取生长良好、特征明显的单菌落进一步纯化培养,在LB斜面培养基上4 ℃条件下保藏备用。
1.2.2玉米内生拮抗细菌的离体筛选
采用平板对峙培养方法对黄曲霉菌及其毒素拮抗细菌进行筛选。将预先准备好的黄曲霉菌菌碟置于PDA平板中央,然后用高温灭过菌的牙签挑取内生细菌,距病原菌2 cm处,等距离对称接种到PDA平板上,放置于28 ℃培养箱中黑暗培养3~7 d,观察抑菌带的有无及大小,重复3次。选出抑菌带较宽的内生细菌菌株在玉米籽粒上进行活体抑菌实验复筛及计算抑制率。抑制率=(对照菌落半径-处理菌落半径)/对照菌落半径×100%。
1.2.3黄曲霉菌拮抗菌的活体筛选
拮抗菌发酵液的准备:利用接种针把离体实验中具有抑菌活性的拮抗菌株单菌落转移至装有100 mL LB培养液的三角瓶中,于28 ℃培养条件下,150 r/min振荡培养1 d。利用移液枪吸取1 mL培养液转接至装有100 mL LB培养液的三角瓶中,28 ℃培养条件下、150 r/min振荡培养2 d,获得拮抗菌株的发酵液。拮抗细菌的活体筛选:把上述发酵2 d的拮抗菌发酵液(1.0×106cfu/mL)和培养7 d生长旺盛的黄曲霉菌孢子悬液(1.0×106cfu/mL)分别浸泡玉米籽粒30 min,每板30粒玉米,放入光照培养箱培养10 d。培养箱培养条件为:温度28 ℃,湿度70%~80%,光照为12 h黑暗/12 h光照。以不浸菌液为空白对照,每处理设3次重复。
1.2.4田间防控实验
采用随机设计,3个重复,每个小区的面积为15 m×3 m。将60 kg·hm-2(1×108孢子·g-1)生防制剂于玉米播种时随肥料施入,设置化学防治方法(70%甲基托布津可湿性粉剂)及对照,农药的施用方法同生防制剂。玉米收获后每组随机调查5个点,每点10株。调查生防菌对黄曲霉毒素污染的控制效果。抑毒率/%=(对照毒素量-处理毒素量)/对照毒素量×100%;促生率/%=(对照株高-处理株高)/对照株高×100%。
1.2.5内生拮抗细菌菌株B 42-3的鉴定
常规鉴定方法参见文献[6]。
16S rDNA PCR扩增及序列测定: 采取试剂盒的方法对生防菌基因组DNA进行提取。扩增细菌菌株的16S rDNA所用引物为:27 F(5、-AGAGTTTGATCCTGGCTCAG-3、)和1 492 R(5、-CTACGGCTA CCTTGTTACGA-3、)。PCR反应体系:10×Taq反应缓冲液 5μL,dNTP(10 mM each)lμL,引物27 F (10 μmol/L) 1 μL,引物1 492 R (10 μmol/L) 1 μL,模板DNA10 pmol,TaqDNA聚合酶 (μmol/L)0.25 μL,Dd H2O 50 μL。扩增条件:98 ℃ 为5 min;95 ℃为35 s,55 ℃为35 s,72 ℃为l min,35个循环;72 ℃为8 min。琼脂糖凝胶电泳并回收目标DNA片段,由上海派诺森生物科技公司进行测序;测序结果用BLAST软件在GenBank数据库中进行同源性比对,对生防菌株进行鉴定。
1.2.6上清液和过滤液制备
取一环LB斜面上活化后的生防菌B42-3于100 mL LB培养液的三角瓶中,于37 ℃培养条件下,160 r/min振荡培养48 h后,制备成以下处理液:上清液,培养液在12 000r/min下离心10 min,取上清,用0.22 μm细菌过滤器过滤后得到无菌的过滤液。蛋白粗提液:培养液在4 ℃条件下,于12 000 r/min离心150min,弃沉淀。在上清液中加入固体硫酸铵至70%饱和度,在4 ℃条件下,于10 000 r/min离心20 min,4 ℃静置过夜,弃上清液,沉淀用磷酸缓冲液悬浮(pH 7.0,1/25体积10 mmol/L),然后用0.22 μm细菌过滤器过滤掉可能存在的细菌。
1.2.7生防菌代谢产物对黄曲霉菌菌丝生长的影响
取黄曲霉菌菌悬液1×1065 mL,放入温度降到35 ℃左右PDA三角瓶中(100 mL/350 mL),摇晃2 min后,均匀的倒入培养皿中。用打孔器在PDA平板周围等距离打3个孔,用移液枪分别加入100 μL上清液、过滤液、蛋白粗提液、冷冻上清液及冷冻过滤液(-4 ℃条件下保藏24 h),30 ℃培养3~5 d,在对照黄曲霉菌落长满平板时,检测各处理抑菌圈的半径,计算出生防菌代谢产物对黄曲霉菌生长的抑制率。每个处理3个重复。
1.2.8黄曲霉毒素污染HPLC法检测
黄曲霉毒素含量测定可分为3个步骤:萃取、净化、检测。首先使用甲醇∶水(6∶4)溶液对其进行萃取,然后使用免疫亲和柱对样品残留毒素进行净化提取(方法参照免疫亲和柱使用说明书);最后用HPLC(柱后光化学衍生)对净化提取得到的样品进行检测。HPLC检测条件为流动相甲醇∶水=1∶1;流速1 mL/min;色谱柱C18 150 mm×4.6 mm,0.5 μm;激发波长360 nm,检测波长440 nm;进样量20 μL。
计算出生防细菌对黄曲霉毒素的抑毒率。抑毒率=(对照毒素含量-处理毒素含量)/对照毒素含量×100%。
2 结果与分析
2.1 玉米内生细菌的分离
根据菌落形态、颜色及出现的先后差异,从表面彻底消毒的籽粒放置的平板中挑取不同菌落进行纯化,得到350株内生细菌。分离结果为,河北玉米籽粒中分离到内生菌105株;山东玉米籽粒中分离出内生菌95株;山西玉米籽粒中分离出内生菌152株;吉林玉米籽粒中分离出内生菌148株。研究结果显示,不同省份区域的玉米籽粒中分离到的细菌数量明显不同。
2.2 内生拮抗细菌的筛选
2.2.1离体筛选
将分离获得的350株内生细菌通过对峙培养法进行拮抗筛选,挑选10株对黄曲霉菌有较强抑制作用的细菌进行下一步的实验研究(表1)。10株生防菌的抑菌带宽均在8 mm以上,拮抗效果在35%以上。其中菌株B42-3对黄曲霉菌的抑制率最高,达85.5%,其次为菌株B12-3和B96-1,抑制率分别达到75.5%和70.5%。

表1 生防菌株对黄曲霉菌的拮抗作用
2.2.2活体拮抗筛选
将离体条件下具有较强拮抗作用的内生细菌在玉米籽粒上进行活体筛选(表2),结果表明获得的内生细菌在籽粒上表现出较好防病效果,对黄曲霉菌毒素污染抑制率较高。较好的8株拮抗细菌对黄曲霉菌的抑制效果达42.5%~75.0%,其中,菌株B42-3对黄曲霉菌的防效最高,达75.0%。抑毒效果较好的菌株分别为B42-3、B12-3及B88-5,抑毒率分别为70.5%、68.5%及62.7%,有进一步研究的价值。

表2 拮抗菌对黄曲霉菌的防治效果及抑毒率
2.3 田间实验
田间实验结果显示,生防菌对黄曲霉毒素污染具有较好的抑制效果。菌株B42-3促生率及抑毒率最高,分别达到4.5%及75.5%,该菌株有进一步研究的价值,生防潜力巨大,其次是菌株B96-1,促生率及抑毒率分别达到3.5%及60.5%(表3)。

表3 拮抗菌对黄曲霉菌产毒抑制率及对花生促生效果
2.4 菌株B42-3的鉴定
2.4.1常规鉴定
观察发现,菌株B42-3在LB培养基上菌落圆形,边缘不规则,表面较光滑,不产色素;菌体杆状,大小为(0.9~1.2) μm×(2.8~3.2) μm;革兰氏染色阳性;产芽孢,芽孢椭圆形;具有运动性,证明该菌株为芽孢杆菌(Bacillussp.)。
菌株生理生化测定结果见表4。菌株B42-3接触酶反应、葡萄糖、甘油、D-木糖、淀粉水解、山梨醇、甘露糖、果糖、肌醇及纤维二糖均为阳性,氧化酶、D-阿拉伯糖等实验均为阴性。参照文献[8-9],发现该菌株与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的特征基本相似,因此判断该菌株可能为解淀粉芽孢杆菌。

表4 菌株B42-3的生理生化特征
注:“+”为阳性反应,“-”为阴性性反应。
2.4.2菌株B42-316S rDNA的序列分析
以菌株B42-3基因组DNA为模板,通过PCR扩增得到该菌株1.48 kb左右的16S rDNA。测序结果表明该菌株16S rDNA序列长度为1 477 bp。BLAST分析发现菌株B42-3与解淀粉芽孢杆菌菌株EF176773关系最紧密,同源性达到100%。结合菌株B42-3形态特征及生理生化指标测定等鉴定结果,可将菌株B42-3鉴定为解淀粉芽孢杆菌。并将该菌株的16S rDNA序列提交到NCBI中登记注册,序列接受号为FJ597542。
2.5 菌株B 42-3代谢物对黄曲霉菌的影响
实验结果表明,生防菌培养液对黄曲霉菌菌丝生长的抑制作用很强,所筛选菌株抑制率均为100%;生防菌的上清液和冻上清抑菌率均在75%以上,其中B42-3抑菌率最强,分别达到97.5%和95.4%,其次是B96-1,达到95.3%和93.2%;生防菌过滤液和冻过滤抑菌率均在75%以上,其中B42-3抑菌率最强,分别达到95.5%和94.3%,其次是B96-1,达到92.0%和93.5%;生防菌蛋白粗提液对黄曲霉菌也有较强的抑制作用,其中B42-3抑菌率最强,达到88.3%,其次为菌株B12-3和B96-1,抑菌率达到85.5%和70.6%(表5)。
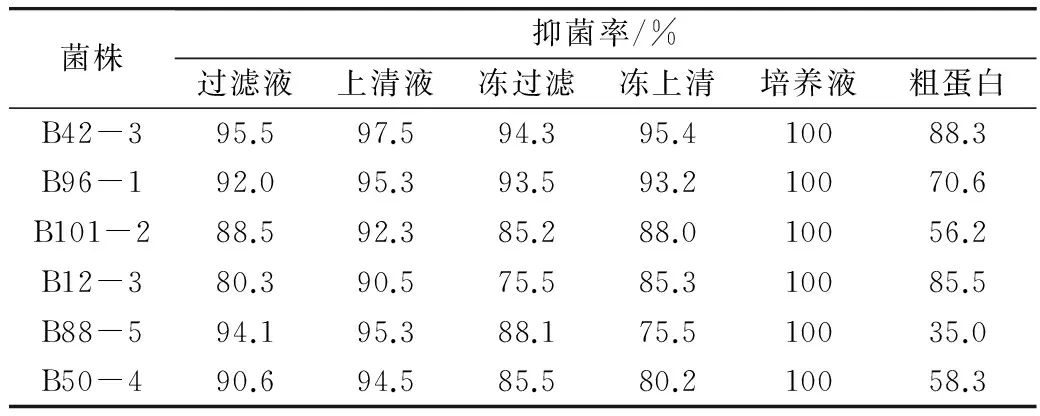
表5 生防菌代谢产物对黄曲霉菌生长的抑制作用
3 讨论与结论
黄曲霉毒素是目前已知的一种自然界最强致癌物,由于能对粮油产品造成污染,对人畜造成严重危害,因而备受关注[7-9]。目前,世界各国虽然已经研发和推广了一些毒素污染防控措施,但效果并不理想,存在一定的局限性和不足。人民希望能开发出一种对毒素污染防治效果较好、对环境无污染和对人畜安全的技术和措施,因而,生物防治逐渐受到技术人员和科研人员的青睐[10-12]。本课题组从我国不同产区玉米籽粒中分离内生有益微生物,创建生防菌高效筛选体系,筛选高效抑制黄曲霉菌生长及黄曲霉毒素合成的生防细菌,选择抑菌抑毒能力较强的生防菌株进行生防机制研究。
植物体是一种微生态环境,内生多种对植物生长有益的微生物。内生细菌是植物体内重要的微生物种群,生存空间稳定,不易受外界环境条件影响,可以在植物体内繁殖和生长,成为一种有潜力的生防菌而加以利用[13-14]。本研究从我国不同玉米产区的健康玉米籽粒中分离到350株内生细菌,其中有8株对玉米黄曲霉菌有较强的拮抗作用,经室内实验和田间实验,菌株B42-3对黄曲霉毒素污染的抑制率可达70%以上,具有较好的开发应用潜力。菌株B42-3发酵滤液、上清液及蛋白粗提液对黄曲霉菌的菌丝生长和孢子萌发具有较强的抑制活性。研究结果表明内生细菌B42-3可通过分泌抗菌物质,来抑制黄曲霉菌丝生长和分生孢子萌发及毒素污染。但其解毒机制、对环境中微生物种类和区系影响、定殖能力、对玉米品质与防病作用的关系有待进一步深入探索和研究。
[1]LIU X. Strengthen research work of exposure and control of mycotoxin [J]. Chinese Journal of Preventive Medicine, 2006, 40: 307-308
[2]PAL K, GARDENER B. Biological control of plant pathogens [J]. The plant health instructor, 2006, 17: 2-8
[3]Dorner J W. Biological control of aflatoxin contamination of crops [J]. Toxin Reviews, 2004, 23(2): 425-450
[4]李强,李小林,黄羽佳,等. 偏肿栓菌内生木霉菌菌株18-21抑菌效果研究[J].微生物学杂志,2016,36(1):17-21
LI Q, LI X L, HUANG Y J, et al.Biocontrol effect of trichoderma viridescens strain 18-21 screened from fruiting bodies of trametes gibbosa[J]. Journal of Microbiology, 2016,36(1):17-21
[5]DEY R, PAL K K, BHATT D M et al. Growth promotion and yieid enhancement of peanut (Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria[J]. Microbiological Research, 2004, 159(4): 371-394
[6]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001
DONG X Z, CAI M Y. Common bacteria identification manual[M].Beijing:Science press, 2001
[7]JI X L, LU G B, GAI Y P. Biological control against bacterial wilt andcolonization of mulberry by an endophytic Bacillus subtilis strain[J]. FEMS Microbiology Ecology,2008,65(3):565-573
[8]KIRK G D, BAH E, MONTESANO R. Molecular epidemiology of human liver cancer: Insights into etiology, pathogenesis and prevention from The Gambia[J]. Carcinogenesis, 2006, 27: 2070-82
[9]GROOPMAN J D, KENSLER T W, WILD C P. Protective interventions to prevent aflatoxin-Induced carcinogenesis in developing countries [J]. Annual Review of Public Health, 2008, 29: 187-203
[10]WU F, KHLANGWISET P. Health economic impacts and cost-effect tiveness of aflatoxin reduction strategies in Africa: Case studies in biocontrol and postharvest interventions[J]. Food Additives and Contaminants, 2010, 27: 496-509
[11]LIU Y, WU F. Global burden of aflatoxin-induced hepatocellular carcinoma: A risk assessment[J]. Environmental Health Perspectives, 2010, 118: 18-24
[12]EGMOND V, DRAGACCI S. Liquid chromatographic method for aflatoxin M1 in milk[J]. Methods in Molecular Biology, 2001, 157: 59-69
[13]TEKINSEN K, EKEN H S. Aflatoxin M1 levels in UHT milk and kashar cheese consumed in Turkey[J]. Food and Chemical Toxicology, 2008, 46: 3287-3289
[14]KIRK G D, BAH E, MONTESANO R. Molecular epidemiology of human liver cancer: Insights into etiology, pathogenesis and prevention from The Gambia[J]. Carcinogenesis, 2006, 27: 2070-82.

