玉米赤霉烯酮对大鼠睾丸支持细胞凋亡蛋白释放的影响及NAC的保护效应
薛画眉, 郭宏元, 王光光, 邹 辉, 袁 燕, 顾建红, 刘学忠, 刘宗平,2, 卞建春,2
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
玉米赤霉烯酮(zearalenone,简称ZEA)在全世界动物饲料和人类粮食中普遍存在,它主要是由镰刀菌污染而产生的一种非甾体雌激素类霉菌毒素[1]。据报道,玉米及饲料中ZEA的超标能够引起公猪性欲下降,血清中睾酮含量急剧降低,导致睾丸的病理性萎缩,精子发生障碍,甚至出现雌性化等病变[2]。睾丸支持细胞(sertoli cell,简称SC)在雄性动物精子发生过程中发挥着不可或缺的作用,精子的发生障碍与睾丸支持细胞受损密切相关。睾丸支持细胞是众多环境污染物作用于雄性生殖系统的靶细胞[3]。靶向破坏睾丸支持细胞将导致生精细胞快速、大量非生理性死亡[4]。因此,研究ZEA对睾丸支持细胞的损害作用及其机制,对揭示ZEA雄性生殖毒性机制具有重要作用。本试验以不同浓度的ZEA处理大鼠原代睾丸支持细胞24 h,观察ZEA对睾丸支持细胞线粒体凋亡蛋白Cyt C、AIF释放的影响和NAC对ZEA引起的睾丸支持细胞凋亡率及凋亡相关蛋白表达变化的影响,为揭示ZEA的雄性生殖毒性机制及ZEA中毒的防控提供理论依据。
1 材料与方法
1.1 试验动物
18~21 d 清洁级Wistar大鼠(由扬州大学比较医学中心提供)。
1.2 主要试剂
玉米赤霉烯酮,购自美国Sigma公司;胎牛血清(FBS)、DMEM/F-12培养基等试剂,购自美国Gibco公司;胰蛋白酶等试剂,购自美国Amresco公司;L-谷氨酰胺、青链霉素等试剂,购自美国Boston Biomedical公司;AnnexinV-FITC/PI细胞凋亡试剂盒,购自美国BD公司; Bax、Bcl-2、Cyt C、AIF、cleaved-Caspase-3、cleaved-Caspase-9等单克隆抗体和辣根过氧化物酶(HRP)标记山羊抗兔IgG,均购自美国CST公司;硝酸纤维素膜,购自美国Pall Corporation公司; BCA蛋白浓度测定试剂盒,购自中国碧云天生物技术研究所;预染蛋白分子量标准和ECL化学发光底物检测试剂盒,购自美国Thermo公司;其他试剂均为国产分析纯。
1.3 大鼠原代支持细胞的分离与培养
取18~21 d Wistar雄性大鼠,脱颈处死后,无菌操作取出双侧睾丸,置于预冷的无菌磷酸缓冲盐溶液(PBS)中并转移至超净工作台内操作。用预冷的PBS将睾丸冲洗3遍后,将睾丸置于直径100 mm的玻璃平皿中,用眼科镊撕去周围脂肪组织及精索,再用眼科剪和眼科镊小心剥去白膜及内部较大血管,并用眼科镊轻轻将曲细精管拉散,置于0.25%胰蛋白酶溶液中,密封后在水浴摇床中于150 r/min 37℃消化15 min至组织碎块呈线索状,加入等体积含血清PBS溶液终止消化,800 r/min、4 ℃ 离心10 min。弃去上清液体,加入0.5%胶原酶溶液,密封后在水浴摇床中于150 r/min 37 ℃消化15 min,至酶液呈黏液状,加入等量含10%FBS的DMEM/F-12培养基终止消化,用100目的网筛进行过滤,将滤液于800 r/min、4 ℃离心 10 min。离心后用DMEM/F-12培养基重悬,重复清洗3次即可,于5%CO2、37 ℃条件下进行培养。对支持细胞的纯化采用低渗处理法[5],细胞培养24 d后,吸去培养基,用PBS清洗1次后,加入pH值为7.4的20 mmol/L Tris-HCl 处理3 min,吸去处理液,用PBS清洗3次,加入含10%胎牛血清(FBS)的DMEM/F-12培养基继续培养。
1.4 细胞染毒和线粒体及胞浆中AIF、Cytc C蛋白的制备
以不同浓度(0、5、10、20 μmol/L)ZEA处理睾丸支持细胞24 h后,用0.25%胰酶消化5 min,离心收集细胞不少于1.0×107个(1 200 r/min,5 min,4 ℃),用4 ℃预冷PBS将细胞洗涤2次。加入300 μL Mito-Cyto Buffer重悬细胞,将细胞悬液移入玻璃匀浆器中,研磨80次(4 ℃冰上操作)。将匀浆液转移至4 ℃预冷的1.5 mL EP离心管中,离心(12 000 r/min,10 min,4 ℃),沉淀即为线粒体,上清为胞浆蛋白;将上清收集至1.5 mL EP离心管中。沉淀中加入 100 μL 线粒体裂解缓冲液,于冰上裂解30 min,离心(12 000 r/min,10 min,4 ℃),收集上清,即得线粒体蛋白,用BCA法测胞浆蛋白及线粒体蛋白浓度,-80 ℃保存备用。
1.5 NAC对ZEA致睾丸支持细胞凋亡的影响
以每孔1.0×105个细胞的密度接种于六孔板中,添加NAC(0、20 μmol/L ZEA,100 μmol/L NAC,20 μmol/L ZEA+100 μmol/L NAC)处理24 h后,用AnnexinV-FITC/PI细胞凋亡双染试剂盒检测SC细胞凋亡情况。分别设空白组(未加染料)、PI单染组、FITC单染组和处理组(PI和FITC双染)。预先将10×Binding Buffer 加DDW稀释成1×Binding Buffer,备用;用0.25%胰酶消化3 min,收集细胞(1 500 r/min,5 min,4 ℃)预冷1×PBS洗涤细胞,离心后加入100 μL 1×Binding Buffer 重悬细胞,加入AnnexinV-FITC和PI各5 μL单独或联合作用,37 ℃避光反应15 min,200目尼龙网过滤,在1 h内用流式细胞仪检测细胞凋亡情况。
同样方法添加NAC处理24 h后(分组同上),收集染毒后的睾丸支持细胞,用预冷的PBS洗涤2次,用细胞裂解液冰浴裂解细胞30 min,超声波细胞破碎仪裂解30 s,12 000 r/min 离心10 min取上清,用BCA法进行蛋白定量,-80 ℃ 保存备用,以测定调控凋亡蛋白Bcl-2、Bax、cleaved-Caspase-9和cleaved-Caspase-3等的表达量。
1.6 Western Blot法检测凋亡相关蛋白的表达
用蛋白免疫印迹法(Western Blot)检测以上保存样品的凋亡相关蛋白Cyt C和AIF的释放量及Caspase-3、Caspase-9的蛋白表达水平,同时检测Bcl-2、Bax蛋白表达水平。
蛋白样品上样10 μL/孔,Bench Marker 5 μL,其余孔内加10 μL 1×Loading Buffer,浓缩胶140 V、20 min,分离胶 110 V、100 min,根据marker指示,确定停止时间。置于电转液中,转膜120 V,90 min。用5%脱脂奶粉封闭2 h,TBST洗2次,吸尽液体后,加入稀释好的一抗(表1),4 ℃孵育过夜;隔日回收一抗,用TBST洗涤5次,每次5 min,加入稀释好的二抗,室温孵育2 h,用TBST洗涤5 次。
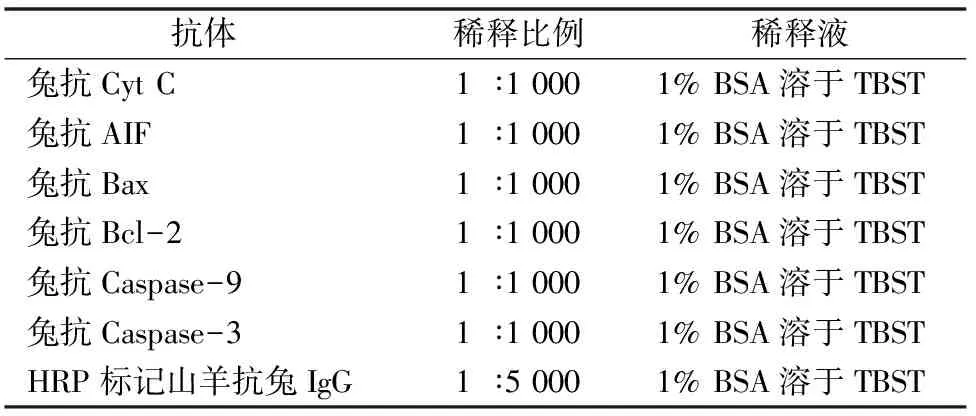
表1 一抗稀释比例及所用稀释液
用ECL检测液发光显影定影。
1.7 数据处理与统计分析

2 结果与分析
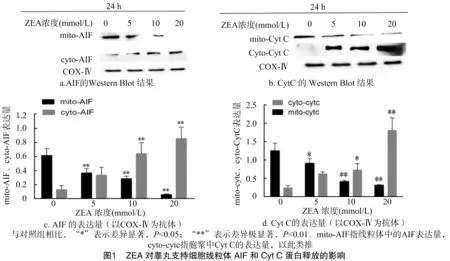
2.1 ZEA对睾丸支持细胞线粒体AIF和Cyt C释放的影响
用0、5、10、20 μmol/L ZEA处理睾丸支持细胞24 h后,与对照组相比,随着ZEA浓度的增加,胞浆中AIF和Cyt C的释放量增加,线粒体中AIF和Cyt C的表达量减少。分析灰度值见图1。结果显示,与对照组相比,线粒体中Cyt C表达量呈现出 5 μmol/L ZEA处理组显著下降(P<0.05)和10、20 μmol/L ZEA处理组极显著下降(P<0.01);各染毒组线粒体中AIF表达量均极显著下降(P<0.01);胞浆中Cyt C呈现出 10 μmol/L ZEA处理组显著上升(P<0.05)和20 μmol/L ZEA处理组极显著上升(P<0.01);10、20 μmol/L ZEA处理组胞浆中AIF表达量呈极显著上升(P<0.01),呈现“剂量-效应”关系。
2.2 NAC对ZEA致睾丸支持细胞凋亡的影响
用100 μmol/L NAC预处理睾丸支持细胞30 min后,用20 μmol/L ZEA作用睾丸支持细胞24 h,流式细胞术检测细胞凋亡率。图2结果显示,与20 μmol/L ZEA处理组相比,NAC与ZEA共处理组R5象限凋亡细胞数量明显减少。与ZEA单独处理组相比,NAC与ZEA共处理组凋亡率极显著降低(P<0.01)。
2.3 NAC对ZEA致睾丸支持细胞Bax和Bcl-2蛋白表达调控
用100 μmol/L NAC预处理睾丸支持细胞30 min后,用20 μmol/L ZEA作用睾丸支持细胞24 h,用Western Blot法检测Bax、Bcl-2蛋白表达变化情况见图3。结果显示,与20 μmol/L ZEA单独处理组相比,100 μmol/L NAC与 20 μmol/L ZEA联合处理组Bcl-2/Bax值有极显著升高(P<0.01)。
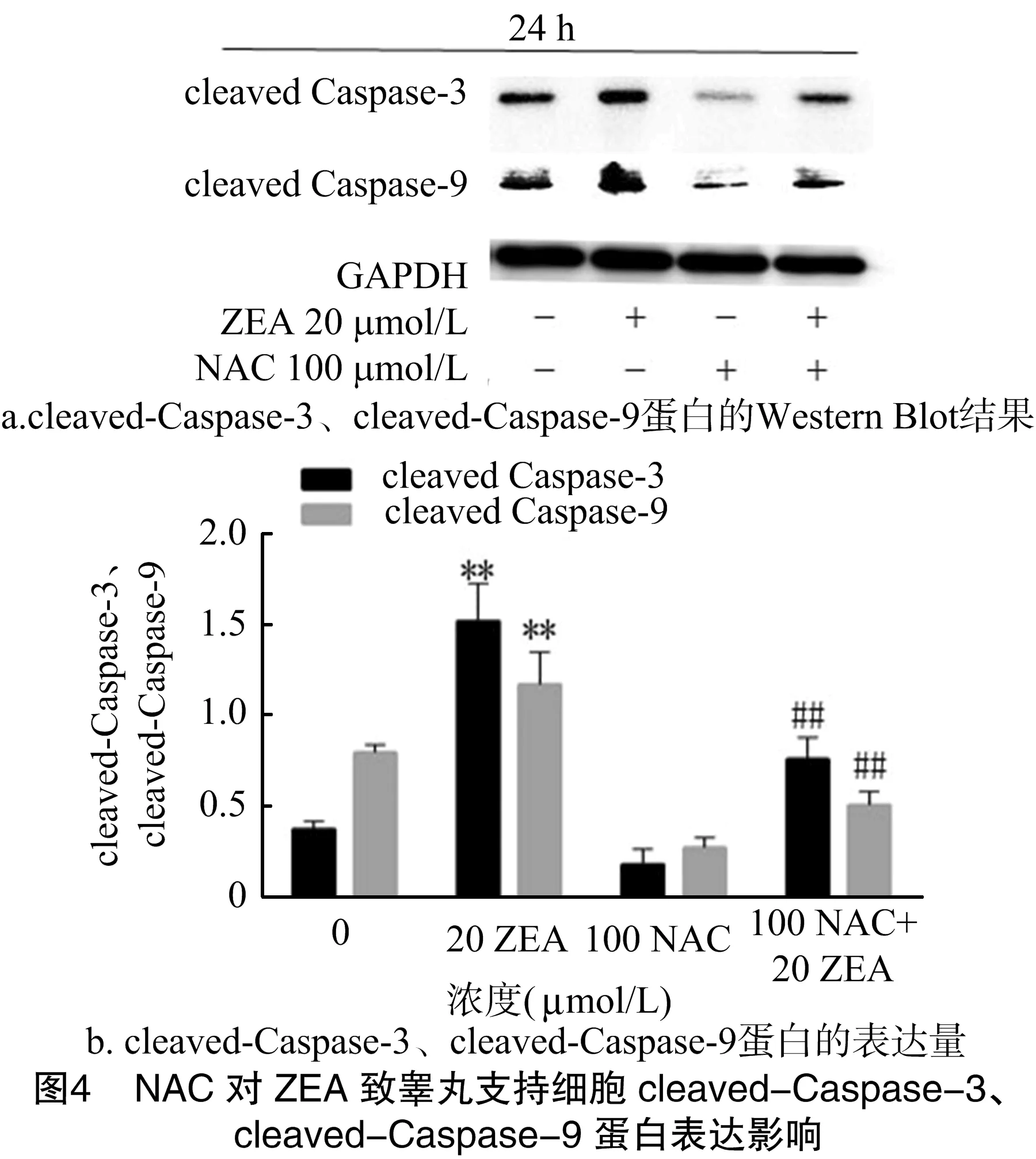
2.4 NAC对ZEA致睾丸支持细胞Caspase-3、Caspase-9蛋白活化的调控
用100 μmol/L NAC预处理睾丸支持细胞30 min后,用20 μmol/L ZEA作用睾丸支持细胞24 h,用Western Blot法检测cleaved-Caspase-9、cleaved-Caspase-3蛋白表达变化情况。图4结果显示,与20 μmol/L ZEA单独处理组相比,100 μmol/L NAC与20 μmol/L ZEA联合处理组cleaved-Caspase-9、cleaved-Caspase-3表达量极显著下降(P<0.01)。
3 讨论
Cyt C是由亚铁血红素和多肽组成的一种可溶性色素蛋白,作为线粒体呼吸链中传递电子的载体,与富含不饱和脂肪酸的线粒体内膜外侧的磷脂结合,呈点状分布,在生理条件下限制其自由穿透线粒体外膜。凋亡发生时,线粒体中的细胞色素C将被释放到细胞浆中,激活caspase级联蛋白,加剧凋亡的进行,释放的细胞色素C活化Caspase-9,进一步激活凋亡家族中的关键性蛋白Caspase-3。ZEA诱导人类肝细胞发生caspase依赖的线粒体介导的凋亡,其中活性氧(reactive oxygen species,简称ROS)的产生在线粒体畸变和Cyt C的释放中起着关键作用[6-7]。本研究发现,ZEA处理睾丸支持细胞能够导致线粒体中Cyt C释放到胞浆中。AIF在凋亡发生过程中调控线粒体膜的通透性,位于线粒体外膜内。在线粒体遭到损伤刺激时,转移至胞浆和细胞核中,参与凋亡进程。Yu等研究证实,ZEA通过调控RAW264.7中AIF的释放而介导caspase非依赖凋亡的进程,在ZEA诱导山羊间质细胞发生凋亡中AIF起到了关键性作用,Cyt C一般涉及caspase依赖的细胞凋亡,而AIF和End G在caspase非依赖凋亡中发挥着重要作用[8-10]。本试验中,AIF随ZEA浓度的升高,在线粒体中的表达量降低,在相应的胞浆中的表达量递增。说明caspase依赖和caspase非依赖性凋亡信号通路共同调节ZEA诱导睾丸支持细胞凋亡的发生。


NAC在致神经元死亡的体内和体外模型中均起到保护作用[11]。GHhosh等研究表明,在黑色素瘤细胞中,用ROS特异性清除剂NAC阻断ROS的生成,可抑制ROS诱导的Bax表达量上升和Bcl-2表达量下降[12]。在败血症和急性肺损伤模型试验中,口服NAC(150 mg/kg)的适当剂量能够降低肺组织中Caspase-3的表达[13]。本试验结果表明,抗氧化剂NAC能够明显抑制因ZEA暴露引起的睾丸支持细胞凋亡发生;Bcl-2/Bax值升高,cleaved-Caspase-9和cleaved-Caspase-3的蛋白表达量均降低,与相关研究存在一致性[14]。NAC显著降低睾丸支持细胞因ZEA引起的氧化损伤,线粒体得到了有效保护。Bcl-2基因产物大量存在于活性氧产生的关键场所——线粒体内膜,Bcl-2的上调使线粒体膜免于脂质过氧化的损伤;Bcl-2的表达量回升,可以有效地抑制Bax、cleaved-Caspase-9和cleaved-Caspase-3等凋亡执行蛋白表达;Bax的下调,使线粒体膜的通透性维持稳态,从而阻断ZEA激活线粒体凋亡通路,延缓ZEA引起的睾丸支持细胞凋亡发生。综上所述,NAC可以对ZEA诱导的睾丸支持细胞的凋亡发生起抑制作用。
参考文献:
[1]Bennett J W. Mycotoxins[J]. Clinical Microbiology Reviews,2003,16(3):497.
[2]Efsa E A. Opinion of the scientific panel on contaminants in food chain on a request from the commission related to ergot as undesirable substance in animal feed[J]. Journal of Indian Botanical Society,2004,89(1):1-35.
[3]沈洁,韩晓冬. 睾丸支持细胞免疫豁免作用机制及研究进展[J]. 中国免疫学杂志,2009,25(7):666-670.
[4]Venkataramana M,Nayaka S C,Anand T,et al. Zearalenone induced toxicity in SHSY-5Y cells:the role of oxidative stress evidenced byN-acetyl cysteine[J]. Food and Chemical Toxicology,2014,65(1):335-342.
[5]韩晓冬,龚昳,屠志刚,等. 大鼠睾丸支持细胞的原代培养与鉴定[J]. 解剖学报,2005,36(6):682-684.
[6]Ayed-Boussema I,Bouaziz C,K,et al. The mycotoxin zearalenone induces apoptosis in human hepatocytes(HepG2)via p53-dependent mitochondrial signaling pathway[J]. Toxicology in Vitro,2008,22(7):1671-1680.
[7]Bouaziz C,Sharaf E O,Golli E E,et al. Different apoptotic pathways induced by zearalenone,T-2 toxin and ochratoxin A in human hepatoma cells[J]. Toxicology,2008,254(1/2):19-28.
[8]Yu J Y,Zheng Z H,Son Y O,et al. Mycotoxin zearalenone induces AIF- and ROS-mediated cell death through p53-and MAPK-dependent signaling pathways in RAW264.7 macrophages[J]. Toxicology in Vitro,2011,25(8):1654-1663.
[9]Yang D Q,Jiang T T,Lin P F,et al. Apoptosis inducing factor gene depletion inhibits zearalenone-induced cell death in a goat Leydig cell line[J]. Reproductive Toxicology,2017,67:129-139.
[10]Kook S H,Son Y O,Chung S W,et al. Caspase-independent death of human osteosarcoma cells by flavonoids is driven by p53-mediated mitochondrial stress and nuclear translocation of AIF and endonuclease G[J]. Apoptosis,2007,12(7):1289.
[11]Karalija A,Novikova L N,Kingham P J,et al. Neuroprotective effects ofN-acetyl-cysteine and acetyl-L-carnitine after spinal cord injury in adult rats[J]. PLoS One,2012,7(7):e41086.
[12]Ghosh S,Bishayee K,Paul A,et al. Homeopathic mother tincture ofPhytolaccadecandrainduces apoptosis in skin melanoma cells by activating caspase-mediated signaling via reactive oxygen species elevation[J]. Journal of Integrative Medicine,2013,11(2):116-124.
[13]Ozdulger A,Cinel I,Koksel O,et al. The protective effect ofN-acetylcysteine on apoptotic lung injury in cecal ligation and puncture-induced sepsis model[J]. Shock,2003,19(4):337-366.
[14]Li J,Meng Z Z,Zhang G W,et al.N-acetylcysteine relieves oxidative stress and protects hippocampus of rat from radiation-induced apoptosis by inhibiting caspase-3[J]. Biomedicine & Pharmacotherapy,2015,70(4):1-6.

