固相萃取-气相色谱法测定油料和植物油中草除灵
韦丹青,胡永健,杨亚琴,刘进玺,王会锋,冯书惠,曹 秀,钟红舰
(河南省农业科学院 农业质量标准与检测技术研究所,郑州 450002)
草除灵(benazolin-ethyl)化学名称为4-氯-2-氧代苯并噻唑-3-基乙酸乙酯,分子式为C11H10ClNO3S,商品名好实多、高特克等。其为选择性、内吸传导型芽后除草剂,用于油菜、苜蓿等防除多种一年生阔叶杂草[1]。草除灵对油菜田猪殃殃和繁缕等高效,对油菜安全[2-3]。虽然草除灵相对安全,但长期使用也会造成一定的污染,国内国际相关限量标准也相继出台。我国规定草除灵在油菜籽中的最大残留限量为0.2 mg/kg[4];2004年,草除灵被欧盟列入禁止销售和使用的农药。有关草除灵原药及制剂的液相、气相色谱检测方法已有报道[5-7],但是对草除灵残留量的测定及其降解的研究甚少[8-10]。本文中草除灵残留采用乙腈提取,弗罗里硅土柱净化,气相色谱-电子捕获检测器(GC-ECD)测定,建立气相色谱定量分析油料和植物油中草除灵残留量的方法。
1 材料与方法
1.1 材料与试剂
固相萃取(SPE)柱(弗罗里硅土,1 000 mg,6 mL),上海月旭公司。油菜籽、大豆油,市售产品。草除灵标准品(>99.5%),德国Dr.Ehrenstorfer公司;乙腈(色谱纯),默克化工技术(上海)有限公司;正己烷(色谱纯),赛默飞世尔科技(中国)有限公司;丙酮(色谱纯),美国J.T.Baker公司;其余试剂为分析纯;超纯水由Milli-Q超纯水系统制。
1.2 仪器与设备
岛津GC-2010 Plus气相色谱仪(配ECD检测器),日本Shimadzu公司;色谱柱TR-5ms(30 m×0.25 mm,0.25 μm),美国Thermo Fisher Scientific公司;分析天平(精度0.000 1 g),瑞士Sartorius公司;分析天平(精度0.01 g),英国艾德姆衡器(武汉)有限公司;自动均质仪,美国Tomtec公司;Milli-Q超纯水发生器,美国Millipore公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;QGC-12T氮气吹干仪,上海全岛公司;HY-6双层摇瓶机,金坛市医疗仪器厂;GL-21B高速冷冻离心机,上海安亭科学仪器厂;SK-1快速混匀器,金坛市中大仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司。
1.3 试验方法
1.3.1溶液的配制
称取草除灵标准品10 mg(精确至0.000 1 g),用丙酮溶解并定容至10 mL,制得1 g/L的标样储备液,于4℃避光储存。根据需要,将储备液用正己烷稀释成不同质量浓度的标样工作溶液,即用即配。
2%丙酮正己烷溶液:量取丙酮2 mL,用正己烷溶解并定容至100 mL。
6%丙酮正己烷溶液:量取丙酮6 mL,用正己烷溶解并定容至100 mL。
1.3.2样品前处理
1.3.2.1样品的提取
将油料样品粉碎,使其通过425 μm的标准网筛。称取粉碎油料样品5.00 g(精确至0.01 g)于100 mL均质瓶中,加入20 mL水浸泡2 h。加入50 mL乙腈,在匀浆机中高速匀浆2 min后过滤,滤液收集到装有5~7 g氯化钠的100 mL具塞量筒中,盖上塞子,剧烈振荡1 min,在室温下静置30 min,使乙腈相和水相分层。从具塞量筒中吸取10 mL乙腈溶液,转入圆底烧瓶,40℃水浴旋转蒸发至近干,加入2.0 mL正己烷,盖上铝箔,待净化。
称取搅拌均匀的植物油样品2.00 g(精确至0.01 g)于100 mL离心管中,加入10 mL正己烷溶解后,再加入50 mL正己烷饱和乙腈溶液,充分混合后振荡30 min,3 000 r/min离心5 min,吸取10 mL乙腈溶液,转入圆底烧瓶中,40℃水浴旋转蒸发至近干,加入2.0 mL正己烷,盖上铝箔,待净化。
1.3.2.2样品的净化
将弗罗里硅土萃取柱(1 000 mg,6 mL)依次用5 mL丙酮+正己烷(体积比为1∶9)、5 mL正己烷活化,当溶剂液面至柱吸附层表面时,立即倒入1.3.2.1中待净化溶液,用5 mL 2%丙酮正己烷溶液冲洗烧杯后淋洗弗罗里柱,然后用10 mL 6%丙酮正己烷溶液洗脱,收集全部洗脱液,40℃水浴中氮气吹干,用正己烷定容至2.0 mL,待GC-ECD测定。
1.3.3色谱条件
色谱柱:TR-5ms柱(30 m×0.25 mm,0.25 μm);检测器:ECD检测器,温度310℃。载气为N2(>99.999%),流速1.0 mL/min。进样体积1 μL,不分流模式进样,进样口温度280℃。升温程序:初始柱温为120℃,保持1 min;然后以20℃/min升至240℃;再以3℃/min升至270℃,保持1 min;最后以20℃/min升至290℃,保持1 min。在上述色谱条件下,草除灵的保留时间为9.958 min。0.01 mg/L草除灵标样溶液色谱图见图1。
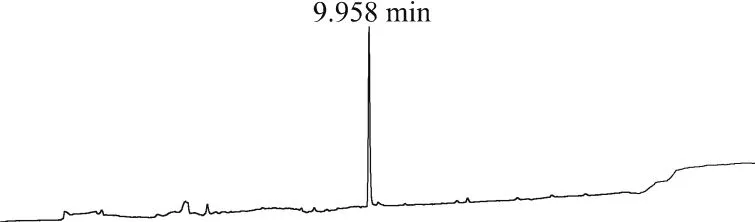
图1 0.01 mg/L草除灵标样溶液谱图
2 结果与分析
2.1 提取溶剂的选择
在农药残留分析中,常以甲醇、乙腈、丙酮、乙酸乙酯等作为提取溶剂。由于乙腈对农药的提取效率高,并能有效减少油脂与色素的干扰,且在氯化钠饱和的状态下,乙腈能与水清晰分层,而不需要引入非极性溶剂[11]。因此,本试验选择乙腈作为提取溶剂。油料选取油菜籽样品,植物油选取大豆油样品进行试验。试验结果证明:乙腈对油菜籽样品中草除灵的提取效果很好,能满足农药残留检测的要求。乙腈提取大豆油样品时会溶解部分油脂,对样品净化及分析造成一定的干扰,因此使用正己烷饱和乙腈溶液作为提取溶剂,则提取液中的油脂含量大大减少。
2.2 净化柱及淋洗液的选择
弗罗里硅土柱又称硅镁复合吸附剂,可从非水溶液中吸附低极性和中等极性化合物,具有灵敏度高,吸附容量大,稳定性好等特点[12]。其常用于农药残留检测的净化、分离等,尤其适用于有机氯类农药。采用不同洗脱溶剂进行弗罗里硅土柱净化效果验证。选用弗罗里硅土柱(1 000 mg,6 mL),依次用5 mL丙酮+正己烷(体积比1∶9)、5 mL正己烷活化,将2 mL质量浓度0.025 mg/L的草除灵标样溶液(正己烷为溶剂)转入弗罗里硅土柱,然后用5 mL不同体积分数的丙酮正己烷溶液洗脱,收集洗脱液,蒸干后用正己烷溶解,待GC-ECD测定。回收率结果见表1。由表1可知:5 mL 6%丙酮正己烷溶液可将目标

表1 不同体积分数丙酮正己烷溶液洗脱对回收率的影响 %
物洗脱完全;8%丙酮正己烷溶液极性更大,会有相对多的杂质被洗脱。
2.3 线性相关性测定
用1 mg/L标样储备液配制质量浓度分别为0.001,0.005,0.01,0.02,0.06,0.10 mg/L草除灵标样溶液,各取1 μL进行气相色谱测定。以草除灵色谱峰的峰面积为纵坐标,标样溶液质量浓度为横坐标,绘制标准曲线(见图2)。结果显示,草除灵的质量浓度与峰面积呈良好的线性关系,线性方程为y=7 233 498 x+15 621,相关系数为0.999 4。
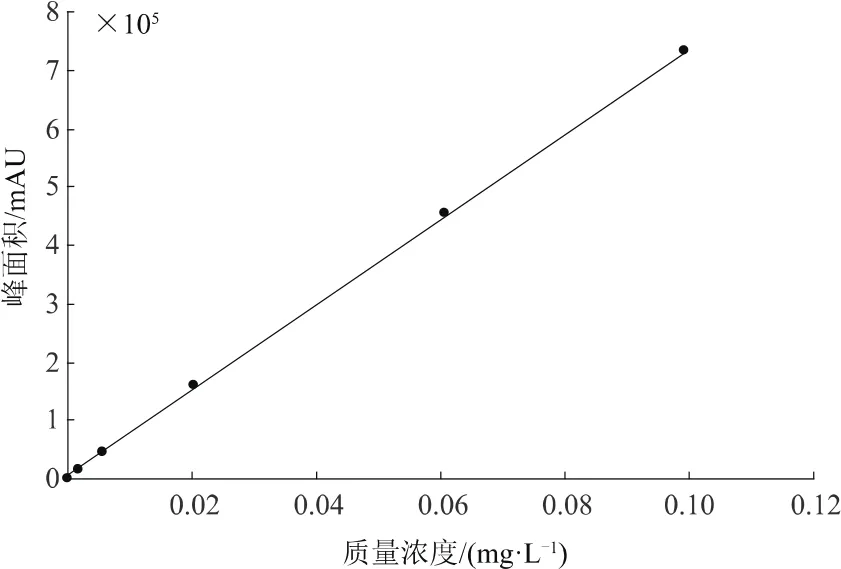
图2 草除灵标准曲线
在上述色谱条件下,草除灵的最小检出量为1.0×10-12g;在上述提取方法和测定条件下,草除灵的定量限(LOQ)为0.05 mg/kg。
2.4 方法准确度和精密度测定
选取油菜籽和大豆油空白样品,以0.05,0.10,0.20,0.40 mg/kg为添加水平进行回收率试验。样品添加草除灵后,涡旋30 s,静置30 min,待草除灵被样品充分吸收后,按照上述样品前处理方法和仪器条件进行测定,每个水平重复5次,结果见表2。
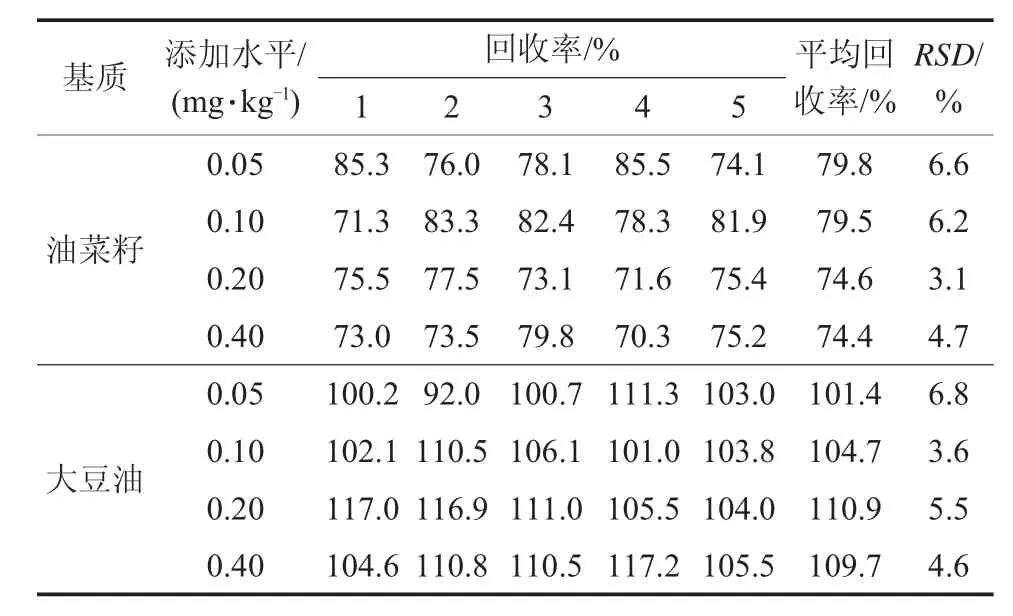
表2 方法加标回收率和相对标准偏差(n=5)
由表2可知:草除灵的平均回收率为74.4%~110.9%,相对标准偏差为3.1%~6.8%。方法符合农药残留检测的要求。油菜籽和大豆油空白样品及添加色谱图见图3~图6。
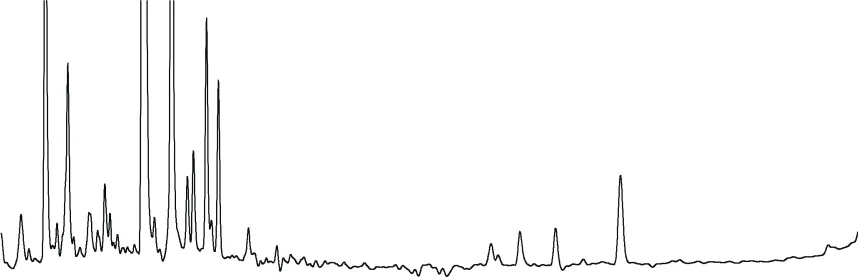
图3 油菜籽空白谱图
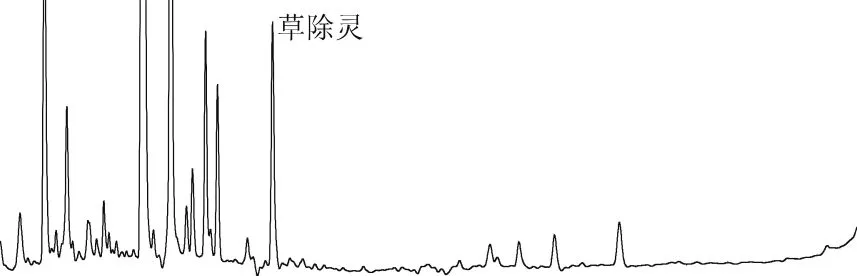
图4 油菜籽添加草除灵(0.1 mg/kg)谱图

图5 大豆油空白谱图

图6 大豆油添加草除灵(0.1 mg/kg)谱图
3 结论
本文建立了油料和植物油中草除灵残留量的气相色谱检测方法。此方法的回收率为74.4%~110.9%,相对标准偏差为3.1%~6.8%,LOQ为0.05 mg/kg。结果表明,本方法可满足油料和植物油中草
除灵残留量的分析要求。
[1]Schnitzler F,Lavorenti A,Berns A E,et al.The Influence of Maize Residues on the Mobility and Binding of Benazolin:Investigating Physically Extracted Soil Fractions[J].Environmental Pollution,2007,147(1):4-13.
[2]张宏军,朱文达,喻大昭,等.烯草酮·草除灵防除油菜田杂草的效果[J].湖北农业科学,2008,47(4):424-426.
[3]杨赓,施娟娟,李明,等.草除灵废水可生物降解性及共基质代谢作用快速测定研究[J].现代农药,2002,1(2):30-33.
[4]中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业部,国家食品药品监督管理总局.GB 2763—2016食品中农药最大残留限量[S].北京:中国标准出版社,2016.
[5]魏翔.草除灵的液相色谱分析[J].山东化工,2003,32(1):30-32.
[6]Cai T M,Qian L H,Cai S,et al.Biodegradation of Benazolin-ethyl by Strain Methyloversatilis sp.cd-1 Isolated from Activated Sludge[J].Current Microbiology,2011,62:570-577.
[7]杨开莲,谢承礼,周岳明.草除灵的气相色谱分析[J].云南化工,2007,34(1):58-59.
[8]孙惠青,李义强,徐广军,等.高效液相色谱法测定草除灵在土壤中降解规律[J].农药,2012,51(8):587-589.
[9]黄雪,罗俊凯,龚道新,等.高效液相色谱法测定土壤中草除灵和高效氯吡甲禾灵的残留量[J].农药学学报,2013,15(1):125-128.[10]孙惠青,李义强,徐广军,等.草除灵在油菜植株、油菜籽及土壤中残留分析方法研究[J].农药科学与管理,2012,33(8):22-24.
[11]Beyer A,Biziuk M.Applications of Sample Preparation Techniques in the Analysis of Pesticides and PCBs in Food[J].Food Chem,2008,108(2):669-680.
[12]Doong R A,Lee C Y.Determination of Organochlorine Pesticide Residues in Foods Using Soild-Phase Extraction Cleanup Cartridges[J].Analyst,1999,124(9):1287-1289.
——《弗罗拉和尤利西斯的光明冒险》导读

