海桑次生木质部导管解剖特征与土壤理化因子年内动态变化的关系研究
李 润,朱丹丹,蒋梦莹,张坚强,李加庆,邓传远
(福建农林大学 园林学院,福州 350002)
红树植物是生长在热带亚热带海岸潮间带的木本植物,是湿地生态系统的重要组成部分[1-3]。植物次生木质部具水分输导和机械支撑等功能,在高盐的海岸潮间带生境,红树植物次生木质部导管必须克服低水势下易诱发栓塞并导致水分输导功能丧失的倾向,才能维持植物正常的生理活动[4-5],因此,植物次生木质部的结构功能与生境相适应是植物生存的基础。前人关于红树植物次生木质部的生态解剖学研究较关注同种红树植物次生木质部解剖特征随水淹频次或海水(土壤)盐度的空间变动而变化的关系分析,从生长在不同空间的同一红树植物次生木质部结构的种内变动与异质生境的相关性揭示红树植物的分布及适应范围[6-12]。盐度是调控红树植物水分运输的一个决定因子并对次生木质部的结构有影响[5,13-14],但红树林生境中土壤盐度除不同空间差异显著外,一年中不同季节土壤盐度等土壤理化因子的变动也是剧烈的[15],这种土壤理化因子时间序列的变动可能对红树植物次生木质部结构产生影响[10]。鉴于此,关于土壤理化因子时间序列的变动对红树植物维管组织特征的影响需进一步证明。
海桑(Sonneratiacaseolaris(L.) Engl.)隶属于海桑科(Sonneratiaceae)海桑属(SonneratiaLinn. f.),是中国红树林生态系统中重要的速生乔木,适应性广,既能在中潮位或高潮位生长,又能生长在盐度较高的滩涂[2-3]。关于海桑次生木质部解剖特征已有较详细的报道,以前的研究较关注海桑属(Sonneratia)属内种间次生木质部的比较解剖研究,通过海桑属次生木质部结构的种间异同探讨海桑属红树植物的生态适应意义和系统演化意义[16-17]。但红树林生境因子的时空变动异常剧烈,海桑次生木质部解剖特征的种内变动与时间序列上土壤理化因子变化的关系研究很少。关于海桑属植物具有生长轮已有报道[3,18],因此,可以较明确界定海桑一年内一定时间段(多个月份连续累积)的“生长层” (新形成的次生木质部),新形成“生长层”导管数量解剖特征可能受生境时间序列上土壤理化因子变动的影响。本研究主要分析海桑次生木质部导管解剖特征年内动态变化(不同连续时间段形成的“生长层”)与对应土壤理化因子变动的关系,旨在揭示海桑次生木质部导管解剖特征随土壤理化因子的年内动态变动而变化的适应机制。
1 材料和方法
1.1 样地概况
福建省龙海市省级红树林自然保护区位于九龙江出海口,中心坐标为24°20′N,117°45′E。保护对象为红树林及其生态系统。海桑(Sonneratiacaseolaris)等引种植物在保护区长势良好,能自然开花结果。土壤和植物采样位于浮宫镇霞郭村红树林保护区范围内的引种区,该区域属南亚热带季风性气候,年均气温21 ℃,年均降水量1 371 mm,年均相对湿度86%,年均日照时数272 h,无霜期231~365天。平均高潮间隙40 min,平均潮差3.98 m,平均大潮差4.95 m,平均小潮差2.85 m。
1.2 材 料
1.2.1枝条取样枝条取样地点为浮宫镇红树林自然保护区高潮位。从2015年03月至12月,每月底采集1次,共10次,每次选择间距5 m以上的5株植株进行枝条取样,截取直径约5 cm,长约20 cm的枝条带回实验室,用砂纸磨光枝干的横断面,根据生长轮粗略判断树龄,截取生长轮一致的枝干用FAA固定。
1.2.2土壤取样为了准确反映海桑生长的潮间带生境一年内土壤理化性质的变化规律,从2015年1月2日第1次取样后,每半个月采集土样1次。土壤样品采集在每个海桑枝条取样植株四周按等距离成对角线取4份土样混合,取样时,用内径为5 cm的PVC管钻取25 cm深的土样,装入自封袋中带回实验室。
1.3 材料处理及试验方法
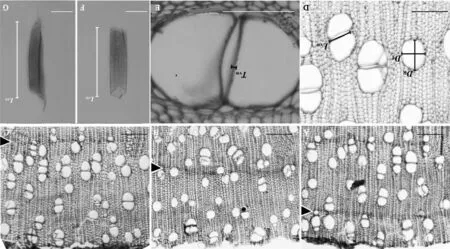
1.3.1木材处理及试验方法Tomlison[3]的观察认为红树植物具有肉眼可见的生长轮,本研究中3月底采集的枝条在解剖镜或显微镜下可以观察到次生木质部最外一轮,与次最外轮(前一年生长轮)区别较明显,由于其不是完整的一个生长轮,主要是1月至3月份维管形成层分裂活动新产生的次生木质部,按照Schmitz等[7],称之为 “生长层” (图1,A),根据这一特点,3月至12月每月的月底采集枝条最外1轮分别为1月至采集枝条月份累积产生的新“生长层”(图1,B、C)。切片法和离析法制片用于光镜观察的主要部位为采样枝条最外边1轮即新“生长层”。采样枝条按照文献[19]的标准方法进行制片。制片材料需包括最靠近维管形成层的“生长层”,枝条材料软化后用滑走切片机切取横、径、弦三向切片,制成临时装片。另从采集的枝条取一部分新“生长层”木材用冰醋酸-过氧化氢离析液离析,制成临时装片。临时装片在光学显微镜(Olympus BHS,日本OLYMPUS公司,东京,日本)下观察次生木质部形态特征并拍照,同时应用Motic Image Advanced 3.2软件测定次生木质部数量特征指标(见表2)。应用光学显微镜观察和拍照。
本研究所用术语及各数量特征的描述和计算依据文献[20~22]提出的标准和计算方法。各项测定指标如下:管孔径向直径(radial vessel diameter,DR);管孔弦向直径(tangential vessel diameter,DT);导管壁厚(intervessel wall thickness,TVW);导管长度(vessel element length,LVE);管孔密度(Vessel density,VD);单孔率(solitary vessel index,VS);导管聚合度(vessel grouping index,VG);相邻管孔间接触壁长占比(intervessel contact fraction,FC);相邻管孔间接触壁长(intervessel wall length,LVW)。其中,管孔径向直径(DR)、管孔弦向直径(DT)、导管壁厚(TVW)、导管长度(LVE)和相邻管孔间接触壁长(LVW)的测量见图1,D~G所示。
1.3.2土壤处理及试验方法土壤样品自然风干、研细、拣去根系,过18号筛,贮存供各种分析用。土壤理化指标测定方法按照鲁如坤[23]和刘光崧[24]等方法进行:土壤有机质含量(soil organic matter content,OM)用K2Cr2O7容量法,土壤全氮含量(soil total nitrogen content,TN)用纳氏试剂比色法,土壤全磷含量(soil total phosphorus content,TP)用磷钼蓝比色法,土壤全盐含量(total soil salt content,TSC)用电导法,土壤pH用电位法。
由于海桑次生木质部导管解剖特征的年内动态变动为连续月份累积的新“生长层”的观测值(详见1.3.2的描述),利用连续月份土壤理化因子测定值的加权平均,可对应各采样枝条新“生长层” 形成阶段土壤理化因子的变动。例如,3月底采集枝条最外一轮“生长层”(图1,A),主要是1月至3月份维管形成层分裂活动新产生的次生木质部,则可能受1月初到3月底土壤理化因子的数量特征影响,本研究用1月初到3月底土壤采集样品理化因子测定值的加权平均表示(1月2日及其后每半个月1次采集土壤样品,共7次土壤采集样品理化因子测定值的加权平均值)。依此类推。

A~C.采样枝条一年内不同连续时间段新形成的“生长层”横切面,箭头所指为新形成的生长层与前一年生长轮的界限(A. 3月底采样枝条;B. 9月底采样枝条;C. 12月底采样枝条);D~G. 导管数量特征指标的测量(D~E. 采样枝条横切面,图示DR(管孔径向直径)、 DT(管孔弦向直径)、 LVW(导管长度) 和TVW(导管壁厚)的测量; F~G. 采样枝条离析材料,图示LVE的测量)。标尺=100 μm。图1 光学显微镜下海桑采样枝条新“生长层”的界定及切片法和离析法制作装片导管数量解剖特征的测定A-C. The new formed growth layers in different continuous time span within one year determined from the cross sections. The arrows indicate the demarcation between the new formed growth layer and the growth ring of previous year( A. Branch collected at the end of March; B. Branch collected at the end of September; C. Branch collected at the end of December); D-G. Illustrations showed measurements of quantitative vessel anatomic feature indexes ( D-E. The cross sections of branch showed measurements of DR(radial vessel diameter), DT(tangential vessel diameter), LVW (vessel element length) and TVW(intervessel wall thickness). F-G. The maceration vessel elements showed measurements of LVE). Bar=100 μm.Fig.1 The demarcation of Sonneratia caseolaris of new formed growth layers and illustrations of measurements on some quantitative anatomical features of section and maceration slides under a microscope
1.4 数据统计分析
应用SPSS分析软件进行研究样地土壤理化因子和海桑次生木质部导管解剖特征年内动态变化的方差分析和LSD多重比较,应用逐步回归分析研究海桑植物次生木质部各结构数量特征与样地土壤理化因子间的关系。
2 结果与分析
2.1 研究样地土壤理化因子年内动态变动
根据1.3.1所述方法对土壤采集样品进行了测定。由于海桑次生木质部导管解剖特征的年内动态变动为连续月份累积的新“生长层”的变化,利用连续月份土壤理化因子测定值的加权平均,可对应各采样枝条新“生长层” 形成阶段土壤理化因子的变动(详见1.3.1的描述)。5项土壤理化因子指标在年内10个不同连续时间段变动的计算结果见表1,其将与10次枝条采样新“生长层”导管数量特征的变动对应。对10个不同连续时间段土壤理化因子指标进行ANOVA方差分析和LSD多重比较,结果见表1。ANOVA分析表明,包括OM(土壤有机质)、TN(土壤全氮含量)、TP(土壤全磷含量)、pH(土壤pH值)和TSC(土壤全盐量)等5项土壤理化指标在10个不同连续时间段的均值变动均存在显著差异(P<0.05)。表1LSD多重比较结果揭示10个不同连续时间段均值间两两的差异程度,其中,TSC(土壤全盐量) 在45对不同连续时间段的LSD两两比较中,共有10对具显著差异(P<0.05),最大值出现在第1时间段;OM(土壤有机质) 在45对不同连续时间段的LSD两两比较中,共有21对具显著差异(P<0.05),最大值出现在第2时间段;pH(土壤pH值) 在45对不同连续时间段的LSD两两比较中,共有25对具显著差异(P<0.05),均值最大值出现在第10阶段。
2.2 海桑次生木质部导管解剖特征年内动态变动
应用1.3.2对一年内不同连续时间段新形成“生长层”的界定,及制片法和离析法制成的临时装片,在连接软件的显微镜下测量统计了10个不同连续时间段海桑形成新“生长层”导管的数量解剖特征,结果见表2。表2表明,在10个不同连续时间段形成的“生长层”,其导管数量解剖特征的9项指标均值变动程度不同;ANOVA分析表明,在10个不同连续时间段形成的“生长层”中,指标Fc(相邻管孔间接触壁长占比)没有显著差异(P>0.05),而其他8项海桑次生木质部导管数量解剖特征指标,包括DR(管孔径向直径)、DT(管孔弦向直径)、TVW(导管壁厚)、LVE(导管长度)、VD(管孔密度)、VS(单孔率)、VG(导管聚合度)和LVW(相邻管孔间接触壁长)在10个不同连续时间段形成的生长层中均具有显著差异(P<0.05)。LSD多重比较分析结果(表2)表明,10个不同连续时间段形成的生长层中,各项导管数量特征指标均值间两两差异的程度。如,DR(管孔径向直径)在45对不同时间段的LSD两两比较中,共有34对具显著差异(P<0.05),最大值出现在第5时间段,最小值出现在第7时间段,而DT(管孔弦向直径) 在45对不同时间段的LSD两两比较中,共有31对具显著差异(P<0.05),最大值出现在第4时间段,最小值出现在第7时间段。
应用1.3.2的制片法和离析法制成的临时装片在显微镜下观察10个不同连续时间段海桑形成新“生长层”导管的形态解剖特征,发现不同连续时间段,海桑次生木质部管孔的形态特征有一些共同特征,如三向切面上可观察到海桑新“生长层”具单管孔和管孔群(图2,A-E),其中短径列复管孔是最常见的管孔群形式(图2,A),管孔团较少见(图2,F)。离析材料的观察表明,不同时间段大部分海桑导管具单穿孔,导管分子端壁平至倾斜(图1,F、G)。但光学显微镜下仔细的观察,部分视野也能粗略显示受高土壤全盐量影响下,海桑次生木质部三向切面导管较大,复管孔较多 (图2,A~E),而低土壤全盐量影响下,海桑次生木质部横切面导管较小,单管孔较多(图2,F~H)。
2.3 海桑次生木质部导管解剖特征随土壤理化因子年内动态变动而变化的关系分析
ANOVA和LSD分析结果表明,不同连续时间段海桑形成的新次生木质部(新“生长层”)管孔数量特征的变动较大,而ANOVA和LSD分析结果同时也表明采样植株土壤理化因子具较大的变动,为了进一步揭示二者变动的相互关系,应用逐步回归分析法分析了不同连续时间段海桑次生木质部管孔的数量特征与土壤理化因子回归关系,结果见表3。表3显示,在5项土壤理化因子中,只有土壤全盐量显著影响海桑次生木质部导管弦向直径和导管聚合度,其他土壤理化因子没有显著影响测定的9项海桑次生木质部数量解剖特征。随着土壤全盐量的提高,导管弦向直径和导管聚合度呈增大趋势达到显著水平,其回归方程分别为yDT=2.240xTSC+7.966和yVG=0.052xTSC+0.703,校正决定系数R2分别为0.352和0.498。

表1 10个新生长层形成阶段(不同连续时间段) 海桑样地土壤理化因子的变动
注:1~10为10个不同的连续时间段,1为第1连续时间段,指1月初到3月底, 对应3月底采样枝条新“生长层”形成阶段。 依此类推。同列不同小写字母表示多重比较结果差异显著(P<0.05);下同
Note: 1-10 represent 10 different continuous time spans, 1 means No. 1 continuous time span from early January to end of March corresponding to the branches collected at the end of March and the formation periods of new growth layers from early January to end of March. The rest may be deduced by analogy. Any of the different hormal letters in each column indicated the difference was significant (P<0.05) by LSD; The same as below
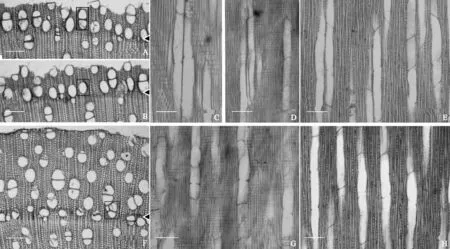
A~E. 3月底采样枝条形成新“生长层”的显微结构,对应1月到3月底土壤理化因子均值影响下形成新“生长层”的导管形态解剖特征 (高土壤全盐量): A. 横切面,矩形框内为短径列复管孔;B. 横切面,矩形框内为单管孔;C、D. 径切面;E.弦切面。F~H. 9月底采样枝条形成新“生长层”的显微结构,对应1月到9月底土壤理化因子均值影响下形成新“生长层”的导管形态解剖特征(低土壤全盐量): F.横切面,矩形框内为管孔团;G. 径切面;H. 弦切面。标尺=100 μm图2 不同连续时间段海桑采样枝条形成新“生长层” 的导管形态解剖特征A-E. The microscopic structures of the new formed growth layer demarcated from branches collected at the end of March which suggest being subjected to effects of high soil salt content by measurements of the soil physicochemical factors from the early January to the end of March: A. Transverse section, the short radial multiple pore can be seen within the rectangular, B. Transverse section, the solitary pore can be seen within the rectangular; C, D. Radial section; E. Tangential section; F-H. The microscopic structures of the new formed growth layer demarcated from branches collected at the end of September which suggests being subjected to effects of low soil salt content by measurements of the soil physicochemical factors from the early January to the end of September: F. Transverse section, the pore cluster can be seen within the rectangular; G. Radial section; H. Tangential section. Bar=100 μmFig.2 The morphological anatomical features of new formed layers demarcated from branches of S. caseolaris in different continuous time spans

解剖性状Anatomicalcharacteristic土壤全盐量Totalsoilsaltcontent回归方程Regressionequation校正决定系数AdjustedR2P值Pvalue管孔弦向直径TangentialvesseldiameteryDT=2.240xTSC+7.9660.352PTSC=0.042导管聚合度VesselgroupingindexyVG=0.052xTSC+0.7030.498PTSC=0.014
3 讨 论
3.1 不同连续时间段海桑生境土壤理化因子和次生木质部管孔数量特征的变动
在浅海滩涂生长的海桑必须具有高的水分输导效率和强的水分输导安全性才能在易产生渗透胁迫的高盐生境下生存[4-5],因此,海桑可能具有特化的输导结构或结构的可塑性保证在盐胁迫生境下正常的生理活动。本研究每半个月采集土壤样品1次,测定了一年内海桑生长小生境不同时间的土壤理化因子,发现不同时间土壤理化因子的变动比较明显,特别是某些月份的变动异常明显,但由于无法以月界定海桑的“生长层”,也就无法通过数理统计方法分析土壤理化因子的月变动对海桑次生木质部结构特征的影响。而由于生长轮的存在,可以界定海桑一年内不同连续时间段海桑新形成的次生木质(形成的新“生长层”),因此,本研究通过数理统计方法分析10个不同连续时间段(一年内从年初到3月底后每个月月底时间等10个连续时间段)土壤理化因子的变动与对应连续时间段形成的海桑新“生长层”解剖特征的关系,旨在揭示时间序列上土壤理化因子的变动对海桑次生木质部解剖结构的影响。由于不同连续时间段为几个月(如本研究中3个月及以上时间) 土壤理化因子测定值的平均,这容易抵消不同月份海桑小生境土壤理化因子的剧烈变动,但本研究发现一年内不同连续时间段,5项测定的土壤理化因子指标是变动的,特别是全盐量含量,在一年内不同连续时间段的变动比较大,同时,本研究测定了与不同连续时间段土壤理化因子对应新形成“生长层”的数量解剖特征,发现许多数量解剖特征指标也是变动的(表2),这些结果表明可能存在对应的结构特点能协调水分输导的安全性和水分输导的有效性。
3.2 不同时间段海桑次生木质部管孔的数量解剖特征随土壤理化因子变动而变化的生态适应策略
一般适应盐生生境的植物具有与适应旱生生境的植物相似的木材组织结构特点[21],关于红树植物次生木质部的比较解剖学研究,特别是相对于与陆生植物的比较表明,红树植物具有高的管孔密度和导管聚合度,低的单孔率和管孔直径,适应高盐生境下完成水分输导的功能[16,25],对同一植物生长在土壤含盐量(或土壤水含盐量)不同的异质生境,次生木质部数量特征的变动倾向于支持比较解剖学的观点,组织水平上,许多次生木质部解剖特征的可塑性能促进水分输导的安全性,但植物并不是必须集合所有的这些特征才能适应高盐生境,可能在某部分特征指标具相应的可塑性而适应生境[26]。如桐花树(Aegicerascorniculatum)在盐度越高的生境中,管孔直径越小[6],白骨壤(Avicenniamarina)次生木质部的单孔率随土壤全盐量增加而降低[12],红海榄(Rhizophorastylosa)管孔密度随土壤全盐量的升高而增大[10],红茄苳(Rhizophoramucronata)管孔密度随土壤水全盐量的升高而增大[7]。本研究中逐步回归分析表明,随着时间序列上土壤全盐含量的提高,导管弦向直径呈增大趋势(表3),这与不同秋茄(Kandeliacandel)种群的研究结果相似,对秋茄的研究表明,沿入海口方向,在土壤盐离子含量越高的不同空间异质生境中,水分输导安全性降低的情况下,而秋茄导管分子却越大,不安全性进一步加剧,由于没有发现其他增进水分输导安全性的次生木质部解剖特征,研究者推测可能有其他机制保证秋茄水分输导的安全性[11]。本研究发现,随着时间序列上土壤全盐含量的提高,海桑导管弦向直径增大,水分输导不安全性进一步加剧的同时,导管聚合度也呈增大趋势,因此,在水分输导安全性降低的情况下,导管聚合度增大具有增进水分输导安全性的作用。
4 结论与展望
统计分析结果表明不同连续时间段海桑次生木质部导管弦向直径和导管聚合度的数量解剖特征变动受不同连续时间段土壤理化因子中全盐量变动的影响,且预测的结果从水分生理角度的解释具有生态适应意义。但综合统计分析结果,进一步展开研究,完善对预测值的生态适应性解释仍然很有必要。逐步回归分析表明,随着土壤全盐含量的提高,导管弦向直径和导管聚合度呈增大趋势且分别达到显著水平,可是校正决定系数仅分别为0.352和0.498,自变量(全盐量)对因变量(导管弦向直径和导管聚合度)的解释程度没有很高,主要原因是一些观察点偏离了回归直线,如表2中的4号材料,此阶段土壤全盐量含量为(18.25±7.42) g·kg-1,低于1号材料阶段土壤全盐含量[(20.25±5.25) g·kg-1],但其管孔弦向直径却比1号材料的大,为(53.23±10.35) μm[1号为(49.46±16.54) μm],在导管聚合度上也有类似的情况。为了提高回归方程的拟合优度,增加自变量对因变量的解释程度,更好地阐明木材解剖结构可塑性的适应意义,应增加样本观测值。结合本研究的实际,如果连续2年以上的观测值进行逐步回归分析可能可以消除一些偏离回归曲线极端值的影响。除了增加样本观测量外,本研究表明,土壤理化性质的月均变动相当剧烈,结合木材解剖研究中的“针刺形成层标记法”[27],可能可以界定出海桑生长层的月变动,则可能在更大的变动幅度中探讨海桑木材解剖结构随时间推进的可塑性及其适应策略。
参考文献:
[1]DUKE N C, MEYNECKE J O, DITTMANN S,etal. A world without mangroves[J].Science, 2007, 317:41-42.
[2]林鹏.中国红树林生态系统[M].北京:科学出版社,1997.1-380.
[3]TOMLINSON P B. The Botany of Mangroves[M]. Cambridge: Cambridge University Press, 1994.
[5]SOBRADO M A. Hydraulic properties of a mangroveAvicenniagerminansas affected by NaCl[J].BiologiaPlantarum, 2001, 44: 435-438.
[6]SUN Q, LIN P. Wood structure ofAegicerascorniculatumand its ecological adaptations to salinities[J].Hydrobiologia, 1997, 352: 61-66.
[7]SCHMITZ N, VERHEYDEN A, BEECKMAN H,etal. Influence of a salinity gradient on the vessel characters of the mangrove speciesRhizophoramucronata[J].AnnalsofBotany, 2006, 98: 1 321-1 330.
[8]SCHMITZ N, JANSEN S, VERHEYDEN A,etal. Comparative anatomy of intervessel pits in two mangrove species growing along a natural salinity gradient in Gazi Bay, Kenya[J].AnnalsofBotany, 2007, 100: 271-281.
[9]SCHMITZ N, ROBERT E M R, VERHEYDEN A,etal. A patchy growth via successive and simultaneous cambia: Key to success of the most widespread mangrove speciesAvicenniamarina[J].AnnalsofBotany, 2008, 101: 49-58.
[10]邓传远,郑俊鸣,张万超,等. 红海榄木材结构的生态解剖[J]. 植物生态学报,2015,39(6):604-615.
DENG C Y, ZHENG J M, ZHANG W C,etal. Ecological wood anatomy ofRhizophorastylosa[J].ChineseJournalofPlantEcology, 2015,39(6): 604-615.
[11]辛桂亮,郑俊鸣,叶志勇,等. 秋茄次生木质部的生态解剖学研究[J]. 植物科学学报,2015,33(6):792-800.
XIN G L, ZHENG J M, YE Z Y,etal. Ecological anatomical characteristics of secondary xylem inKandeliaobovataSheue[J].PlantScienceJournal, 2015,33(6): 792-800.
[12]辛桂亮,郑俊鸣,叶志勇,等. 白骨壤次生木质部生态解剖学研究[J]. 植物分类与资源学报,2015,37(5):552-530.
XIN G L, ZHENG J M, YE Z Y,etal. Ecological wood anatomy ofAvicenniamarina[J].PlantDiversityandResources, 2015,37(5): 552-530.
[13]LOPEZ-PORTILLO J, EWERS F W, ANGELES G. Sap salinity effects on xylem conductivity in two mangrove species[J].Plant,Cell&Environment, 2005,28(10):1 285-1 292.
[14]PALIYAVUTH C, CLOUGH B, PATANAPONPAIBOON P. Salt uptake and shoot water relations in mangroves[J].AquaticBotany, 2004,78(4): 349-360.
[15]ROBERT E R B, SCHMITZ N, KIRAUNI H A,etal. Salinity fluctuations in mangrove forest of Gazi bay, Kenya: lessons for future research[J].Nature&Faune, 2010,24(1): 89-95.
[16]邓传远,郭素枝,林鹏. 海桑属(Sonneratia)植物的木材结构及其系统演化意义[J]. 热带亚热带植物学报,2004,12(3):213-220.
DENG C Y, GUO S Z, LIN P. Wood anatomy of someSonneratiaspecies in relation to phylogenetic significance[J].JournalofTropicalandSubtropicalBotany, 2004,12(3): 213-220.
[17]邓传远,林鹏,郭素枝. 海桑属红树植物次生木质部解剖特征及其对潮间带生境的适应[J]. 植物生态学报,2004,28(3):392-399.
DENG C Y, LIN P, GUO S Z. Wood structures of someSonneratiaspecies and their adaptation to intertidal habitats[J].ActaPhytoecologicaSinica2004,28(3): 392-399.
[18] ROBERT E M R, SCHMITZ N, OKELLO J A,etal. Mangrove growth rings: fact or fiction?[J]Trees, 2011,25(1): 49-58.
[19]MIKSCHE J P. Botanical Microtechnique Cytochemistry[M]. Iowa: The Iowa State University Press, 1976.
[20]IAWA COMMITTEE. IAWA list of microscopic features for hardwood identification[J].IAWANewSeries, 1989,10(3): 219-332.
[21]CARLQUIST S. Comparative Wood Anatomy[M]. 2nd ed. Berlin: Springer Verlag, 2001.
[22]SCHOLZ A, KLEPSCH M, KARIMI Z,etal. How to quantify conduits in wood[J].FrontiersinPlantScience, 2013, 4:1-11.
[23]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,1999.
[24]刘光崧. 土壤理化分析与剖面描述[M]. 北京:中国标准出版社,1996.
[25]邓传远,林鹏,郭素枝. 榄李属(Lumnitzera)红树植物的木材解剖学研究[J]. 厦门大学学报(自然科学版),2004,43(3):406-411.
DENG C Y, LIN P, GUO S Z. Study on wood anatomy ofLumnitzeraspecies[J].JournalofXiamenUniversity(Natural Science), 2004,43(3):406-411.
[26]CARLQUIST S. How wood evolves: a new synthesis[J].Botany, 2012, 90: 901-940.
[27]VERHEYDEN A, KAIRO J G, BEECKMAN Hetal. Growth rings, growth ring formation and age determination in the mangroveRhizophoramucronata[J].AnnalsofBotany, 2004,94(1): 59-66.

