盐穗木HcUKPP原核表达及重组菌非生物胁迫耐受性研究
张丽丽,张 冀,张富春
(新疆大学 生命科学与技术学院,新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
盐穗木(Halostachyscaspica)隶属藜科(Chenopodiaceae)盐穗木属,广泛分布于新疆干旱荒漠盐碱地,耐盐能力强,可在野外含盐量高达27%的重度盐渍化环境中生长,并且形成优势群落[1-2]。因此选取盐穗木作为耐盐碱基因挖掘及相关功能验证的理想材料,对于抗逆研究具有重要意义。
随着基因组学、转录组学和代谢组学的快速发展,许多盐胁迫相关蛋白质、转录因子、激素信号转导和胁迫响应通路相关基因相继被发现,其中有一部分基序和结构域未知,且功能模糊的蛋白质(POFs),它们在非生物胁迫时呈现了高表达,并且过表达该蛋白的植物都获得了更强的非生物胁迫耐受性[3-5]。本实验室在前期研究中发现,在600 mmol/L NaCl 处理条件下,采用RACE技术从盐穗木中扩增获得了1个功能未知多肽基因HcUKPP,并随着胁迫处理时间的增加,该基因表达显著升高,进一步研究发现其定位于细胞质膜上,为细胞质膜相关蛋白(plasma membrane protein, PMP),猜测它可能参与调节细胞膜通透性和维持细胞结构而增强盐胁迫耐受性[6-7]。当盐敏感型植物长期暴露在高盐环境中时,不利因素所诱发的氧化胁迫和离子损伤会导致质膜过氧化并破坏细胞膜结构,进而改变细胞的渗透势,对植物造成不可逆的伤害。研究表明,当耐盐植物暴露于盐环境中时,会激活维持膜组分和离子稳态的信号通路以及相应基因,并通过稳定细胞结构、抗脂质过氧化和维持细胞渗透势等方式增强植物对盐胁迫的耐受性[8-11]。
本研究通过构建原核表达载体pET30a-HcUKPP,并转化EscherichiacoliBL21(DE3)表达菌株,利用IPTG诱导重组菌株过表达HcUKPP蛋白质,然后用不同浓度NaCl(100、300、500、700和900 mmol/L)、PEG 6000(2.5%、5%、10%、15%和20%)和甲基紫精(25、50、75、100、150和200 μmol/L)分别模拟盐、干旱和氧化胁迫,初步证明HcUKPP蛋白对宿主菌大肠杆菌应对非生物胁迫的显著促进作用,为研究HcUKPP应对非生物胁迫的功能机理以及抗逆经济作物的培育奠定基础。
1 材料和方法
1.1 试验材料
盐穗木种子采自新疆五家渠103团(E87.31°,N44.29°),并种植于本实验室植物培养室。载体质粒pET30a为本实验室保存。
1.2 方 法
1.2.1HcUKPP基因的克隆和原核表达载体的构建取适量盐穗木同化枝,利用植物总RNA提取试剂盒(OMEGA公司)提取总RNA,参照TaKaRa反转录试剂盒说明书将RNA反转录为cDNA,以cDNA为模版,再以上游引物P1(5′-CCGGAATTCTATTATATGCGTACTAGGTGGCT -3′,EcoR Ⅰ和下游引物P2(5′-CCCAAGCTTTACCATATGGCTCTTACTCA-3′,HindⅢ)进行PCR扩增,PCR反应程序为95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min;4 ℃保存。PCR产物回收之后连接至pEASY-T5载体(全式金公司),将测序正确的重组克隆载体pEASY-T5-HcUKPP和pET30a载体同时用EcoRⅠ和HindⅢ (TaKaRa公司)双酶切,用胶回收和PCR产物回收试剂盒(OMEGA公司)分别回收目的基因和载体后,用SolutionⅠ快速连接酶(TaKaRa公司)16 ℃连接4 h,将连接产物转化至EscherichiacoliDH5(全式金公司)中,经 PCR和双酶切鉴定正确后,转入表达菌株E.coliBL21(全式金公司)中,提取质粒进行PCR和双酶切鉴定。
1.2.2融合蛋白His-HcUKPP的诱导表达及特异性分析将阳性菌接种于含有50 μg/mL卡那霉素的新鲜 LB培养基中,于37 ℃、220 r/min过夜培养,次日,再按1/100接种于7个含有50 μg/mL卡那霉素的6 mL新鲜 LB培养基中,在37 ℃、220 r/min条件下振荡培养4 h,待OD600达到0.6~0.8之后,取1 mL作为诱前,剩余5 mL在不同浓度IPTG(0.1、0.4、0.7、1.0、1.3、1.5和2.0 mmol/L),37 ℃、220 r/min条件下诱导4 h。离心收集菌体,用PBS缓冲液洗涤菌体3次后,每毫升菌用80 μL PBS缓冲液重悬,并加入20 μL 5×蛋白loading,沸水浴处理15 min,冰浴10 min,10 000 r/min离心10 min。
将处理好的样品用SDS-PAGE分离后,电转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉37 ℃封闭2 h后,转入含有5%脱脂奶粉稀释的抗His一抗中,低速摇床上结合2 h,TBS-T洗膜3次,每次10 min,再转入2%脱脂奶粉稀释的抗HRP-标记的羊抗鼠二抗中,低速摇床上结合1 h,TBS-T洗膜3次,每次10 min,最后用DAB显色至目的条带清晰。
1.2.3重组菌非生物胁迫耐受性检测重组菌的非生物胁迫耐受性检测参照Narayan和程刚等的方法并进行适当修改[12-13]。将重组菌E.coliBL21∷pET30a-HcUKPP和对照菌E.coliBL21∷pET30a同时进行震荡培养后,为了减轻IPTG对菌体的伤害,用0.1 mmol /L IPTG诱导4 h后将菌液调整至浓度一致,分别接种于含有100、300、500、700和900 mmol/L NaCl,2.5%、5%、10%、15%和20% PEG6000和25、50、75、100、150和200 μmol/L 甲基紫精的新鲜LB培养基中,37 ℃、220 r/min振荡培养,每2 h检测1次,读取OD600,持续检测12 h。
1.2.4统计学分析实验数据的作图和分析采用GraphPad Prism 7。
2 结果与分析
2.1 HcUKPP的克隆
以反转录获得的cDNA为模版,P1和P2为引物,利用RT-PCR扩增获得了HcUKPP基因,1.5%琼脂糖凝胶对目的基因进行检测。结果(图1)表明,获得HcUKPP基因开发阅读框243 bp,大小与预期值相符,且测序结果与GenBank数据库的序列比对完全一致。
2.2 pET30a-HcUKPP原核表达载体的构建
将HcUKPP基因与pET30a连接后,转化E.coliBL21,得到重组菌。用工具酶EcoRⅠ和HindⅢ 对构建的重组原核表达载体pET30a-HcUKPP进行双酶切后,用1%琼脂糖凝胶对酶切产物进行检测。结果显示,pET30a-HcUKPP经EcoRⅠ和HindⅢ 酶切后出现了2条条带,1条为5 000 bp左右的载体片段,1条为250 bp左右的目的片段,而未经双酶切的pET30a-HcUKPP仅出现了1条条带(图2)。该结果表明,已成功获得E.coliBL21::pET30a-HcUKPP原核表达载体,可用于后续蛋白表达。
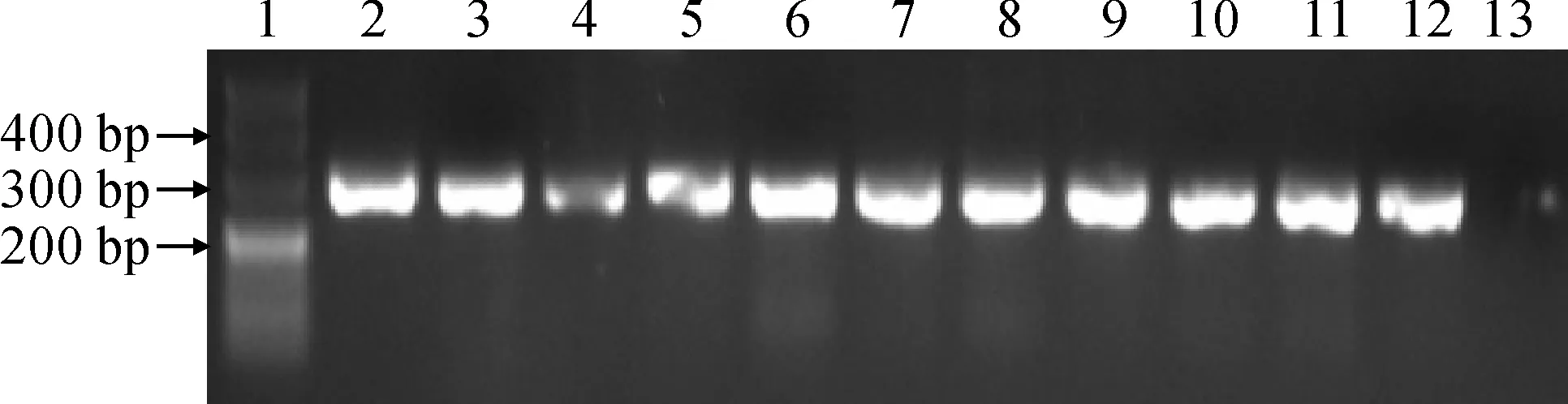
1. DL500;2~12. HcUKPP基因;13. 阴性对照图1 HcUKPP基因的PCR扩增结果1. DL500; 2-12. HcUKPP gene; 13. Negative controlFig.1 Amplification of HcUKPP gene with PCR
2.3 重组蛋白His-HcUKPP的诱导表达和特异性检测
重组菌E.coliBL21::pET30a-HcUKPP经诱导表达条件优化之后,确定在37 ℃、4 h ,0.1、0.4、0.7、1.0、1.3、1.5和2.0 mmol/L IPTG条件下均可诱导表达蛋白,且表达量差异不显著。 SDS-PAGE结果显示,与诱导前相比,诱导后出现了1条约为15 kDa目的条带(图3,A),Western Blot结果表明该条带为特异性的His-HcUKPP(图3,B)。
2.4 重组菌非生物胁迫下生长曲线的测定
通过测定重组菌E.coliBL21∷pET30a-HcUKPP在NaCl、PEG 6000以及甲基紫精等非生物胁迫的OD600,来检测其生长状况(图4,A~C)。结果显示,在上述3种非生物胁迫下,重组菌都表现出了优于对照菌的趋势;进一步分析发现,在500 mmol/L NaCl、10% PEG 6000和75 μmol/L甲基紫精胁迫12 h之后,重组菌的生长优势最为显著,OD600分别是对照菌的1.81、1.47和3.48倍(图4,D~G)。以上结果表明,HcUKPP的表达能提高宿主菌对非生物胁迫的耐受性。
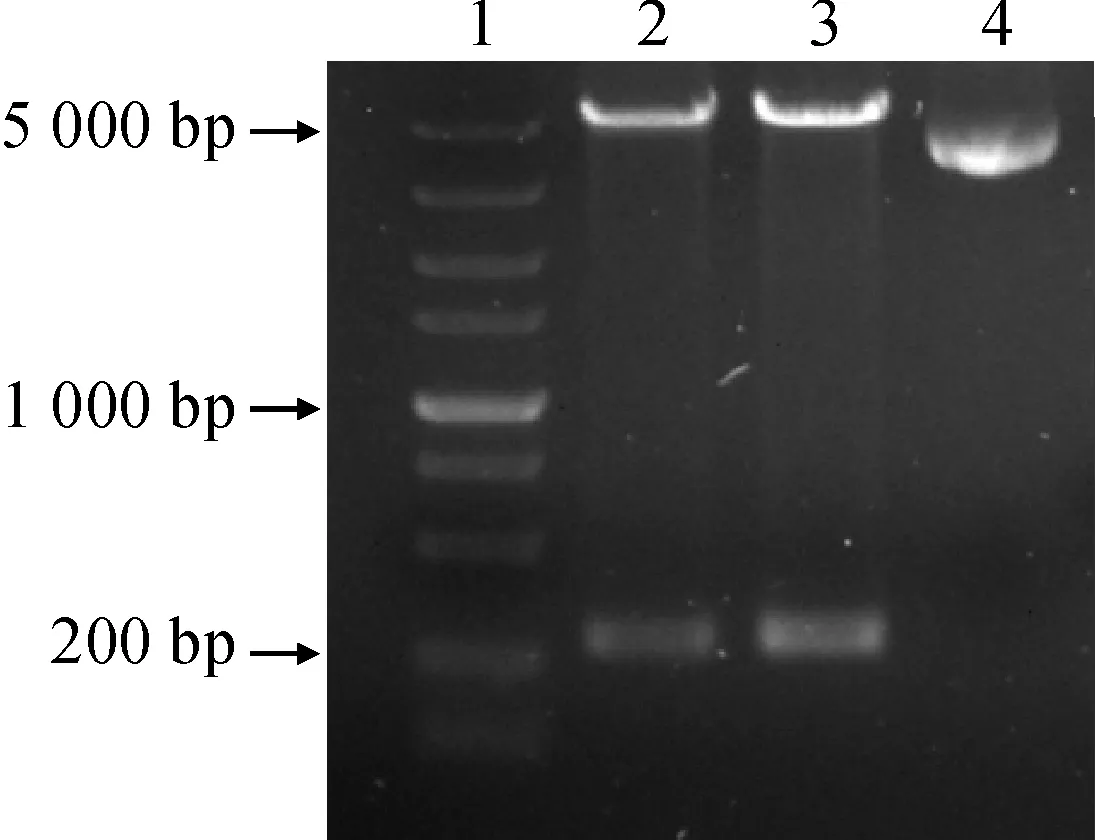
1. DL5000;2~3. 重组质粒pET30a-HcUKPP经EcoRⅠ和Hind Ⅲ 双酶切;4. 重组质粒pET30a-HcUKPP图2 重组质粒pET30a-HcUKPP的双酶切鉴定1. DL5000; 2-3. Recombinant plasmid pET30a-HcUKPP digested by EcoRⅠand Hind Ⅲ; 4. Recombinant plasmid pET30a-HcUKPPFig.2 Identification of recombinant plasmid pET30a-HcUKPP with double-enzyme digestion
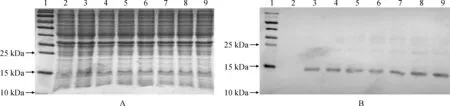
A.SDS-PAGE 分析pET30a-HcUKPP融合蛋白;B. His-HcUKPP融合蛋白的Western blot鉴定;1. 蛋白Marker; 2. E.coli BL21∷pET30a-HcUKPP诱导前; 3. 0.1 mmol/L IPTG; 4. 0.4 mmol/L IPTG; 5. 0.7 mmol/L IPTG; 6. 1.0 mmol/L IPTG; 7. 1.3 mmol/L IPTG; 8. 1.5 mmol/L IPTG; 9. 2.0 mmol/L IPTG图3 His-HcUKPP重组蛋白的诱导表达及特异性分析A. Expression analysis of recombinant His-HcUKPP protein; B. Identification of recombinant His-HcUKPP protein by Western Blot;1. Protein standard marker; 2. Un-induced E.coli BL21∷pET30a-HcUKPP; 3. 0.1 mmol/L IPTG; 4. 0.4 mmol/L IPTG; 5. 0.7 mmol/L IPTG; 6. 1.0 mmol/L IPTG; 7. 1.3 mmol/L IPTG; 8. 1.5 mmol/L IPTG; 9. 2.0 mmol/L IPTGFig.3 Identification and expression analysis of recombinant His-HcUKPP protein
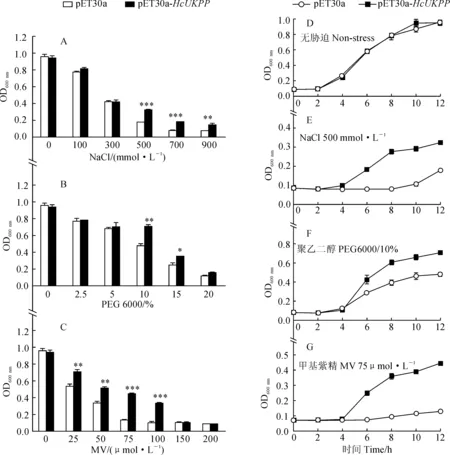
*. P < 0.05;**. P < 0.01;***. P < 0.001A~C. 非生物胁迫12 h后菌体生长的检测; D~G. E.coli BL21∷pET30a-HcUKPP在不同非生物胁迫下的生长检测图4 重组菌E.coli BL21∷pET30a-HcUKPP在不同非生物胁迫下生长曲线A-C. Strains growth under various abiotic stresses for 12 h; D-G. Growth of the recombinant E.coli BL21∷pET30a-HcUKPP under different abiotic stressesFig.4 Growth curve of recombinant strain E.coli BL21∷pET30a-HcUKPP under different abiotic stresses
3 讨 论
近年来,由于基因组和转录组测序技术的快速推广,在真核生物基因组内发现了大量功能未知基因。研究表明,平均每个物种中就有15%~40%的基因功能是未知的[14]。其中在对包括裂殖酵母、小鼠和拟南芥等10种真核生物蛋白组进行Blast比对分析时发现,有18%~38%(平均26%)的蛋白质功能是未知的,并且在对不同真核生物蛋白质组中功能已知蛋白(PDFs)和功能未知蛋白(POFs)进行多样性分析时发现,POFs的物种差异性要显著高于PDFs[15]。在针对紫花苜蓿共生根瘤菌的研究过程中,发现了一个非常重要且高度保守的未知功能蛋白SMc01113家族,通过基因工程的方法对该基因进行改造突变并接种至植物后,极显著增加了根瘤菌的数量,促进了根瘤的生长,从而使植物固氮能力显著提高,且接种SMc01113开放阅读框中一段基因的突变体植株SMc01113∷mTn5(284~507 bp)在应对多种环境胁迫时,都表现出了显著优势[16]。将23个POFs在拟南芥中过表达,结果显示,高达70%转基因拟南芥都显示出了对氧化胁迫的耐受性[17]。因此,探讨植物POFs的功能在研究植物抗逆领域具有重要作用。
本实验室前期在盐穗木转录组中发现了1个定位于细胞质膜上的盐响应未知功能基因HcUKPP,表达特性分析表明,其在600 mmol/L NaCl处理条件下,随着胁迫时间的延长呈现出上调趋势。生物信息学分析发现,在N 端信号肽区与C 末端分别含有一个跨膜区,并且拥有1个Thr和1个的Tys的蛋白激酶磷酸化位点[6-7]。其可能在响应盐等非生物胁迫时通过充当膜受体或者通过磷酸化修饰调控等方式参与胁迫信号转导、基因表达和合成代谢等途径调控植物的耐受性[18-19]。到目前为止,还没有任何关于HcUKPP基因在生物和非生物胁迫中潜在功能的研究。因此开展盐穗木未知多肽基因HcUKPP后续的功能验证研究对于理解其潜在功能和可能参与胁迫响应的反应机制具有重要作用。
本研究通过构建重组原核表达载体pET30a-HcUKPP,并以E.coliBL21为宿主菌,研究了重组菌株在不同浓度NaCl、PEG 6000和甲基紫精胁迫下的耐受性。结果表明,在不同浓度NaCl、PEG 6000和甲基紫精胁迫下,重组菌都显示出强于对照菌的生长优势,尤其在500 mmol/L NaCl、10% PEG 6000和75 μmol/L甲基紫精胁迫12 h之后,重组菌株的优势最为显著。值得注意的是,在500、700和900 mmol/L 高浓度NaCl处理12 h之后,重组菌株都表现出了不同程度的盐耐受性,该结果表明HcUKPP可能在维持渗透平衡等方面发挥重要作用[20]。此外,相比于盐胁迫,75 μmol/L甲基紫精胁迫12 h之后,重组菌株的生长极显著优于对照菌株。可能是在高浓度的甲基紫精胁迫下,产生的大量活性氧使得细胞质膜蛋白发生过度氧化,导致细胞膜结构破坏而失去功能,从而使细胞内环境失衡、抗逆信号转导途径终止,最终导致对照菌体生长受限,并发生死亡[21]。而重组菌由于过表达了HcUKPP蛋白,阻止了质膜蛋白的过度氧化,维持了细胞膜结构,在保证细胞稳态的情况下,高效地传递了抗逆信号,从而合成了抗氧化物质,维持了活性氧的平衡,从而使得重组菌株获得了氧化胁迫耐受性。
本研究对盐穗木未知功能多肽HcUKPP进行了原核表达,且E.coliBL21∷pET30a-HcUKPP重组菌抗非生物胁迫的能力显著提高。研究结果为深入探索盐穗木HcUKPP潜在的生理功能提供了基础。
参考文献:
[1]郗金标, 张福锁, 毛达如,等. 新疆盐生植物群落物种多样性及其分布规律的初步研究[J]. 林业科学, 2006,42(10):6-12.
XI J B, ZHANG F S, MAO D R,etal. Species diversity and distribution of halophytic vegetation in Xinjiang[J].ScientiaSilvaeSinicae, 2006,42(10):6-12.
[2]常丹, 张霞, 张富春. 盐穗木HcPEAMT基因的克隆及表达分析[J]. 西北植物学报, 2014,34(8):1 522-1 528.
CHANG D, ZHANG X, ZHANG F C. Cloning and expresion analysis ofHcPEAMTgene fromHalostachyscaspica[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014,34(8):1 522-1 528.
[3]ITURRIAGA G, MAF C, CUSHMAN J C. An EST catalogue from the resurrection plantSelaginellalepidophyllareveals abiotic stress-adaptive genes[J].PlantScience, 2006,170(6):1 173-1 184.
[4]ZHANG X, ZHEN J, LI Z,etal. Expression profile of early responsive genes under salt stress in upland cotton (GossypiumhirsutumL.)[J].PlantMolecularBiologyReporter, 2011,29(3):626-637.
[5]LUHUA S, HEGIE A, SUZUKI N,etal. Linking genes of unknown function with abiotic stress responses by high-throughput phenotype screening[J].PhysiologiaPlantarum, 2013,148(3):322-333.
[6]姚曼红, 曾幼玲. 极端耐盐植物盐穗木编码未知多肽基因HcUKPP的克隆与表达[J]. 中国生物化学与分子生物学报, 2012,28(3):261-266.
YAO M H, ZENG Y L. Cloning and expression of unknown polypeptide gene (HcUKPP) from extreme salt-tolerant plantHalostachyscaspica[J].ChineseJournalofBiochemistryandMolecularBiology, 2012,28(3):261-266.
[7]彭丹, 张霞, 张富春. 盐穗木功能未知蛋白(HcUKPP)的亚细胞定位[J]. 中国生物化学与分子生物学报, 2014,30(12):1 244-1 249.
PENG D, ZHANG X, ZHANG F C. Subcellular localization of function unknown protein (HcUKPP) fromHalostachyscaspica[J].ChineseJournalofBiochemistryandMolecularBiology, 2014,30(12):1 244-1 249.
[8]YOSHIKAWA S, MITSUI N, CHIKARA K I,etal. Effect of salt stress on plasma membrane permeability and lipid saturation in the salt-tolerant yeastZygosaccharomycesrouxii[J].JournalofFermentation&Bioengineering, 1995,80(2):131-135.
[9]MANSOUR M M F. Plasma membrane permeability as an indicator of salt tolerance in plants[J].BiologiaPlantarum, 2012,57(1):1-10.
[10]NATERA S H A, HILL C B, RUPASINGHE T W T,etal. Salt-stress induced alterations in the root lipidome of two barley genotypes with contrasting responses to salinity[J].FunctionalPlantBiology, 2016,43(2):207-219.
[11]CHAVES M M, FLEXAS J, PINHEIRO C. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell[J].AnnalsofBotany, 2009,103(4):551-560.
[12]NARAYAN O P,KUMARI N,RAI L C.Heterologous expresion ofAnabaenaPCC 7120all3940(a Dps family gene)protectsEscherichiacolifrom nutrient limitation and abiotic streses[J].BiochemicalandBiophysicalResearchCommunications, 2010,394(1):163-169.
[13]程刚, 兰海燕. 异子蓬PEPC基因原核表达及其重组菌在非生物胁迫下的耐受力解析[J]. 西北植物学报, 2015,35(9):1 767-1 775.
CHENG G, LAN H Y, Procaryotic expression of PEPC from halophyteSuaedaaralocaspicaand analysis of stress tolerance of the recombinant strain [J].ActaBotanicaBoreali-OccidentaliaSinica, 2015,35(9):1 767-1 775.
[14]GOLLERY M, HARPER J, CUSHMAN J,etal. What makes species unique? The contribution of proteins with obscure features[J].GenomeBiology, 2006,7(7):R57.
[15]GOLLERY M, HARPER J, CUSHMAN J,etal. POFs: what we don't know can hurt us[J].TrendsinPlantScience, 2007,12(11):492-496.
[16]DAVIES B W, WALKER G C. A highly conserved protein of unknown function is required bySinorhizobiummelilotifor symbiosis and environmental stress protection[J].JournalofBacteriology, 2008,190(3):1 118-1 123.
[17]SONG L, CIFTCIYILMAZ S, HARPER J,etal. Enhanced tolerance to oxidative stress in transgenicArabidopsisplants expressing proteins of unknown function[J].PlantPhysiology, 2008,148(1):280-292.
[18]OSAKABE Y, MIZUNO S, TANAKA H,etal. Overproduction of the membrane-bound receptor-like protein kinase 1, RPK1, enhances abiotic stress tolerance inArabidopsis[J].JournalofBiologicalChemistry, 2010,285(12):9 190-9 201.
[19]BHATOTIA K, KHATODIA S, KHURANA S. Abiotic stress specific phosphorylation in plant proteins: A review[J].CurrentAdvancesinAgriculturalSciences, 2015,7(2):95-100.
[20]LI J, SUN X, YU G,etal. Generation and analysis of expressed sequence tags (ESTs) from halophyteAtriplexcanescensto explore salt-responsive related genes[J].InternationalJournalofMolecularSciences, 2014,15(6):11 172-11 189.
[21]HUANG P, CHUNG M S, JU H W,etal. Physiological characterization of theArabidopsisthalianaoxidation-related zinc finger 1, a plasma membrane protein involved in oxidative stress[J].JournalofPlantResearch, 2011,124(6):699-705.

