中频电疗仪电气安全及电磁兼容整改实例
杨飞,赵旭,闫佩玉,刘斌,钟蕾,刘东红
1.北京市药品不良反应监测中心,北京 100035;2.北京市医疗器械检验所,北京 101111
引言
中频电疗仪是指应用频率1~100 kHz的电流治疗疾病的仪器。主要由主机,连接线,电极板等组成[1-2]。医疗器械不良事件是指获准上市的质量合格的医疗器械在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件[3]。
2012年3月7日,国家食品药品监督管理总局发布《医疗器械不良事件信息通报(2012年第2期)关注中频治疗仪使用风险》。自2002年1月~2011年11月,国家药品不良反应监测中心共收到关于中频治疗仪的可疑医疗器械不良事件报告104例,主要表现为皮肤红肿、烧伤、电击样麻木感等[4]。
为提高医疗器械上市后安全性,保障用械安全,对北京市13家中频电疗仪生产企业每家一台产品进行电气安全及电磁兼容性能检测,分析中频电疗仪在设计和生产等环节的风险及影响因素,并提出相应风险控制建议,指导企业技术改进,更加科学、全面地提高中频电疗仪安全性。
1 方法与内容
1.1 方法
以仪器检测方式为主,现场走访生产企业,提出技术改进建议,整改后并复检。
1.2 检测标准
(1)电气安全方面检测标准[5]:GB9706.1-2007(idt IEC60601-1:1988)《医用电气设备 第1部分:安全通用要求》[6];YY0607-2007(idt IEC60601-2-10:1987)《医用电气设备第2部分:神经和肌肉刺激器安全专用要求》[7]。
(2)电磁兼容方面检测标准[5]:YY0505-2012(idt IEC60601-1-2:2004)《医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》[8];YY0607-2007(idt IEC60601-2-10)《医用电气设备 第2部分:神经和肌肉刺激器安全专用要求》[7];GB 4824-2013(idt CISPR 11:2010)《工业、科学和医疗(ISM)射频设备 骚扰特性 限值和测量方法》[9];GB/T 17626.2-2006(idt IEC 61000-4-2:2001)《电磁兼容 试验和测量技术 静电放电抗扰度试验》[10];GB/T 17626.4-2008(idt IEC 61000-4-4:2004)《电磁兼容 试验和测量技术 电快速瞬变脉冲群抗扰度试验》[11];GB/T 17626.5-2008(idt IEC 61000-4-5:2005)《电磁兼容 试验和测量技术 浪涌(冲击)抗扰度试验》[12]。
1.3 检测内容
1.3.1电气安全方面检测内容
在检测经验以及中频电疗仪医疗器械不良事件风险综合评估基础上,此次共选取测试项目8项:① B型、BF型和CF型应用部分;② 控制器件和仪表的准确性;③ 电源电压波动;④ 输出参数限制;⑤ 外部标记;⑥ 外壳和防护罩;⑦ 保护接地、功能接地和电位均衡;⑧ 连续漏电流和患者辅助电流。
1.3.2电磁兼容方面检测内容
在检测经验以及中频电疗仪医疗器械不良事件风险综合评估基础上,此次共选取测试项目5项:传导发射项、辐射发射项、静电放电项、电快速瞬变脉冲群项和浪涌项(表1)。
1.4 样品信息
北京市13家中频电疗仪生产企业(标记为A公司到O公司)最新型号产品,每家各一台,共13台。
1.5 检测条件
为了统一测试条件,电气安全方面测试环境要求按照GB9706.1-2007中第8~12章的要求,对中频治疗仪样品在正常工作模式下进行试验。性能测试方法参考企业标准及产品说明书进行。电磁兼容方面测试中频治疗仪样品选取相近的工作模式进行试验。可概括为:发射测试中,选择最大输出电流工作模式,样品连续输出;抗扰度测试中,选择典型输出电流工作模式,样品连续输出。同时,参考了YY0607-2007专标中对于辐射发射试验的特殊布局和测试要求。

表1 电磁兼容方面测试项目
2 结果
2.1 整体检测结果
本次对13个不同厂家、13台不同型号的中频治疗仪类产品进行了电气安全(8项)和电磁兼容(5项)两大部分共13个分项目测试。只有1家全部项目合格,所占比率为7.69%,具体见表2。具体样品不合格项目,见表3。不合格项目统计结果,见表4。

表2 检测总体情况
从测试项目来看,B型、BF型和CF型设备,控制器件和仪表的准确性,电源电压波动,外壳和防护罩,保护接地、功能接地和电位均衡,漏电流和患者辅助电流通过率较高,所有检测样机均顺利通过测试,合格率达到100%。输出参数限制有2家不合格;外部标记有8家不合格;有2台样机由于控制电路设计的不合理引起样品的电流输出参数超过标准限值,输出参数限制不合格;浪涌项通过率较高,所有检测样机均顺利通过测试,合格率达到100%,说明此批次中频治疗仪的开关电源电路设计过关,抗浪涌能力较强;传导发射有3家不合格;辐射发射项通过率较低,6家不合格;电快速瞬变脉冲群项通过率最低,8家不合格;静电放电项,其通过率也较低,5家不合格。
2.2 整改方案
GB9706.1及YY0607已经在国内实施多年,生产厂家应对不符合样机进行相应的设计整改,使其符合标准要求。随着标准YY0505-2012对于Ⅱ类医疗器械强制检验的实施进程推进,建议生产厂家对不符合样机进行相应的电磁兼容设计整改,使其符合标准要求,提高该类产品的稳定性和安全性,降低使用者风险[13-16]。针对本次检测中不合格项目中具体不合格小项目,提出改进建议如下。
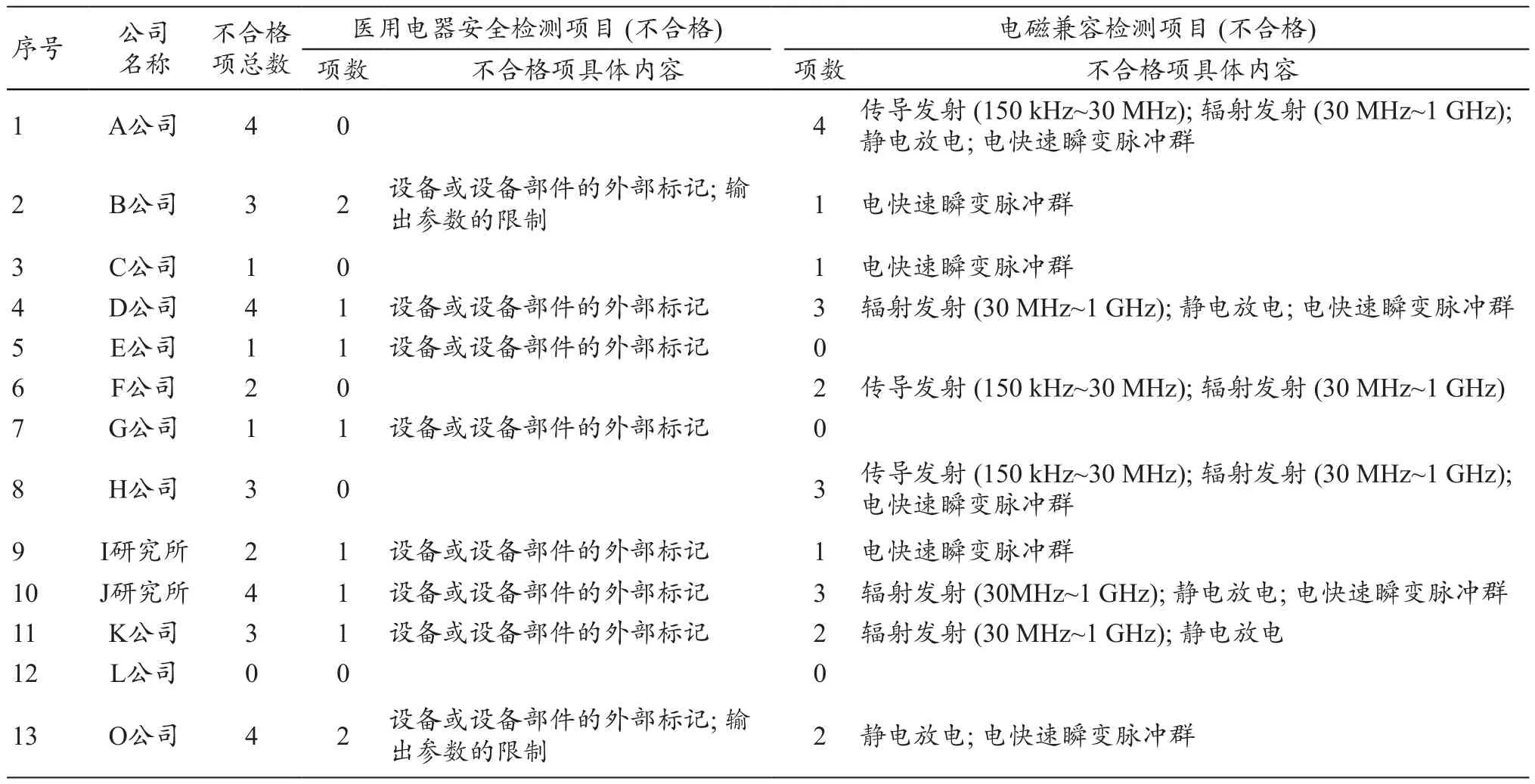
表3 具体公司样机总体不合格项目情况

表4 具体不合格项目统计
2.2.1外部标记
(1)标准条款:YY0607-2007(6.1)。
(2)标准要求:n)熔断器(可触及的,表明型号和标称)。
(3)改进建议:依照GB 9706.1-2007《医用电气设备第1部分:安全通用要求》的要求及YY 0607-2007 《医用电气设备 第3部分:神经和肌肉刺激器安全专用要求》的要求进行修改。熔断器的标识应该涵盖4个内容,分断速度,电流值,分断能力类型,电压值。
2.2.2输出参数限制
(1)标准条款:YY0607-2007(51.104)。
(2)标准要求:a)输出参数的限制,刺激器在500 Ω的负载电阻下,输出电流不能超过直流80 mA。
(3)改进建议:正确调试产品的直流电输出值,将数值严格控制在规定的80 mA内。
2.2.3传导发射(150 kHz~30 MHz)
(1)标准条款:GB4824-2013。
(2)改进建议:增加通信隔离模块,晶振源加强屏蔽和滤波,如在晶振管脚处增加磁珠滤波。
2.2.4辐射发射(30 MHz~1 GHz)
(1)标准条款:GB4824-2013。
(2)改进建议:① 合理设计控制电路;② 合理应用屏蔽滤波技术,对变压器输出电路增加高频滤波及磁屏蔽;对晶振外壳接地屏蔽,加强屏蔽(具体将晶振屏蔽罩与地线连接,可有效屏蔽辐射发射);电源线和输出线处理,在网电输入端和应用输出部分,对开关电源进行电路优化,增加滤波磁环,可有效抑制高频信号在导线上传导。
2.2.5静电放电
(1)标准条款:YY0505-2012条款36.202.1j)。
(2)改进建议:① 使电源及外壳的接地性良好:螺孔内绝缘漆去掉,检查所有螺钉的接地及松紧度,以改善外壳接地,针对电源金属螺钉,优化开关电源的接地能力,在按键及主机后方螺丝优化对地的连接;② 加大复位电路的抗干扰能力(加大复位电容的裕量);③ 输出端和电源输入端加入滤波磁环及滤波器。
2.2.6电快速瞬变脉冲群
(1)标准条款:YY0505-2012条款36.202.1j)。
(2)改进建议:① 完善瞬态抑制电路设计;② 良好接地:电源部分加装了滤波器并增加磁环,在产品内部增加脉冲群抑制器,增强仪器抗干扰能力,输出端和电源输入端加入滤波磁环及滤波器。
2.3 复检结果
本次专项检测主要针对有不合格项的产品经过企业技术整改后,有针对性地进行复检。初检结果为12家中频电疗仪生产企业的12台产品不合格,其中1家因改进技术力量不足,自动放弃复检,共11家企业11台产品参与复检。复检内容为对应生产专项检测初检不合格项,有针对性地进行复检。
2.3.1电气安全方面复检结果
本次对11个不同厂家的11台不同型号的中频治疗仪类产品进行了电气安全不合格项目复检。从检测结果看,11家全部合格,整改通过率为100%。电气安全方面技术整改前后情况对比结果,见表5和图1。
2.3.2电磁兼容方面复检结果
通过本次技术改进建议,厂家根据自身产品情况,进行有针对性的技术整改,电磁兼容方面复检结果为总体3家不合格,整改通过率为72.73%。其中传导发射,整改后,全部符合要求,通过率为100%;辐射发射、静电放电、电快速瞬变脉冲群3项分别有2家不合格,单项通过率都为81.82%,具体情况,见表6和图2。

图1 电气安全检测项目合格率对比图

图2 电磁兼容检测项目合格率对比图
2.3.3整体检测总结
通过本次技术改进建议,厂家根据自身产品情况,进行有针对性的电气安全和电磁兼容方面技术整改,产品合格率由初检合格率为7.69%,提升到复检合格率75.00%,产品整体安全性大幅提高近10倍,具体见表7和图3。
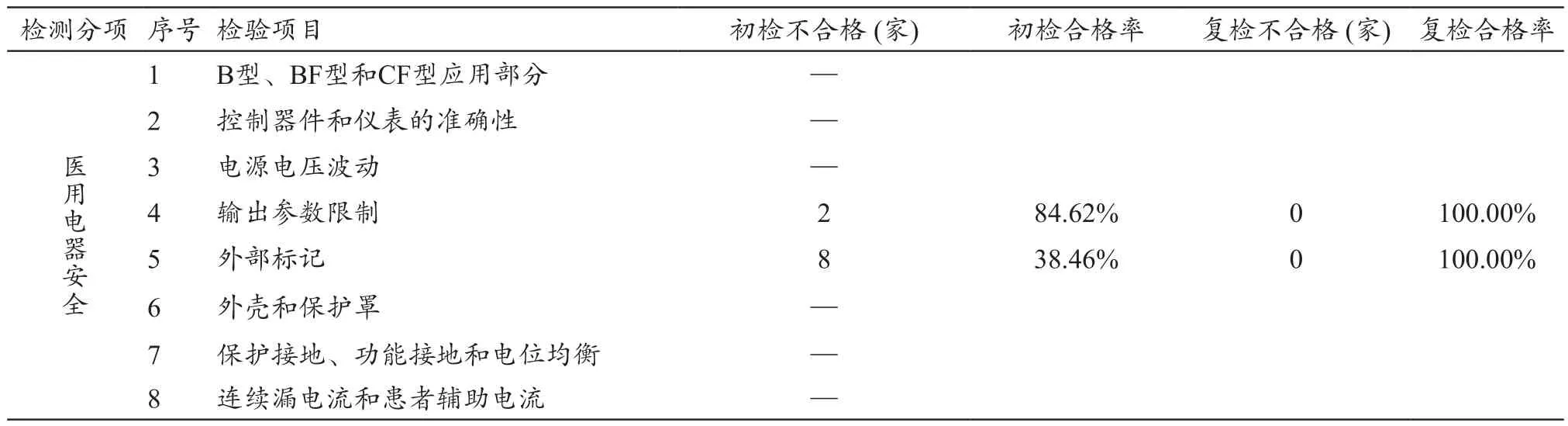
表5 电气安全方面技术整改前后情况对比

表6 电磁兼容方面技术整改前后情况对比

表7 检测总体情况对比
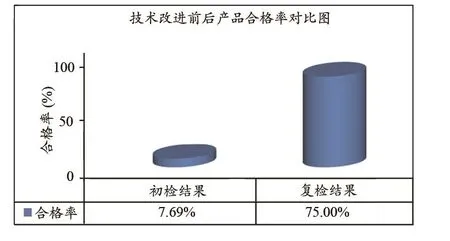
图3 技术改进前后产品合格率对比图
3 结论
企业进行有针对性的电气安全和电磁兼容方面技术整改,通过合理设计控制电路、合理应用屏蔽滤波技术、电源及外壳良好接地、加大复位电路的抗干扰能力、输出端和电源输入端加入滤波磁环及滤波器、完善瞬态抑制电路设计等方法,使产品合格率由初检合格率为7.69%,提升到复检合格率75.00%,产品整体安全性大幅提高近10倍,极大地提高了中频电疗仪安全性。
[参考文献]
[1] 乔志恒,华桂茹.理疗学[M].2版.北京:华夏出版社,2013.
[2] 刘克敏.物理疗法与作业疗法研究[M].2版.北京:华夏出版社,2012.
[3] 国家食品药品监督管理总局.医疗器械不良事件监测和再评价管理办法(试行)(国食药监械[2008]766号)[EB/OL].(2008-12-29)[2016-04-27].http://www.sda.gov.cn/.
[4] 国家药品不良反应监测中心.关注中频治疗仪使用风险[EB/OL].(2012-03-08)[2016-04-27].http://www.cdr-adr.org.cn/.
[5] 国家食品药品监督管理总局.中频电疗产品注册技术审查指导原则[EB/OL].(2013-10-23)[2016-05-09].http://www.sda.gov.cn/WS01/CL1421/96619.html.
[6] GB 9706.1-2007/IEC 60601-1:1988,医用电气设备 第1部分:安全通用要求[S].北京:中国标准出版社,2008.
[7] YY 0607-2007/IEC 60601-2-10:1987,医用电气设备 第2部分:神经和肌肉刺激器安全专用要求[S].北京:中国标准出版社,2007.
[8] YY 0505-2012,医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容要求和试验[S].北京:中国标准出版社,2012.
[9] GB 4824-2013/CISPR 11:2010,工业、科学和医疗(ISM)射频设备 骚扰特性 限值和测量方法[S].北京:中国标准出版社,2015.
[10] GB/T 17626.2-2006/IEC 61000-4-2:2001,电磁兼容 试验和测量技术 静电放电抗扰度试验[S].北京:中国标准出版社,2007.
[11] GB/T 17626.4-2008/IEC 61000-4-4:2004,电磁兼容 试验和测量技术 电快速瞬变脉冲群抗扰度试验[S].北京:中国标准出版社,2008.
[12] GB/T 17626.5-2008/IEC 61000-4-5:2005,电磁兼容 试验和测量技术 浪涌(冲击)抗扰度试验[S].北京:中国标准出版社,2008.
[13] 李澍,王权,任海萍,等.医疗器械电磁兼容整改方案的有效性分析[J].中国医疗设备,2014,29(8):121-124.
[14] 王乾方,牛帅,蒋岁,等.对输液泵辐射发射测试超标的整改实例[J].中国医疗器械杂志,2011,35(3):222-224.
[15] 孙京昇,孟志平,许峰,等.对多参数监护仪电磁兼容整改的研究[J].首都医药,2010,(10):8-10.
[16] 杨飞,钟蕾,焦立公,等.北京市医疗机构中频电疗仪使用情况调查报告[J].中国医疗设备,2016,31(12):124-130.

