锂-氧电池在几个关键科学问题上的最新进展
黄 俊,彭章泉
锂-氧电池在几个关键科学问题上的最新进展
黄 俊1,彭章泉2
(1中南大学化学化工学院,湖南 长沙 410083;2中国科学院长春应用化学研究所,电分析化学国家重点实验室,吉林 长春 130022)
本文评述了过去一年锂-氧电池在几个关键科学问题上的进展。涉及的科学问题包括:反应机理是什么?反应位点在何处?副反应由谁引发?
锂-氧电池;氧还原反应;反应位点;副反应

1 反应机理是什么
锂-氧电池氧正极的总反应如式(1)所示

十年前,研究者们对于这个反应知之甚少。近年来,人们围绕这个反应开展了一系列谱学研究才逐渐揭示其机理[4-7]。目前,如图1所示,一个普遍接受的反应机理如式(2)~式(5)所示[7]
(2)

(4)
(5)
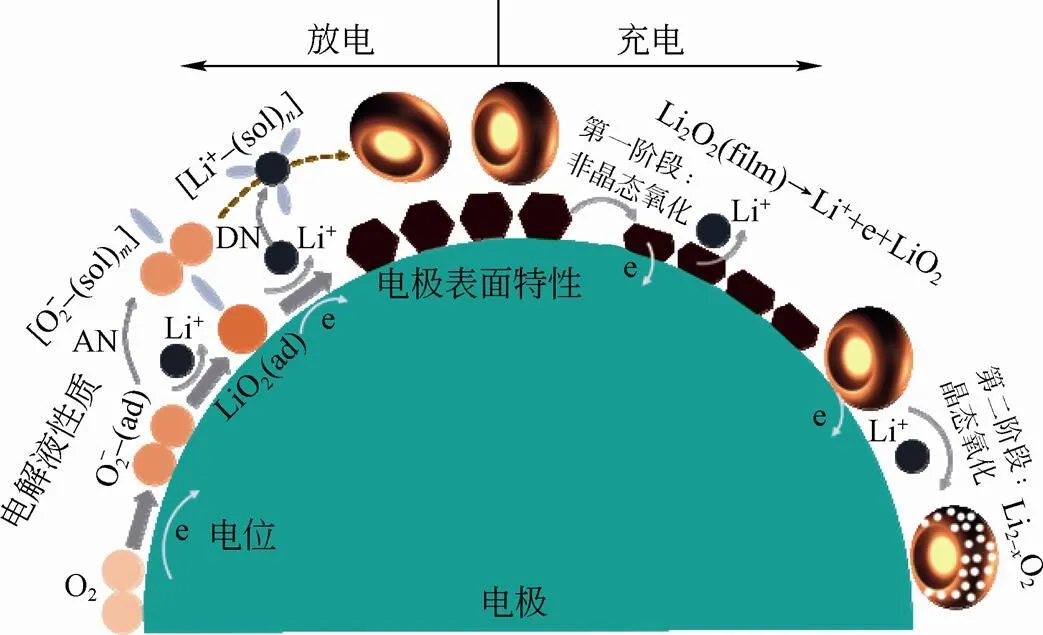
图1 锂-氧电池反应机理示意图


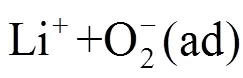
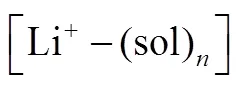

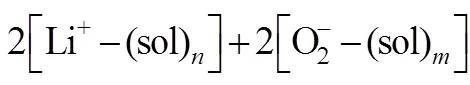
综上所述,在锂-氧电池中,同时涉及到表面反应机制和溶液反应机制。前者生成膜状过氧化锂,而后者生成算珠状过氧化锂。两种反应机制的相对优势由溶液性质、电极表面特性、电极电位等多种因素综合决定[5, 8-10]。至此,可以说我们基本掌握了 锂-氧电池的放电反应机理。但目前的了解只是定性的,我们还缺少一个描述上述反应机理的数学模型,以定量分析溶液性质、电极表面特性、电极电位等多个因素如何调控反应热力学、动力学和电池性能。此外,我们对于过氧化锂成核生长动力学知之甚少,“算珠状”这一特殊形状背后的数学物理机制仍然未解。
部分归功于初始状态的良好可控性,锂-氧电池放电反应机理逐渐出现一个被普遍接受的统一框架。相对而言,充电反应研究较少,且机理尚未明确。我们认为主要原因有两个:①充电过程严重依赖于难以精确调控的放电产物性质。因此不同课题组在研究充电反应机理时,其体系的初始状态可能不一致,导致了研究结论的多样性;②充电过程中的副反应比放电过程严重得多,增加了复杂性[3]。目前在充电反应机理上的几点重要认识包括:①理论上表明在较低过电位下(约0.2 V)Li+和电子就能够从Li2O2中脱出,形成Li2-O2[12]。实验中在3 V左右就能够检测到析出的O2,并用原位X射线衍射检测到了Li2-O2[13];②在充电过程中,非晶态Li2O2(如膜状Li2O2或者算珠状Li2O2表面存在的非晶态Li2O2)在较低过电势即可被氧化,然后随着充电过电位的提高,晶态Li2O2通过生成Li2-O2相而逐渐被氧化。因此,充电过程呈现明显的两阶段性[13];③充电过程初始阶段会生成Li2CO3等副反应产物,而随着电压升高,接着发生Li2CO3等副反应产物的分解。普遍认为,Li2CO3等副反应产物分解是造成充电过电势过高的主要原因,相关内容请参考最近关于锂空电池Li2CO3的综述[14]。可以说,充电反应机理研究目前还停留在现象描述阶段,中间产物和基元步骤尚未明确。因此,我们认为充电反应机理是锂-氧电池基础研究的薄弱环节,是亟待去开展的关键研究课题。
2 反应位点在哪里
锂-氧电池氧正极存在电极/Li2O2界面①和Li2O2/电解液界面。那么问题是,氧正极在充放电过程中的氧还原和析出反应发生在哪个界面?早期的理论计算都隐含一个假设,即反应发生在Li2O2/电解液界面[15-16]。但鲜有研究严肃讨论过这个假设的合理性。
我们首先简化考虑,假设Li2O2薄膜完全覆盖电极表面。如果反应发生在Li2O2/电解液界面,那么电子需经由Li2O2从电极传输到反应界面。理论计算和实验测量都表明Li2O2的电子传导率很低,即便是非晶态,也在10-13S/cm量级,并随着Li2O2厚度的增加而指数降低[17]。假设一个5 nm厚的Li2O2薄膜,电导率为10-13S/cm,那么0.1~0.5 V的过电压最多能维持2~10mA/cm2(这里的面积指真实反应面积)的电流。而实验中常常能够测量到100mA/cm2(这里的面积指电极几何面积)以上的电流密度[17]。因此,有研究认为反应不可能发生在Li2O2/电解液界面[17]。当然,这个估算里面有3个细节值得推敲:①真实反应面积很难准确测量,从电极几何面积推算真实反应面积任意性比较大;②目前Li2O2薄膜电子传导率是在开路、非原位情况下用电化学阻抗谱(electrochemical impedance spectroscopy,EIS)测量得到的,尚未有研究在充放电过程中原位测量Li2O2薄膜的电子传导率;③有研究者认为Li2O2表面是半金属态,因此电子可能通过Li2O2表面而非本体传输[18]。
WANG等[17]通过同位素标记和原位SERS表征方法,巧妙地证明了充放电反应都发生在电极/ Li2O2界面,其主要实验结果参见图2。他们首先将电池在18O2中放电,期间,SERS在Au电极上检测到了Li218O2。然后将气体切换为16O2时,SERS检测到Li218O2的峰强度在减弱,而Li216O2的峰强度在增加,直至最后Li218O2的信号完全消失。他们分析认为,放电反应发生在电极/Li2O2界面,新生成的Li216O2逐渐取代先前生成的Li218O2。在研究充电反应位置时,他们首先制备了一个Li218O2(先生成)和Li216O2(后生成)共存的电极。SERS显示在充电过程中该电极表面Li216O2首先被氧化,接着是Li218O2被氧化。因此认为充电反应也发生在电极/ Li2O2界面。这一观点隐含一个假设就是Li2O2薄膜是多孔的,Li+和氧气分子通过孔隙传输到反应界面。
我们也要注意到,文献中有不同的看法。HUANG等[19]基于EIS推断反应发生在Li2O2/电解液界面,其主要结果见图3。他们提出的EIS物理模型表明,如果反应发生在Li2O2/电解液界面,那么EIS结构会有两个半圆(一个对应电子在Li2O2中的传输与存储,另一个则对应Li2O2/电解液界面上的电化学反应与双电层充电)。如果反应发生在电极/Li2O2界面,那么电子无需在Li2O2中传输,因而EIS结构只有一个反应半圆。实验结果表明,在未经放电的初始状态,EIS结构只有一个半圆,而一经放电,则在高频段出现一个新的半圆。他们认为这个新出现的高频半圆对应电子在Li2O2中的传输与存储。此外,他们的数据表明,放电后电极表面的氧还原速率变快,活化能降低,见表1。他们分析认为,这是因为反应界面从原来的电极表面转换到了新生成的Li2O2表面。另外一个佐证是,实验观测到一经放电电池的平衡电位会比初始状态降低0.1 V左右[20]。如果反应一直发生在电极表面,氧还原平衡电位以及反应动力学放电前后的变化应该不明显。KUSHIMA等[21]用液态电池原位透射电子显微镜方法观察了充放过程中电极/电解液界面形貌的变化,他们的结论是放电过程中反应发生在Li2O2/电解液界面,而充电过程则发生在电极/Li2O2界面。此外,还有一种观点认为电极表面Li2O2薄膜不是连续的。放电反应发生在未被Li2O2薄膜覆盖的电极表面[22]。
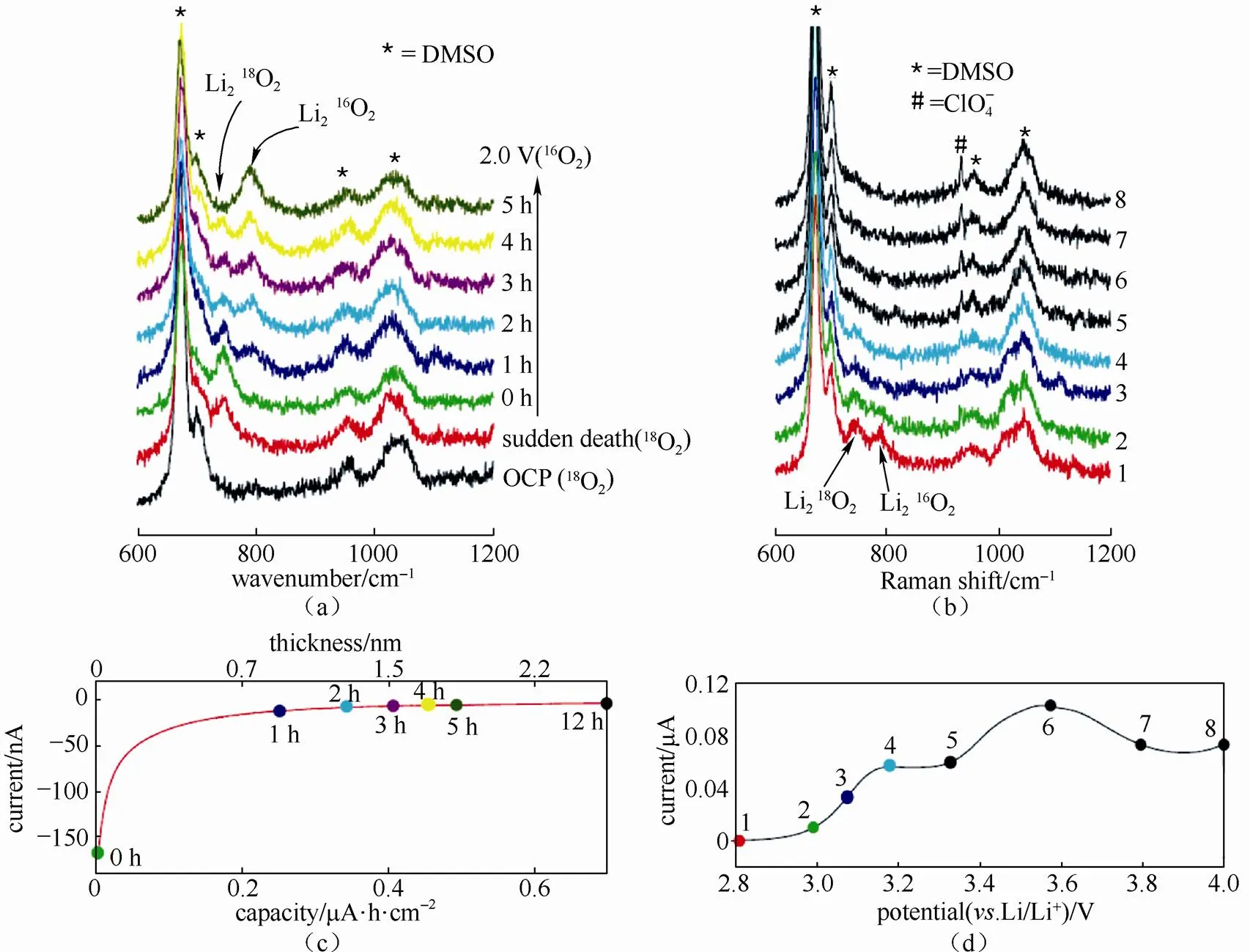
图2 在同位素标记氧气饱和的0.1 mol/L LiClO4 DMSO电解液中Au电极充放电过程中的原位SERS:(a)为开路电压下(open-circuit potential,OCP,黑线),18O2放电截止时(红线)以及紧接着在2.0 V下在16O2中放电不同时间点[(c)图为电流响应]的原位SERS;(b)为从2.8 V到4.0 V线性电压扫描(扫描速率为2 mV/s)时不同时间点的原位SERS [(d)图为电流响应][17]
确定反应位点是一个基本问题。目前看来,在这个问题的认识上还有较多争议。这个问题的复杂性,很大程度上源于Li2O2薄膜结构和功能上的复杂性,其中涉及的问题包括:①电极表面Li2O2薄膜是紧密的,还是多孔的?如果多孔,那么孔隙率是多少?②氧气分子是否可以穿过Li2O2薄膜?如果可以,扩散系数是多少?③充电反应与放电反应一定发生在同一界面吗?④充放电过程中电极表面Li2O2薄膜在原位湿润状态下的电子、离子传导率是多少?⑤电极表面Li2O2薄膜是连续的吗?⑥ Li2O2表面电子和离子传导率是多少?表面传输路径能否支撑发生在电极/Li2O2界面的反应?
图3 应用EIS来研究锂氧电池界面动力学:(a)反应发生在Li2O2/电解液界面;(b)反应发生在电极/Li2O2界面;(c)针对(a)和(b)两种情形的模型仿真的EIS(Bode图),其中红线表示在(a)情形下Li2O2对应的贡献[19]
3 副反应由谁引发


上述第二个问题直到最近一两年才取得重大突破。早在2013年,BRUCE课题组[28]通过同位素标记方法发现碳电极在3.5 V以上会分解。这是出乎意料的,因为一般认为碳电极在4.0 V以下都是稳定的[29]。BRUCE课题组[28]推断可能是Li2O2氧化过程的反应中间产物导致了碳电极的氧化分解。有研究者猜测这个反应中间产物可能是单线态氧1O2[30]。然而一直没有直接的实验证据来证实这一观点。直到2016年,WANDT等[29]用原位电子顺磁共振谱(electron paramagnetic resonance,EPR)在充电过程中检测到了1O2,主要实验结果如图4(a)所示。预载Li2O2的Vulcan电极充电至3.65 V以上时,4-Oxo-TEMP捕集单线态氧生成的4-Oxo-TEMPO的EPR信号强度增强,即证明了Li2O2在3.65 V以上氧化时产生了1O2这一反应中间产物。WANDT等进一步估计析出氧中0.5%(下限值)是1O2,并由此推断,1O2是造成充电过程中电解液和碳电极氧化分解的引物。
在2017年,MAHNE等[31]进一步证明,充放电过程中都会产生1O2,且充电过程中产生的更多,从而成功解释了为什么充电过程的副反应比放电过程严重很多。MAHNE等的结果表明一开始充电就有1O2产生,而不是WANDT等声称的需要充电 至3.65 V,如图4(b)~4(c)。MAHNE等认为1O2是锂-氧电池中副反应的主要引物。最近关于1O2的 几个工作是锂-氧电池机理研究中的重要实质性进展,开启了1O2作为主要副反应引物的新篇章,开辟了通过捕获或者转换1O2来抑制副反应的新方 向[23, 25-26]。
4 结 语
在发展已经比较成熟的领域,人们往往短时间内不能直接感受到围绕关键科学问题开展的基础研究对应用研究和工程实践的巨大意义。而在锂-氧电池这个正快速发展的领域,基础研究的强大指导作用及时可见。我们通过介绍几个发表于2017年前后的具体研究,来主张探寻科学问题、开展基础研究的价值与意义,以作为本文的结尾。

从对充电反应机理的研究可知,电极表面副产物的聚集是导致充电过电势过高的主要原因。据此,ZHOU等[34]设计了一种具有超强溶解能力的电解液——六甲基磷酰胺(hexamethylphosphoramide, HMPA)。相比于传统醚类电解液,HMPA对Li2O2、LiOH以及Li2CO3的溶解能力大大提升,从而充电过电势和循环性能都得到显著改善。
在锂-氧电池领域,人们借用先进表征技术已经揭示了放电主反应中间产物和反应路径,观测了充电过程的现象并推测了可能的反应机理,基于第一性原理计算了反应热力学和动力学细节,并在副反应引物和机理上取得了突破性进展。需进一步研究的关键科学问题包括:①多路径统一、热力学与成核生长动力学统一的反应机理数学模型;②充电反应的中间产物和基元过程;③不同晶态、不同形状Li2O2在表面和本体、面向和法向的电子和离子传导率的原位测量;④充放电过程中1O2的生成与转换机制。
[1] FREUNBERGER S A. True performance metrics in beyond-intercalation batteries[J]. Nature Energy, 2017, 2: doi: 10.1038/nenergy.2017.91.
[2] HUANG J, LI Z, ZHANG J. Review of characterization and modeling of polymer electrolyte fuel cell catalyst layer: The blessing and curse of ionomer[J]. Frontiers in Energy, 2017, 11(3): 334-364.
[3] AURBACH D, MCCLOSKEY B D, NAZAR L F, et al. Advances in understanding mechanisms underpinning lithium-air batteries[J]. Nature Energy, 2016, 1: doi: 10.1038/NENERGY.2016.128.
[4] PENG Z, FREUNBERGER S A, HARDWICK L J, et al. Oxygen reactions in a non-aqueous Li+electrolyte[J]. Angewandte Chemie International Edition, 2011, 50(28): 6351-6355.
[5] ZHANG Y, ZHANG X, WANG J, et al. Potential-dependent generation of O2-and LiO2and their critical roles in O2reduction to Li2O2in aprotic Li-O2batteries[J]. The Journal of Physical Chemistry C, 2016, 120(7): 3690-3698.
[6] BELOVA A I, KWABI D G, YASHINA L V, et al. Mechanism of oxygen reduction in aprotic Li-air batteries: The role of carbon electrode surface structure[J]. The Journal of Physical Chemistry C, 2017, 121(3): 1569-1577.
[7] WANG L, ZHANG Y, LIU Z, et al. Understanding oxygen electrochemistry in aprotic LiO2batteries[J]. Green Energy & Environment, 2017, 2(3): 186-203.
[8] AETUKURI N B, MCCLOSKEY B D, GARCíA J M, et al. Solvating additives drive solution-mediated electrochemistry and enhance toroid growth in non-aqueous Li-O2batteries[J]. Nature Chemistry, 2015, 7(1): 50-56.
[9] JOHNSON L, LI C, LIU Z, et al. The role of LiO2solubility in O2reduction in aprotic solvents and its consequences for Li-O2batteries[J]. Nature Chemistry, 2014, 6(12): 1091-1099.
[10] KWABI D G, BRYANTSEV V S, BATCHO T P, et al. Experimental and computational analysis of the solvent-dependent O2/Li+O2-redox couple: standard potentials, coupling strength, and implications for lithium-Oxygen batteries[J]. Angewandte Chemie International Edition, 2016, 55(9): 3129-3134.
[11] LUO L, LIU B, SONG S, et al. Revealing the reaction mechanisms of Li-O2batteries using environmental transmission electron microscopy[J]. Nature Nanotechnology, 2017, 12: doi: 10.1038/NNANO.2017.27.
[12] KANG S, MO Y, ONG S P, et al. A facile mechanism for recharging Li2O2in Li-O2batteries[J]. Chemistry of Materials, 2013, 25(16): 3328-3336.
[13] GANAPATHY S, ADAMS B D, STENOU G, et al. Nature of Li2O2oxidation in a Li-O2battery revealed by operando X-ray diffraction[J]. Journal of the American Chemical Society, 2014, 136(46): 16335-16344.
[14] ZHAO Z, HUANG J, PENG Z. Achilles' heel of Li-air batteries: Li2CO3[J]. Angewandte Chemie International Edition, 2017, doi: 10.1002/ange.201710156
[15] HUMMELSHøJ J S, BLOMQVIST J, DATTA S, et al. Communications: Elementary oxygen electrode reactions in the aprotic Li-air battery[J]. The Journal of Chemical Physics, 2010, 132(7): 71101.
[16] MO Y, ONG S P, CEDER G. First-principles study of the oxygen evolution reaction of lithium peroxide in the lithium-air battery[J]. Physical Review B, 2011, 84(20): 205446.
[17] WANG J, ZHANG Y, GUO L, et al. Identifying reactive sites and transport limitations of oxygen reactions in aprotic lithium-O2batteries at the stage of sudden death[J]. Angewandte Chemie International Edition, 2016, 55(17): 5201-5205.
[18] RADIN M D, SIEGEL D J. Charge transport in lithium peroxide: Relevance for rechargeable metal-air batteries[J]. Energy & Environmental Science, 2013, 6(8): 2370-2379.
[19] HUANG J, TONG B. Probing the reaction interface in Li-O2battery using electrochemical impedance spectroscopy: Dual roles of Li2O2[J]. Chemical Communications, 2017, 53: 11418-11421.
[20] CUI Z H, GUO X X, LI H. Equilibrium voltage and overpotential variation of nonaqueous Li-O2batteries using the galvanostatic intermittent titration technique[J]. Energy & Environmental Science, 2015, 8(1): 182-187.
[21] KUSHIMA A, KOIDO T, FUJIWARA Y, et al. Charging/discharging nanomorphology asymmetry and rate-dependent capacity degradation in Li-oxygen battery[J]. Nano Letters, 2015, 15(12): 8260-8265.
[22] LAU S, ARCHER L A. Nucleation and growth of lithium peroxide in the Li-O2battery[J]. Nano Letters, 2015, 15(9): 5995-6002.
[23] LUNTZ A C, MCCLOSKEY B D. Li-air batteries: Importance of singlet oxygen[J]. Nature Energy, 2017, 2: doi: 10.1038/nenergy.2017.56.
[24] LIM HD, LEE B, BAE Y, et al. Reaction chemistry in rechargeable Li-O2batteries[J]. Chemical Society Reviews, 2017, 46(10): 2873-2888.
[25] MAHNE N, FONTAINE O, THOTIYL M O, et al. Mechanism and performance of lithium-oxygen batteries-A perspective[J]. Chemical Science, 2017, 8(10): 6716-6729.
[26] VEGGE T, GARCIA-LASTRA J M, SIEGEL D J. Lithium-oxygen batteries: At a crossroads?[J]. Current Opinion in Electrochemistry, 2017, 6(1): 100-107.
[27] ZHANG X, GUO L, GAN L, et al. LiO2: Cryosynthesis and chemical/electrochemical reactivities[J]. The Journal of Physical Chemistry Letters, 2017, 8(10): 2334-2338.
[28] OTTAKAM THOTIYL M M, FREUNBERGER S A, PENG Z, et al. The carbon electrode in nonaqueous Li-O2cells[J]. Journal of the American Chemical Society, 2013, 135(1): 494-500.
[29] WANDT J, JAKES P, GRANWEHR J, et al. Singlet oxygen formation during the charging process of an aprotic lithium-oxygen battery[J]. Angewandte Chemie, 2016, 128(24): 7006-7009.
[30] HASSOUN J, CROCE F, ARMAND M, et al. Investigation of the O2electrochemistry in a polymer electrolyte solid-state cell[J]. Angewandte Chemie International Edition, 2011, 50(13): 2999-3002.
[31] MAHNE N, SCHAFZAHL B, LEYPOLD C, et al. Singlet oxygen generation as a major cause for parasitic reactions during cycling of aprotic lithium-oxygen batteries[J]. Nature Energy, 2017, 2: doi: 10.1038/nenergy.2017.36.
[32] GAO X, CHEN Y, JOHNSON L R, et al. A rechargeable lithium–oxygen battery with dual mediators stabilizing the carbon cathode[J]. Nature Energy, 2017, 2: doi: 10.1038/nenergy.2017.118.
[33] ZHANG Y, WANG L, ZHANG X, et al. High-capacity and high-rate discharging of a coenzyme Q10-catalyzed Li-O2battery[J]. Advanced Materials, 2017, doi: 10.1002/adma.201705571.
[34] ZHOU B, GUO L, ZHANG Y, et al. A high-performance Li-O2battery with a strongly solvating hexamethylphosphoramide electrolyte and a LiPON-protected lithium anode[J]. Advanced Materials, 2017, 29(30): 1701568.
Progress in key scientific issues of Li-O2batteries
HUANG Jun1, PENG Zhangquan2
(1College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, Hunan, China;2State Key Laboratory of Electroanalytical Chemistry, Changchun Institute of Applied Chemistry, Chinese Academy of Science, Changchun 130022, Jilin, China)
This paper briefly reviews the progress in the past year about the understanding of several key scientific issues in Li-O2batteries, including deciphering the reaction mechanism, discerning the reaction site, and discovering the origin of parasitic reactions.
Li-O2battery; oxygen reduction; reaction site; parasitic reactions
10.12028/j.issn.2095-4239.2018.0002
TM 911
A
2095-4239(2018)02-0167-08
2018-01-10;
2018-01-16。
国家自然科学基金项目(91545129、21575135、21733012、21633008和21605136),中国科学院战略性先导科技专项(XDA09010401),吉林省科技厅项目(20150623002TC,20160414034GH)。
黄俊(1989—),男,特聘副教授,研究方向为电化学界面和多孔电极理论,E-mail:jhuangelectrochem@qq.com;
彭章泉,研究员,研究方向为基础电化学(电极动力学, 现场光/质谱电化学, 电极反应的第一性原理计算)、锂-离子电池、金属-空气电池,E-mail:zqpeng@ciac.ac.cn。
①在本文中,电极/Li2O2界面实际上是电极/电解液界面,因为电解液会浸润多孔Li2O2薄膜。
编者按:储能科学与技术的发展日新月异,新的储能体系不断涌现并取得实质性进展,鉴于此,在第二届编委会的建议下,本刊自2018 年起设立“新储能体系”栏目,栏目主编为中国科学院物理所李泓 研究员。该栏目将组织报道新的储能体系的工作原理,关键材料,器件设计和组成,关键科学与技术问题,目前技术指标水平,技术成熟度,未来发展展望,新储能体系可能针对的应用市场等。文章以 约稿为主,同时接受自由来稿,期待您的参与!本栏目得到北京卫蓝新能源科技有限公司的大力支持!

