线性氟代碳酸酯添加剂DTFEC对锂硫电池性能的影响
陈振营,周晶晶,杨 军,王久林,努丽燕娜
线性氟代碳酸酯添加剂DTFEC对锂硫电池性能的影响
陈振营,周晶晶,杨 军,王久林,努丽燕娜
(上海电化学能源器件工程技术研究中心,上海交通大学化工系,上海 200240)
锂硫(Li-S)电池具有比锂离子电池更高的能量密度,是近10年来的研究热点,但目前锂硫电池的循环性能和倍率性能远远不能满足人们的需求。在本研究中,二(2,2,2-三氟乙基)碳酸酯(DTFEC)作为一种电解液添加剂应用到锂硫电池中,以提高电池的电化学性能,并对DTFEC的添加量进行了筛选和优化。结果表明,DTFEC的添加量对电池性能有很大的影响,当添加体积分数为5% 时,复合硫正极材料(S@pPAN)表现出最佳的循环稳定性和倍率性能。室温条件下进行充放电测试,在1C的充放电电流下,锂硫电池在循环200圈后容量保持率比常规电解液约高20%;在7C的大倍率充放电电流下,依然可以得到1246.3mA·h/g的可逆比容量。以上结果表明,DTFEC可以有效提高锂硫电池的电化学性能,是一种适合用于锂硫电池电解液体系的添加剂。
锂硫电池;DTFEC;添加剂;电化学性能
经过二十多年的发展,锂二次电池已被广泛应用到消费电子产品中,如手机、相机、电脑等,同时伴随动力电池的研究和开发,锂二次电池已广泛应用到汽车中,这也直接推动了近年来新能源电动汽车的蓬勃发展。与此同时,人们对更高比能量、更长使用寿命、更低成本及环境友好型锂二次电池的需求也更加迫切[1]。锂硫电池和传统锂离子电池相比具有更高的理论比容量(1672 mA·h/g)和能量密度(2567 W·h/kg),满足人们对高比能量电池的需求,逐渐成为当今研究的热点,同时硫材料还具有原料丰富、价格便宜和低毒性等特点,适合商业化推广[2-5]。
硫正极材料可以分为两类:一类是与碳酸酯类溶剂不兼容,硫元素以单质硫(S8)的形式嵌入到导电材料中,硫单质和基体材料之间不存在化学键,我们通常称其为单质硫正极材料,这种硫正极材料通常只适用于醚类电解液[6-7];第二类正极材料与碳酸酯溶剂有很好的兼容性,以小分子硫的形式分散在导电基体中或者和碳之间有化学键的相互作用,称之为小分子复合硫正极材料[8-9]。本课题组合成了以PAN为碳骨架的S@pPAN复合硫正极材料,并对其在碳酸酯类电解液中的电化学性能展开了一系列研究[10],该材料不存在单质硫正极的多硫离子的“穿梭效应”,和商用碳酸酯类电解液有很强的兼容性。但S@pPAN复合硫正极材料在传统商业化电解液 1 mol/L LiPF6/EC-DMC (1∶1,体积比)中的循环稳定性仍不理想。虽然S@pPAN的电子电导率(10-4S/cm)相比硫(10-30S/cm)提高了26个数量级,但S@pPAN正极材料的倍率性能依然差强人意。
为了解决以上问题,人们做了一系列的改进。石墨烯具有优异的电子导电性,越来越多的应用到电池领域,王久林等[11]采用原位聚合的方法制备了PAN/GNS 复合材料,并以之为前驱体制备了硫基复合材料 S@pPAN/GNS,在0.2 C的充放电电流下,循环300圈后容量保持率为88.8%,10 C下可逆容量为700 mA·h/g。CHEN等[12]通过在复合硫正极材料中掺入纳米氧化物颗粒,增加了正极材料的表面粗糙度,扩大了反应区域,从而提高了正极材料活性。首次可逆充放电容量达到了1223 mA·h/g,提高了循环稳定性和倍率性能。
除了对电极本身的改性,对电解液体系的改进进行了研究。CHEN等[13]研究了一系列的凝胶电解质以提高S@pPAN的电化学性能,PVDF/HFP/PMMA/5%(质量分数)MMT电解质室温下电导率达到3.06 mS/cm,首次放电容量为1418 mA·h/g,在循环100圈后容量为1071 mA·h/g。添加剂作为最经济有效的方法,一直以来受到人们的青睐。硝酸锂(LiNO3)作为一种无机盐添加剂,在常规Li-S电池醚类电解液中被广泛应用[14-16],LiNO3的加入提高了电池的可逆容量和库仑效率,增强了电池的循环稳定性。HOLLENKAMP等[17]研究了离子液体(C4mpyr-TFSI)作为添加剂对锂硫电池的影响,并将其和硝酸锂混合使用,得到了更好的效果。三(2,2,2-三氟乙烷基)亚磷酸盐(TTFP)、乙氧基五氟环磷腈(PFPN)、三(三甲代甲硅烷基)硼酸盐(TMSB)都曾作为添加剂[18-20],在锂离子电池或锂硫电池中得到使用,有效提高了电池的性能。
DTFEC作为一种直链氟代碳酸酯,曾被作为共溶剂或添加剂用于锂离子电池中[21-22],研究表明其对碳负极和Li1.2Mn0.525Ni0.175Co0.1O2正极材料都具有一定的保护作用。本工作将DTFEC添加到常规电解液1 mol/L LiPF6/EC-DMC(1∶1,体积比)中,有效降低了电极与电解液的界面阻抗,提高了Li-S电池的循环性能和倍率性能,二(2,2,2-三氟乙基)碳酸酯,简称DTFEC,是一种较为新型的氟代碳酸酯。与传统的碳酸酯相比,氟原子取代传统有机溶剂上的氧原子后,可燃性的氧含量会有所降低,抑制了溶剂的燃烧可能性,氟代有机溶剂具有较高的闪点,不易燃,将这种有机溶剂添加到有机电解液中,有助于改善电池在受热、过充电等状态下的安全性能[23-24]。
1 实验材料和方法
1.1 材 料
聚丙烯腈(AR,美国Sigma-Aldrich公司),升华硫、β-环糊精(AR,国药化学试剂集团),双氧水(30%,质量分数,国药集团化学试剂有限公司),六氟磷酸锂、碳酸乙烯脂、碳酸二甲酯(电池级,深圳新宙邦科技有限公司),二(2,2,2-三氟乙基)碳酸酯(电池级,惠州市大道新材料科技有限公司),导电碳super P(电池级,Timcal),隔膜(Celgard 2400)。
1.2 分析测试仪器
电池测试系统,LAND-CT2007A,武汉市金诺电子有限公司;扫描电子显微镜,JSM-7401F,日本JEOL公司;电导率仪FE30和inLab 710电极,Metteler- Toledo;电化学工作站,CHI 760E ,上海辰华仪器有限公司;AUTOLAB,PGSTAT302N,METROHM;元素分析仪,Vario EL III,Elementar。
1.3 S@pPAN正极材料的制备
将升华硫和PAN粉末以8∶1的质量比分散到乙醇中,然后在行星式球磨机中以400 r/min转速充分球磨4 h,使材料混合均匀。将球磨后的浆料在60 ℃下烘干后装于石英舟中,在300 ℃氩气气氛下烧制8 h,得到黑色的硫基复合材料。通过元素分析仪测定材料硫含量为43%。
1.4 羰基-β-环糊精黏结剂的制备
在20 mL密闭样品瓶中,加入质量比为1∶1的-环糊精和质量分数为30%的H2O2溶液。在 90 ℃下反应24 h;然后打开瓶盖蒸掉大部分的水分和过氧化氢,最后干燥的材料在100 ℃下真空烘干24 h,除去痕量水分,即可得到棕色羰基--环糊精粉末。
1.5 电解液的配制
由于购买的锂盐和溶剂都为电池级,所以不再进行提纯等后处理。电解液的配制全程在手套箱(MB-10 compact,MBRAUN)中操作,水含量和氧含量都小于0.1 mg/cm3。首先将EC/DMC/DTFEC以不同比例混合,室温下磁力搅拌1~2 h,DTFEC在溶剂总体积中的比例分别为3%、5%、10%、15%、20%,然后将1mol/L LiPF6缓慢加入,继续搅拌5~8 h。
1.6 S@pPAN复合正极的制备和电池组装
将制得的S@pPAN、羰基--环糊精和super P 导电剂按质量比 80∶10∶10 混合,加入适量蒸馏水作为分散剂,室温下磁力搅拌6~8 h。将混合均匀的浆料涂覆在涂碳铝箔上, 65 ℃下真空干燥 6 h,随后用12 mm的冲头冲成圆形极片,在0.5 MPa的压强下将极片压实,称量后在60 ℃下真空烘干2 h,然后迅速转移到手套箱备用,极片的平均重量为1.5~2 mg/cm2。
以S@pPAN为正极、锂片为负极、Celgard 2400 作为隔膜,在手套箱(MB-10 compact,MBRAUN)中装备CR2016扣式电池,每个电池电解液用量为50~70 μL。
1.7 电化学测试
电解液电导率测试。在手套箱配制不同DTFEC含量的电解液,将所用电导率仪和电极用标准溶液进行矫正标定,然后将所用测试仪器一并放入手套箱备用。每一种电解液进行3次平行实验测试,然后计算平均值。测试温度为25 ℃。
电池的充放电测试在室温25 ℃下进行,采用武汉LAND-CT2007A电池测试系统进行测试,充放电电压范围为1~3 V(. Li/Li+),本文所指的比容量是以极片中硫质量计算而得。
循环伏安测试(CV)采用上海辰华CHI 760E进行测试,测试电压区间为1~3 V(. Li/Li+),扫描速率为0.6 mV/s、0.7 mV/s、0.8 mV/s、0.9 mV/s、1.0 mV/s。
交流阻抗谱(EIS)测试在AUTOLAB PGSTAT302N(Metrohm)上进行,测试频率范围为1 MHz~0.01 Hz。
2 实验结果与讨论
2.1 电解液电导率分析
图1为添加不同体积分数的DTFEC后,电解液的电导率变化。DTFEC含量在5%以内对电导率的影响不大,当添加量多于5%时,电导率下降明显。这也是氟代溶剂的共同缺点,氟具有较强的吸电子效应,因此溶剂氟代之后会降低溶剂的DN值,降低溶剂对锂盐的溶解能力。电导率影响电池性能,尤其是倍率性能,所以选择适量的添加剂对电池的性能有重要影响。
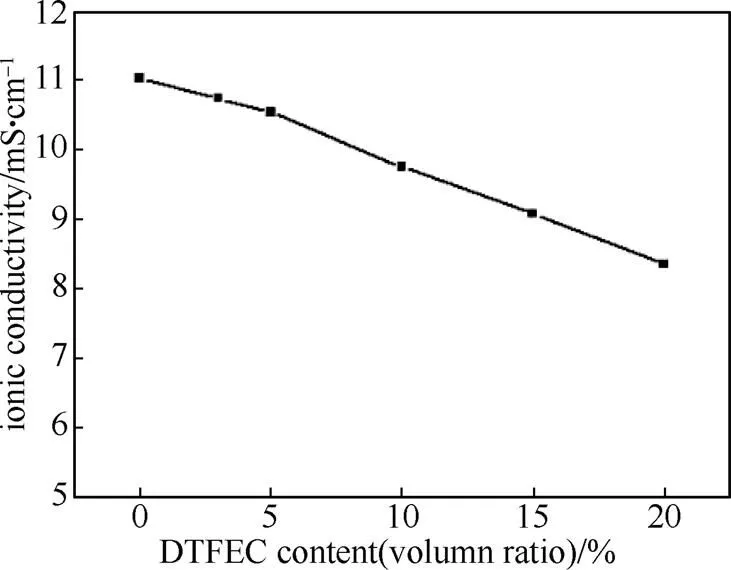
图1 添加不同体积分数DTFEC电解液的电导率
2.2 电池在不同含量DTFEC电解液中的电化学 性能分析
图2(a)是室温条件下,Li-S电池在不同比例DTFEC中的循环性能和库仑效率图,充放电倍率为1 C。由图可知,添加DTFEC后可以提高电池的循环稳定性。通过对比发现,当添加剂的体积分数为5%时,电池的循环性能达到最佳,这是因为DTFEC添加会使电导率降低,但当添加量很少时对电极不足以形成保护。图2(b)为电池的充放电曲线特征图,在未加入DTFEC的电解液体系中,在1C的充放电电流密度下,首次放电比容量为1714.9 mA·h/g,充放电效率为82.04%,可以看到首次放电比容量要略高于S的理论容量1672 mA·h/g,造成这种现象的原因主要有两个,其一,pPAN共轭骨架会与Li+发生不可逆反应;其二,电解液在电极表面形成SEI膜及发生其它副反应,产生不可逆容量。第二圈的可逆容量为1388.7 mA·h/g,随着循环次数的增加,电池容量衰减速率会越来越快。经过200圈循环后剩余992.3 mA·h/g,容量保持率为71.5%。当在电解液中添加5% 的DTFEC时,电池的首次放电比容量为1787.0 mA·h/g,比未加添加剂的放电容量要高,产生这种差别的原因是DTFEC会在放电过程中发生分解,在电极表面成膜,产生不可逆容量。第二圈的可逆容量为1378.1 mA·h/g,可逆容量略低于空白电解液的原因可能是由于电解液的导电率降低所造成,经过200次充放电循环后,电池放电比容量为1244.3 mA·h/g,容量保持率约为90.3%。由图2(b)可知,添加DTFEC可以明显降低电池极化,反映出DTFEC的添加降低了电池的阻抗。虽然在循环过程中,有无DTFEC的电解液都表现出很高的库仑效率,但是添加DTFEC的电池体系表现出更加稳定的库仑效率,这也与更加稳定的SEI膜形成有关。
图3(a)为电池在不同电解液中的倍率性能图。加入适量的DTFEC可以提高电池的倍率性能,含量不同产生的效果差别也很大,这也和电解液电导率有很大的关系。当添加剂的体积分数为5%时,Li-S电池表现出最好的倍率性能,在7 C的充放电倍率下,电池的可逆容量为1246.3 mA·h/g,不加DTFEC时,可逆容量降低为1029.8 mA·h/g。由图可以看出到添加量为20% 时,DTFEC对倍率性能的提高已经微乎其微,甚至在高倍率下出现放电容量低于不加添加剂的情况,结果表明电解液的电导率对电池的倍率性能影响很大。图3(b)和3(c)为电池在不同倍率下的充放电曲线,在加入5% DTFEC电解液体系中,不同充放电倍率下的起始放电电压由2.33 V(0.5 C)降低到2.07 V(7 C),而不加DTFEC的电解液体系中,起始放电电压由2.34 V(0.5 C)降低到1.92 V(7 C),加入5% DTFEC可以明显降低电池的极化。
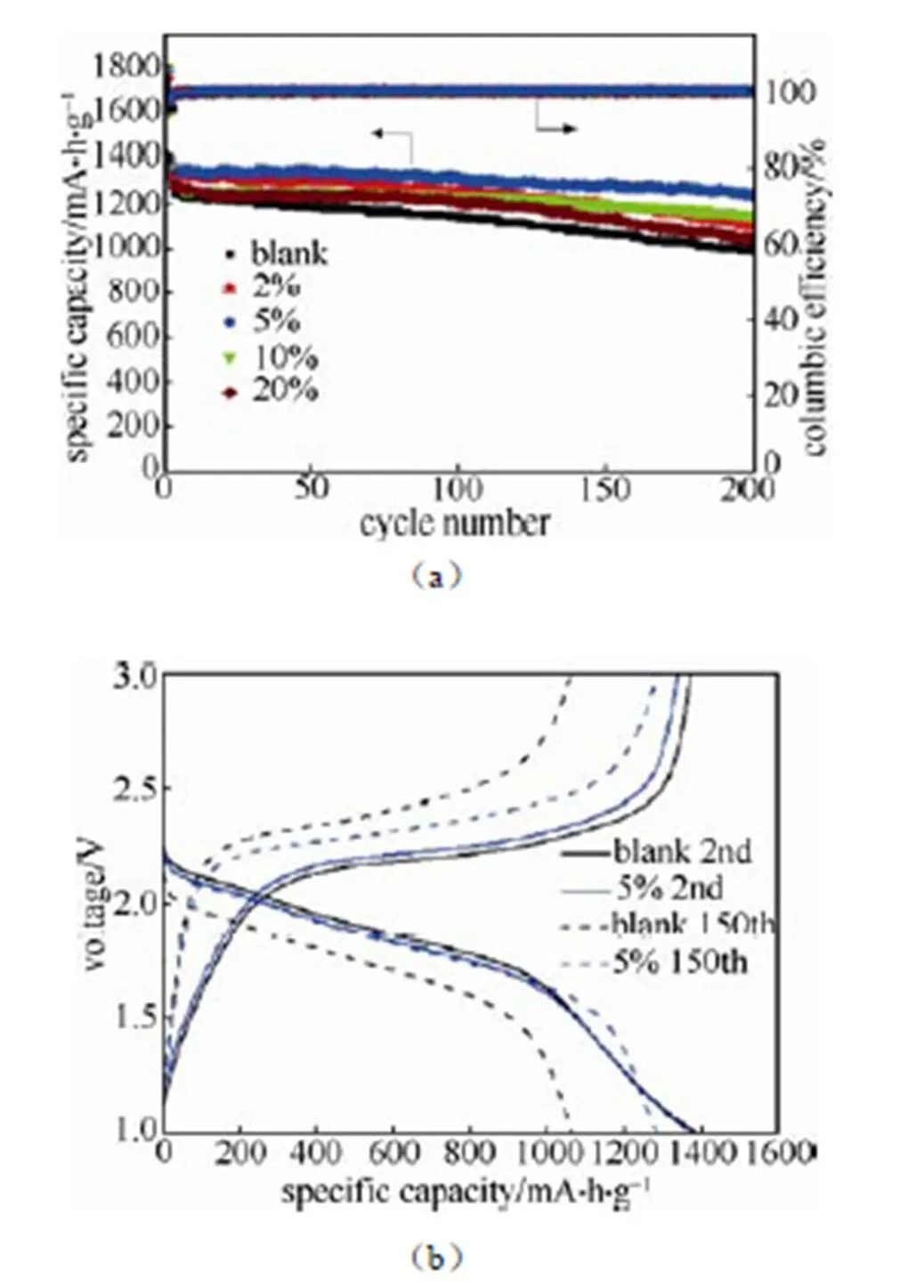
图2 在1 C倍率下,(a)电池在添加不同比例DTFEC电解液中的循环性能;(b)电池在常规电解液和添加5% DTFEC电解液中第2圈及第150圈的充放电曲线
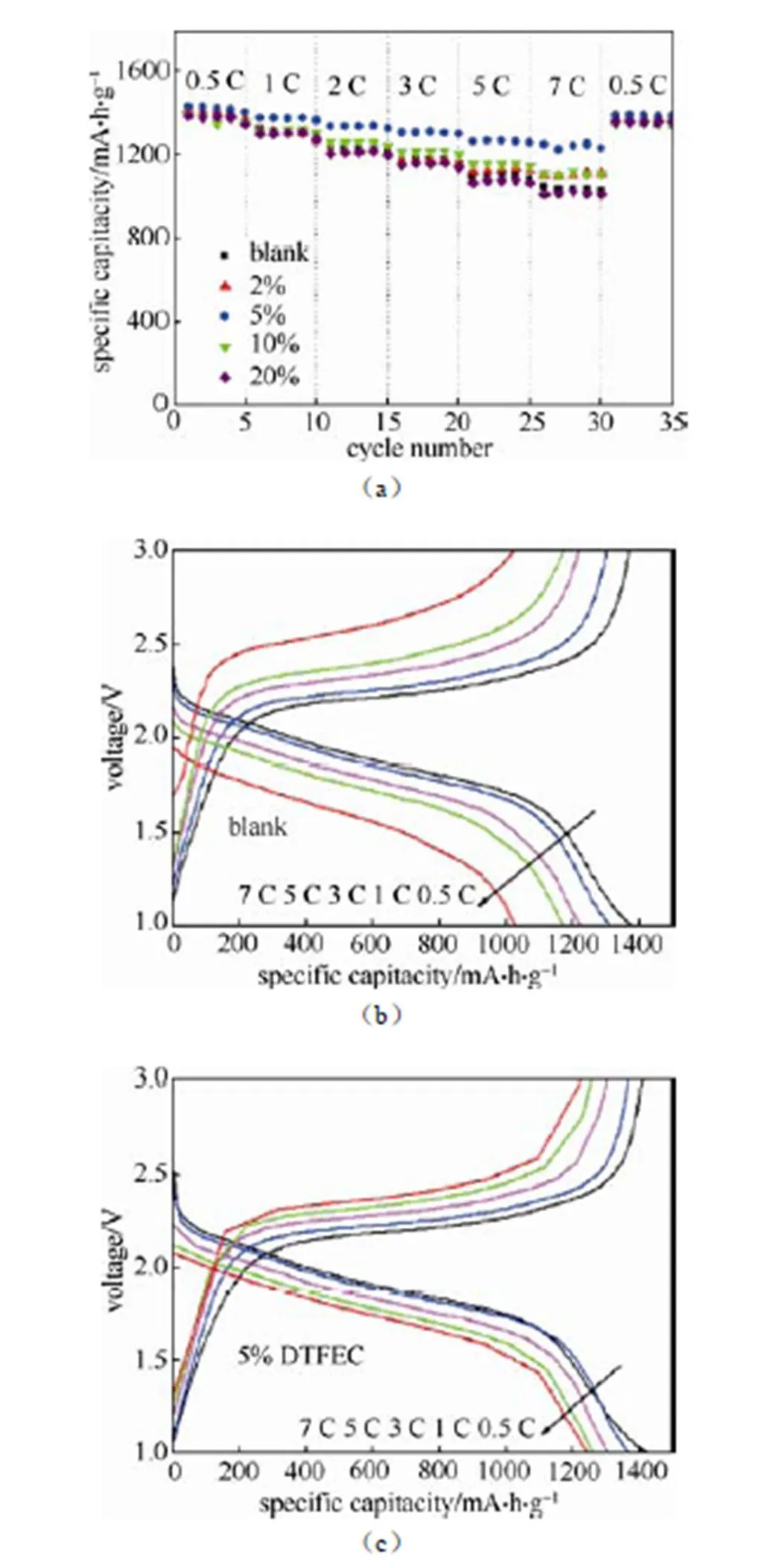
图3 电池在添加不同比例DTFEC电解液中的倍率性能(a);(b)常规电解液和(c)添加5% DTFEC电解液在不同倍率下的的充放电曲线
如图3(a)和3(b)所示,为了探究DTFEC对Li-S电池的影响机理,在1mol/L LiPF6-EC/DMC (blank)电解液和添加了5% DTFEC电解液体系中,分别测试了Li-S电池的交流阻抗图谱。分别在电池满充状态(2.3 V)下,测试了未循环状态、第1圈、第30圈的交流阻抗。表1中所列为经过拟合后的阻抗数据。e为电解液本体阻抗,f为电极与电解液间的界面阻抗,0为锂离子在电极中的扩散阻抗。在电池未循环状态下,添加5% DTFEC的电解液本体阻抗(e)要高于未加添加剂的电解液,这也反映出两者之间电导率的差别;电极与电解液的界面阻抗(f)也要比未加添加剂的高,由此推测出DTFEC在电极表面形成了一层阻抗比较大的界面膜。但在第一圈循环后,f的值要远远小于不加DTFEC的电池体系,这是由于DTFEC在电极表面形成的界面膜组分在充放电过程中发生了变化,重新形成了阻抗更小的界面膜。随着充放电循环的进行,两种电解液体系的界面阻抗(f)都在增加,但很显然添加5% DTFEC的阻抗增加更为缓慢,体现了DTFEC对电极界面的保护。
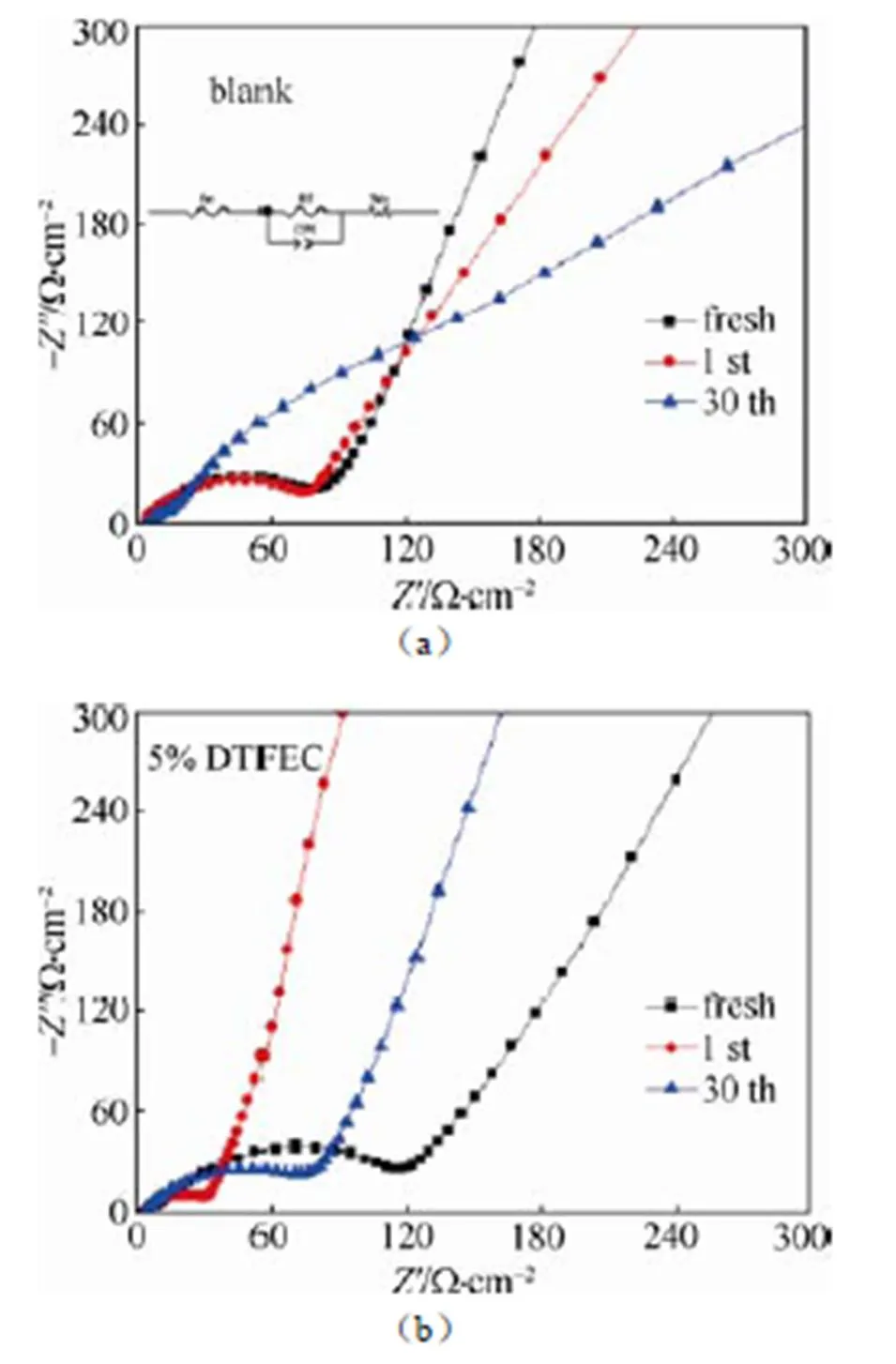
图4 电池在常规电解液(a)和添加5% DTFEC电解液(b)中的交流阻抗图,插图为拟合电路

表1 Re和Rf值随循环次数的变化
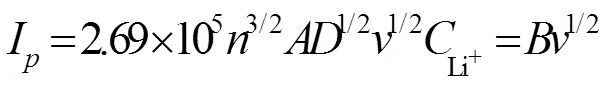
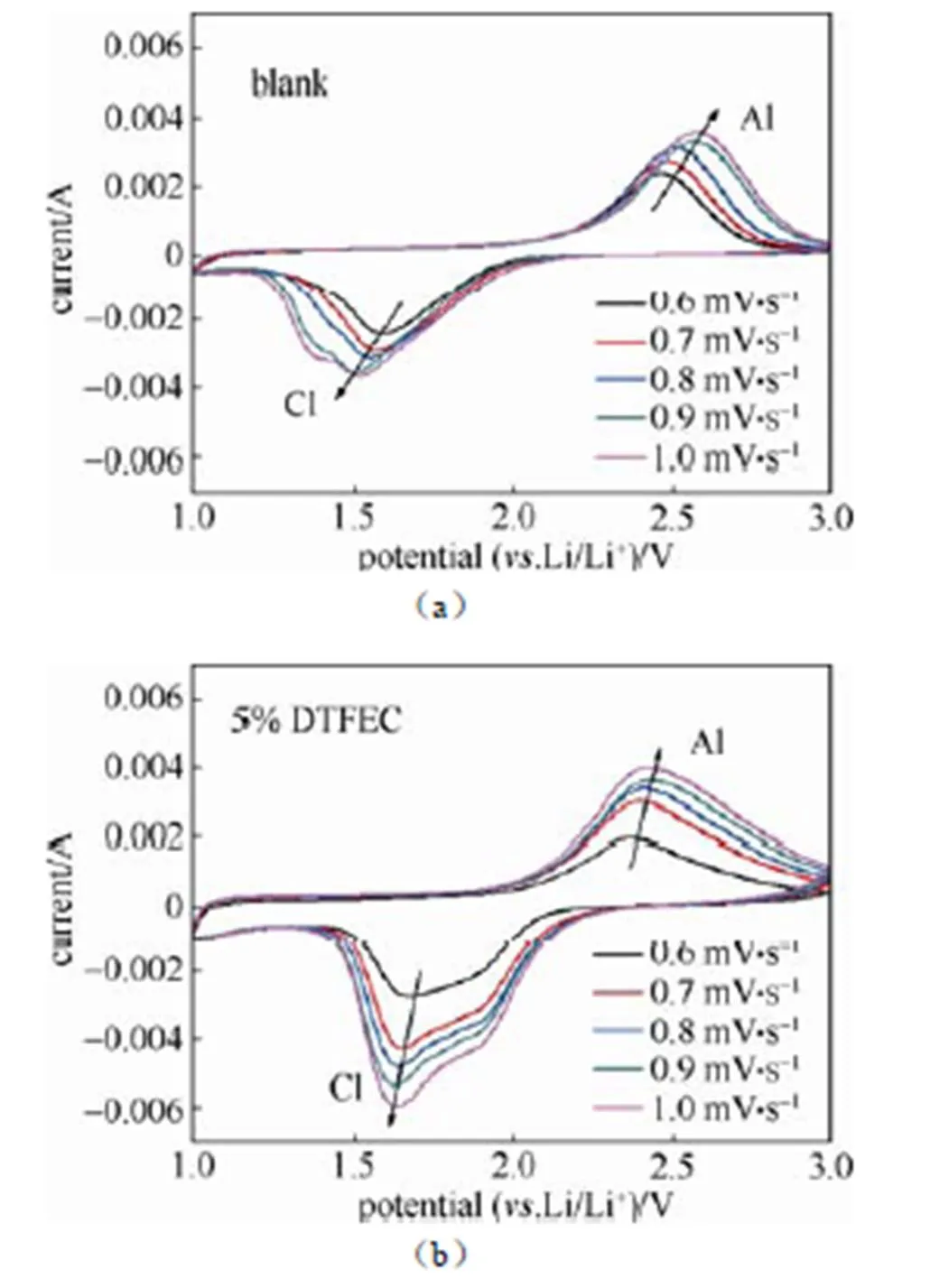

表2 不同电解液中锂离子扩散系数的拟合计算结果
2.3 添加剂对极片形貌影响的分析
将循环100圈后的电池拆开,使用扫描电镜对循环100圈后的极片进行形貌分析。发现未加DTFEC电解液体系中循环后的极片表面比较粗糙,极片的完整性也遭到了一定的破坏。而添加DTFEC后,极片表面比较平滑,极片的完整性也比较好。在宏观上体现了DTFEC在充放电过程中对极片的保护作用。

图6 (a)循环前S@pPAN极片和(b)在常规电解液;(c)添加5% DTFEC电极液中循环100圈后的SEM图
3 结 论
(1)本工作针对提高Li-S电池的循环和倍率性能展开了研究,将二(2,2,2-三氟乙基)碳酸酯(DTFEC)作为电解液添加剂,首次应用到S@pPAN和常规电解液锂硫电池体系中。
(2)通过对添加比例的筛选发现,当DTFEC的体积分数为5%时,可以最有效地提高Li-S电池的循环与倍率性能。在1 C的充放电倍率下,可逆容量在200圈后可以保留90.3%,在7 C的充放电倍率下也可以得到1246.3 mA·h/g的可逆容量。
(3)结果分析表明,添加5% DTFEC后可以降低电极与电解液的界面阻抗,提高锂离子在电极的扩散系数,在循环过程中可以对极片进行有效的 保护。
[1] ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451(7179): 652-657.
[2] THACKERAY M M, WOLVERTON C, ISAACS E D. Electrical energy storage for transportation—Approaching the limits of, and going beyond, lithium-ion batteries[J]. Energy & Environmental Science, 2012, 5(7): 7854-7863.
[3] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11(1): 19-29.
[4] MARMORSTEIN D, YU T H, STRIEBEL K A, et al. Electrochemical performance of lithium/sulfur cells with three different polymer electrolytes[J]. Journal of Power Sources, 2000, 89(2): 219-226.
[5] 邓南平, 马晓敏, 阮艳莉, 等. 锂硫电池系统研究与展望[J]. 化学进展, 2016, 28(9): 1435-1454.
DENG N P, MA X M, RUAN Y L, et al. Research and prospect of lithium-sulfur battery system[J]. Progress in Chemistry, 2016, 28(9): 1435-1454.
[6] GAO J, LOWE M A, KIYA Y, et al. Effects of liquid electrolytes on the charge-discharge performance of rechargeable lithium/sulfur batteries: Electrochemical and-X-ray absorption spectroscopic studies[J]. Journal of Physical Chemistry C, 2011, 115(50): 25132-25137.
[7] YIM T, PARK M S, YU J S, et al. Effect of chemical reactivity of polysulfide toward carbonate-based electrolyte on the electrochemical performance of Li-S batteries[J]. Electrochimica Acta, 2013, 107(2013): 454-460.
[8] WEI S Y, MA L, HENDRICKSON K E, et al. Metal-sulfur battery cathodes based on PAN-sulfur composites[J]. Journal of the American Chemical Society, 2015, 137(37): 12143-12152.
[9] WANG J L, HE Y S, YANG J. Sulfur-based composite cathode materials for high-energy rechargeable lithium batteries[J]. Advanced Materials, 2015, 27(3): 569-575
[10] ZHANG Y G, ZHAO Y, YERMUKHAMBETOVA A, et al. Ternary sulfur/polyacrylonitrile/Mg0.6Ni0.4O composite cathodes for high performance lithium/sulfur batteries[J]. Journal of Materials, 2013, 1(2): 295-301.
[11] WANG J L, YANG J, XIE J Y, et al. A novel conductive polymer-sulfurcomposite cathode material for rechargeable lithium batteries[J].Advanced Materials, 2002, 14(13/14): 963-965.
[12] WANG J L, YIN L C, JIA H, et al. Hierarchical sulfur-based cathode materials with long cycle life for rechargeable lithium batteries[J]. ChemSusChem, 2014, 7(2): 563-569.
[13] ZHANG Y G, ZHAO Y, BAKENOV Z, et al. Poly(vinylidene fluoride-co-hexafluoropropylene)/poly(methylmethacrylate)/nanoclay composite gel polymer electrolyte for lithium/sulfur batteries[J]. Journal of Solid State Electrochemistry, 2014,18(4): 1111-1116.
[14] BARCHASZ C, LEPRETRE J C, ALLOIN F, et al. New insights into the limiting parameters of the Li/S rechargeable cell[J]. Journal of Power Sources, 2012, 199(1): 322-330.
[15] LIANG X, WEN Z Y, LIU Y, et al. Improved cycling performances of lithium sulfur batteries with LiNO3-modified electrolyte[J]. Journal of Power Sources, 2011, 196(22): 9839-9843.
[16] ZHANG S S. New insight into liquid electrolyte of rechargeable lithium/sulfur battery[J]. Electrochimica Acta, 2013, 97(5): 226-230.
[17] BARGHAMADI M, BEST A S, BHATT A I, et al. Effect of LiNO3additive and pyrrolidinium ionic liquid on the solid electrolyte interphase in the lithiume-sulfur battery[J]. Journal of Power Sources, 2015, 295(2015): 212-220.
[18] WANG J L, LIN F J, JIA H, et al. Towards a safe lithium-sulfur battery with a flame-inhibiting electrolyte and a sulfur-based composite cathode[J]. Angewandte Chemie International Edition, 2014, 53(38): 10099-10104.
[19] 沈旺, 雷智鸿, 谢李生, 等. 多功能添加剂PFPN 对可充锂硫电池的影响[J]. 储能科学与技术, 2016, 5(4): 397-403.
SHEN W, LEI Z H, XIE L S, et al. Multi-functional additive PFPN for rechargeable lithium sulfur battery with composite cathode materials[J]. Energy Storage Science and Technology, 2016, 5(4): 397-403.
[20] WANG L N, LI Q Y, YANG H J, et al. Superior rate capability of a sulfur compositecathode in a tris(trimethylsilyl)borate-containing functional electrolyte[J]. Chemical Communications, 2016, 52(100): 14430-14433.
[21] SMART M C, RATNAKUMAR B V, RYAN-MOWREY V S, et al. Improved performance of lithium-ion cells with the use of fluorinated carbonate-based electrolytes[J]. Journal of Power Sources, 2003, 119(6): 359-367.
[22] PHAM H Q, NAM K M, HWANG E H, et al. Performance enhancement of 4.8 V Li1.2Mn0.525Ni0.175Co0.1O2battery cathode using fluorinated linear carbonate as a high-voltage additive[J]. Journal of the Electrochemical Society, 2014, 161(14): 2002-2011.
[23] HIANG H F, JIN Q Y, WANG R, et al. Nonflammable electrolyte for 3V lithium-ion battery with spinel materials LiNi0.5Mn1.5O4and Li4Ti5O12[J]. Journal of Power Sources, 2008, 179(1): 351-356.
[24] LALIA B S, YOSHIMOTO N, EGASHIMOTO M, et al. A mixture of triethylphosphate and ethylene carbonate as a safe additive for ionic liquid-based electrolytes of lithium ion batteries[J]. Journal of Power Sources, 2010, 195(21): 7426-7431.
[25] DAS S R, MAJUMDER S B, KATIYAR R S. Kinetic analysis of the Li+ion intercalation behavior of solution derived nano-crystalline lithium manganate thin films[J]. Journal of Power Sources, 2005, 139(1): 261-268.
[26] JUNG H G, HASSOUN J, PARK J B, et al. An improved high-performance lithium-air battery[J]. Nature Chemistry, 2012, 4(7): 579-585.
[27] YUAN L, QIU X, CHEN L, et al. New insight into the discharge process of sulfur cathode byelectrochemical impedance spectroscopy[J]. Journal of Power Sources, 2009, 189(1): 127-132.
Improved performance of lithium sulfur battery with the fluorinated linear carbonate DTFEC as addictive
CHEN Zhenying, ZHOU Jingjing,YANG Jun, WANG Jiulin, NULI Yanna
(Shanghai Electrochemical Energy Devices Research Center, Department of Chemical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China)
Lithium sulfur (Li-S) battery with the high theoretical energy density has been considered as the most promising next generation of rechargeable batteries, being the research hot topic in the last 10 years. However, the cycle and rate performances could not satisfy the actual requirements. Here, di-2,2,2-trifluoroethyl carbonate (DTFEC) has been investigated as electrolyte addictive to improve the electrochemical performances of the Li-S batteries for the first time. The electrochemical test results show that the additive has a great influence on the performance of the battery and which is related to the amount of addition. With 5% DTFEC (volume ratio) added, the sulfur composite (S@pPAN) cathodes exhibit the best cycle stability and rate performance at room temperature. The capacity retention is improved about 20% compared with conventional electrolyte after 200 cycles at 1C and the reversible capacity is maintained at about 1246.3 mA·h·g-1even at 7 C. This study indicates that DTFEC is a favorable additive in conventional liquid electrolytes for rechargeable lithium sulfur batteries.
lithium sulfur (Li-S) batteries; DTFEC; addictive; electrochemical performances
10.12028/j.issn.2095-4239.2017.0166
TM 911
A
2095-4239(2018)02-0255-07
2017-11-22;
2017-12-06。
国家重点基础研究发展计划(2014CB932303)。
陈振营(1992—),男,硕士研究生,主要研究方向为高比能量锂二次电池电解液开发及负极保护,E-mail:zhenying@sjtu.edu.cn;
杨军,教授,主要研究方向为锂(和镁)金属二次电池关键材料,E-mail:yangj723@sjtu.edu.cn。

