川藏地区牦牛牛病毒性腹泻病毒分子流行病学调查及分离鉴定
陈新诺,肖 敏,3,阮文强,覃思楠,岳 华,2,汤 承,2,张 斌,2*
(1. 西南民族大学生命科学与技术学院,成都 610041;2. 国家民族事务委员会青藏高原动物疫病防控创新团队,成都 610041;3. 四川省龙日种畜场,红原 624400)
牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)属单股正链RNA病毒,与猪瘟病毒(classical swine fever virus, CSFV)和边界病病毒(border disease virus, BDV)同属黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus)[1-2]。BVDV作为其中重要的病毒之一,在国内外广泛存在,且宿主广泛,包括牛、羊、山羊、猪、牦牛、鹿和骆驼等[3-4]。 BVDV进入宿主机体后可造成持续性感染与免疫抑制,持续感染动物的血清抗体为阴性,但却终身带毒并排毒,因此对养牛业及其他动物养殖业均造成了巨大的危害[5-6]。BVDV最重要特征是其遗传的多样性[7-8],基于细胞病变效应(cytopathic effect, CPE),可将BVDV分为两组生物型,致细胞病变型(cytopathic biotype, cp)和非致细胞病变型(noncytopathic biotype,ncp)。在BVDV基因组中,E2基因是瘟病毒的重要保护性抗原编码的基因,在瘟病毒结构蛋白基因中变异较大,代表着毒株的遗传特性,而5′-UTR和Npro基因均是瘟病毒最保守的基因,因此5′-UTR、Npro和E2常用于瘟病毒及BVDV的遗传多样性分析。根据5′-UTR将BVDV分为两个不同的遗传物种,即BVDV-1型和BVDV-2型[9-10]。BVDV-1型可进一步分为1a~1u亚型,BVDV-2型可进一步分为2a~2d亚型[10-13]。近年来,四川、西藏等地区的流行病学调查显示,BVDV流行范围广泛[14-15],新型亚型的鉴定明显增加,BVDV基因组的遗传多样性发生了显著变化[10,16]。然而,牦牛BVDV毒株的分离鉴定及针对牦牛BVDV系统的遗传进化研究尚属空白。因此在本研究中,我们系统调查了2016年川藏部分地区腹泻牦牛粪便BVDV的发病率和主要亚型,并分离培养出牦牛两株BVDV-1a和1d亚型毒株。
1 材料与方法
1.1 试验材料
1.1.1样本及细胞系从四川和西藏地区共收集30至60日龄的腹泻牦牛的粪便样本,共计149份。取材地点情况:西藏自治区,N27°38′31.34″, E89°02′27.94″,海拔4 284 m;四川省,N31°32′31.03″,E101°40′07.82″,海拔 3 605 m。本研究所用的细胞MDBK(Madin-Darby bovine kidney)由本实验室保存,BVDV标准毒株 OregonC24V 购自中国食品药品检定研究院。
1.1.2主要试剂与仪器QuickTaqHS DyeMix购自TOYOBO东洋纺生物科技有限公司;MarkerⅡ、PrimeScriptTMRT试剂盒均购自大连宝生物公司;Tirzol试剂盒(RNAiso Plus)购于上海英骏生物科技有限公司。DMEM培养液和胎牛血清购自Gibco公司,异硫氰酸荧光素(FITC)标记的兔抗羊IgG购自美国Abbkine公司,含DAPI的Fluoroshield固定剂购自美国Abbkine公司。BVDV多克隆抗体购自美国VMRD公司。高速离心机5804购自Eppendor公司;普通PCR仪、核酸蛋白电泳仪、凝胶成像系统VersaDoc2000为Bio-Rad公司产品。OLMPS IX71型荧光显微镜购自TOKYO公司。
1.1.3引物参照文献[10,17]中引物序列,合成BVDV的特异性引物BVDV-P1~BVDV-P6用于扩增5′-UTR、Npro来进行分子流行病学调查及分子分型。根据GenBank上已发表的BVDVE2基因序列,应用Primer Premier 6软件设计特异性引物BVDV-P7和BVDV-P8(BVDV-P7:AAYGTGCCACRAHACWGC;BVDV-P8:TRCCCATCATSACYAYTTCYC)对E2基因进行扩增和序列分析。所有引物均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1总RNA提取和反转录将粪便样品按1∶5加入灭菌生理盐水研磨,经反复冻融后,取上清液加入青霉素/链霉素(0.1 mg·mL-1)混匀,以3 000 r·min-1离心20 min,取上清液。参照上海英骏生物科技有限公司Trizol试剂盒(RNAisoPlus)说明书,提取牦牛BVDV总RNA。取处理后的样本悬液500 μL加入 700 μL的Trizol,室温静置10 min;加入200 μL氯仿,强烈振荡15 s室温静止5 min;4 ℃ 12 000 r·min-1离心15 min,取上清液;加入等体积的异丙醇充分颠倒混匀,室温静置10 min;4 ℃ 12 000 r·min-1离心15 min,弃上清液,加入1 mL 75%(经DEPC处理过的灭菌水配制)乙醇;4 ℃ 12 000 r·min-1离心5 min,弃上清液,用 15 μL经DEPC处理过的无菌水溶解沉淀,-70 ℃保存备用。利用PrimeScriptTMRT试剂盒将RNA反转录成cDNA并置于-20 ℃待用。
1.2.2BVDV的RT-PCR扩增与检测以反转录后的cDNA为模板,进行PCR扩增反应。反应体系如下:QuickTaqHS DyeMix 5 μL,上下游引物均为10 pmol·L-1各0.5 μL,cDNA模板1 μL,加ddH2O 3 μL;PCR反应条件为94 ℃预变性2 min,94 ℃变性30 s,52 ℃退火30 s,68 ℃延伸1 min,共35个循环,72 ℃延伸8 min,4 ℃保存,取扩增产物经琼脂糖凝胶核酸电泳和凝胶成像扫描仪进行检测与分析。扩增片段胶回收,连接pMD19-T载体后,转化到E.coliDH5α感受态细胞中,筛选重组质粒,送由上海生工生物有限公司测序。
1.2.3进化关系分析应用DNAStar、CLUSTAL W 软件将测序样本的序列与GenBank中已公布的BVDV参考序列进行多序列比较, 使用MEGA 6.06软件以Neighbor-Joining法(Bootstrap 值为1 000)构建系统进化树。
1.2.4细胞及病毒的分离培养细胞瓶中用含有10%胎牛血清的DMEM培养液37 ℃ 5% CO2培养MDBK细胞12 h,使细胞生长致单层细胞后,将处理后的样本感染细胞24 h,同时接种BVDV OregonC24V标准毒作为阳性对照组和不接种病毒的MDBK做阴性空白对照组,37 ℃ 5% CO2培养并观察细胞状态。待细胞病变后空泡面积达50%以上后收毒。细胞培养物于-80 ℃反复冻融3次后10 000 r·min-1离心10 min,上清移至离心管中放入-80 ℃保存备用。
1.2.5间接免疫荧光检测待细胞培养板上的细胞长成单层后,弃去维持液并用PBS(pH为7.4)洗涤3次,每次3 min。每孔加入80%冰丙酮 1 mL,在4 ℃条件下固定10 min左右,弃掉丙酮后用PBS洗涤3次。每孔加入1∶300稀释的一抗(BVDV多克隆抗体)1 mL,37 ℃孵育45 min。一抗孵育结束后用PBS洗涤3次,再加1∶1 000稀释的FITC标记的兔抗羊IgG二抗,每孔1 mL,37 ℃孵育45 min。二抗孵育结束后再用PBS洗涤5次以上,滴加含有DAPI的封片液,室温孵育10 min使用吸水纸吸取残留液体后直接在荧光显微镜下观察细胞核周边有无绿色荧光出现,判定标准如下:(-)无绿色荧光;(+)绿色荧光较弱,但清楚可见;(++)绿色荧光明亮;(+++~++++)绿色荧光闪亮。待检样本特异性绿色荧光强度达“++”以上,而各种对照显示为(±)或(-),即可判定为阳性。
1.2.6病毒毒价测定将“1.2.4”中细胞培养物用细胞营养液做连续10倍梯度稀释,从10-3稀释到10-13,依次吸取病毒液100 μL 接种到长满单层MDBK细胞的96孔细胞培养板上,每一个稀释度接种8个培养孔,37 ℃ 5%CO2培养箱培养,逐天观察并记录病变情况,同时设立未接毒的正常细胞作对照,根据Reed-Muench法计算病毒的TCID50,计算方法:距离比例=(高于50%的百分数-50%)/(高于50%的百分数-低于50%的百分数);TCID50的对数=高于50% 的最高稀释对数+距离比例×稀释系数的对数
2 结 果
2.1 2016年川藏地区牦牛BVDV分子流行病学调查
根据引物BVDV-P1、BVDV-P2进行RT-PCR检测,结果显示149份出现腹泻症状牦牛的粪便样品中,有29份扩增出了特异性条带,部分样品的PCR扩增结果如图1。川藏地区腹泻牦牛粪便中BVDV阳性检出率为19.46%(95%CI=13.4%~26.7%),西藏地区牦牛BVDV阳性检出率为27.14%(95%CI=17.2%~39.1%),四川地区牦牛BVDV阳性检出率为12.66%(95%CI=6.2%~22.0%)。
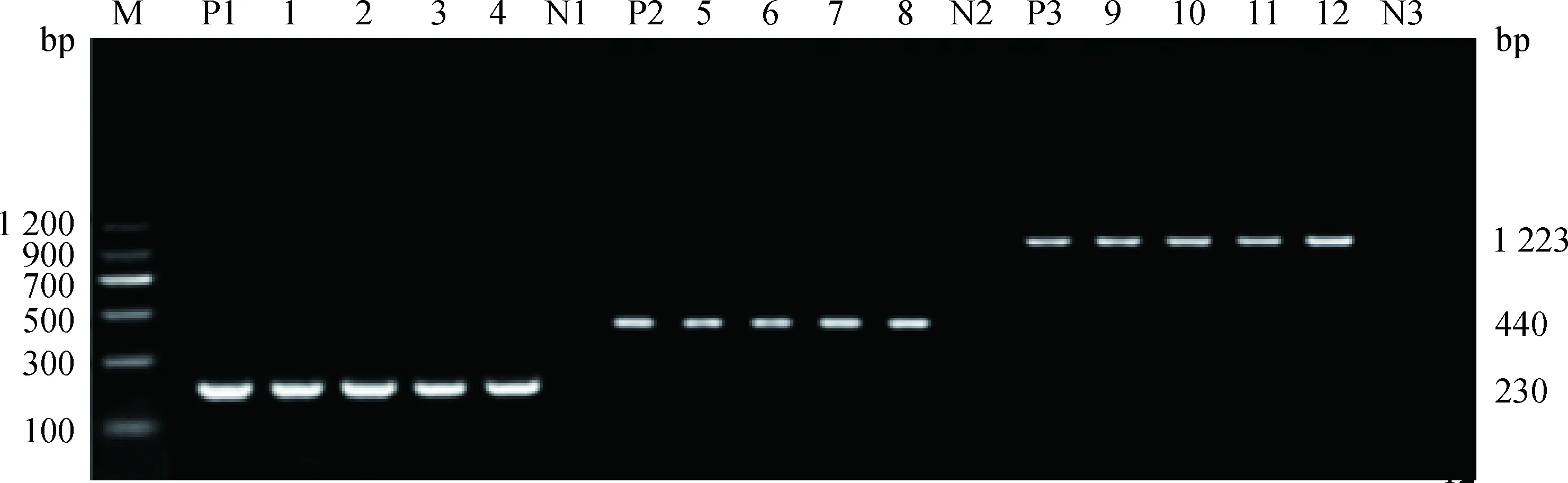
M.DNA markerⅡ;P1~P3.阳性对照;N1~N3.阴性对照;1~4. 5′-UTR RT-PCR产物(230 bp);5~8.Npro RT-PCR产物(440 bp);9~12. E2 RT-PCR产物(1 223 bp)M.DNA markerⅡ;P1-P3.Positive control;N1-N3.Negative control;1-4. The RT-PCR product (230 bp) of 5′-UTR; 5-8. The RT-PCR product (440 bp) of Npro; 9-12. The RT-PCR product (1 223 bp) of E2图1 BVDV RT-PCR部分扩增结果Fig.1 Partial amplified results of BVDV by RT-PCR
2.2 遗传进化分析
为了解2016年川藏地区牦牛BVDV主要的流行亚型及遗传进化情况,我们从西藏和四川两个地区随机选择“2.1”中RT-PCR呈阳性的样本10份(5份来自西藏地区腹泻牦牛,5份来自四川地区腹泻牦牛),根据5′-UTR、Npro和E2基因的特异性引物(BVDV-P1~BVDV-P8)进行RT-PCR扩增、测序。分别在230、440和1 223 bp处可见特异性扩增条带, 部分样品的PCR扩增结果如图1。将产物进行回收克隆测序后结果显示10个样本均为BVDV-1型。将测序所得序列与GenBank中公布的11株BVDV 进行同源性比较,结果显示,根据5′-UTR基因测序所得10株测序株之间的核苷酸相似性为86.6%~100%,与其他BVDV毒株5′-UTR基因的核苷酸相似性为69.1%~90.9%。Npro基因测序株之间的核苷酸和氨基酸序列相似性分别为72.8%~100%和74.7%~99.3%,与其他BVDV毒株Npro基因序列的核苷酸和氨基酸相似性分别介于74.9%~87.5%和82.3%~89.0%之间。E2基因测序结果显示10株测序株之间的核苷酸和氨基酸相似性分别为68.2%~99.9%和66.8%~99.5%,与其他BVDV毒株E2基因序列的核苷酸和氨基酸相似性分别介于68.2%~97.8%和67.4%~96.0%。系统发育树表明,西藏腹泻牦牛粪便样本(BB8、FB4、FB6、JB8和EB3)和四川腹泻牦牛粪便样本L8与BVDV-1d菌株10JJ-SKR更为密切相关,Z1、Z3、Z6和Z10分离株均与BVDV-1a菌株GS5在同一分支上(图2),研究结果表明10株BVDV阳性样本分别属于BVDV-1a(n=4)和BVDV-1d(n=6)。
2.3 病毒的分离及鉴定
将RT-PCR呈阳性的粪便样本处理后接种于事先培养好的MDBK细胞中,盲传7代后,BVDV-1a SWU-Z10和BVDV-1d SWU-L8两个样本在70 h左右出现与BVDV OregonC24V阳性对照相同的典型的细胞病变,病变初期细胞出现圆缩的现象,逐渐出现拉网状并开始脱落,正常MDBK细胞阴性对照没有发生病变(图3),初步确定分离到了两株CP型BVDV。按Reed-Muench法对两株分离株的效价进行计算,结果显示,该两株分离株SWU-Z10和SWU-L8第9代细胞毒的TCID50·100 μL-1分别为10-8. 11和10-5.81。通过间接免疫荧光试验检测,显微镜下观察可见,两株分离株SWU-Z10和SWU-L8以及阳性对照 OregonC24V毒株的细胞膜内均出现了明亮的特异性绿色荧光,而阴性对照则未出现绿色荧光,说明成功分离到SWU-Z10和SWU-L8两株BVDV CP型毒株。
3 讨 论
牦牛多生存于海拔3 000 m及以上的青藏高原地区,是典型的高原物种之一,具有“高原之舟”之称。牦牛广泛分布于中国青藏高原地区(西藏、青海、四川、云南等地区)及其相邻的高原地区。我国牦牛资源较为丰富、牦牛数量较多,据统计我国有1 300多万头牦牛,占世界牦牛总数的90%以上[18]。在青藏高原地区,牦牛作为最重要的高原生存物种之一,具有产肉、产奶、皮革和绒毛生产等多方面的经济价值[19]。

标记黑点的是测序株The sequencing strain is marked as a black spot图2 基于5′-UTR(a)、Npro(b)和E2序列(c)的10株测序株的系统发育分析Fig.2 Phylogenetic analysis of 10 sequencing strains based on 5′-UTR (a), Npro (b) and E2 sequence (c)
BVDV是导致牦牛腹泻的重要病原,牦牛感染BVDV后可导致牛奶产量下降,牛奶品质差,繁殖力降低,生长迟缓和继发感染其他疾病。据调查该病在我国大部分地区广泛存在,牛群中有相当一部分是BVDV的携带者[20]。根据近年来的BVDV流行病学调查显示,四川、西藏等地区均有不同程度的BVDV感染。笔者实验室通过PCR检测从2013年青藏高原地区的20份腹泻牦牛粪便样品中病毒流行情况,BVDV阳性率为15%,检测2015年青藏地区腹泻牦牛222份粪便样品,BVDV阳性率为20%[14]。本研究中川藏地区牦牛粪便BVDV的阳性检出率为19.46%,与之前的报道[10,14,17,21]大致相同,四川地区阳性率有所降低。分析可能是因为样本采集地区差异以及我们研究所用的样本为腹泻牦牛的粪便,而之前文献报道的样本多为牦牛血清。

A. 接毒细胞细胞膜出现绿色荧光;B. DAPI染细胞核;C. A和B的结合图;D.阴性对照(MDBK细胞)。OregonC24V、SWU-Z10和SWU-L8在MDBK细胞中引起典型的致细胞病变作用A.Green fluorescence occur in membrane of infected MDBK cells;B. Nucleus dyed by DAPI;C. Merged Fig. of A and B;D. Negative control (MDBK cells). OregonC24V, SWU-Z10 and SWU-L8 cause typical cytopathic effects in MDBK cells图3 通过IFA检测相关毒株感染MDBK细胞中的BVDV抗原Fig.3 Detection of BVDV antigen in MDBK cell infected with BVDV strains by IFA
在BVDV基因组中,E2糖蛋白编码区通常被认为是最不保守的区域之一,因此,该蛋白也被认为是BVDV分型的依据之一,其抗原的变异导致BVDV可很好的适应环境的变化,这种特性也导致了BVDV疫苗的免疫失效,且也是畜群感染BVDV后出现持续性感染的重要原因[22-23]。同时,作为BVDV的一个重要特征,亚型往往是群体特有的,不同的地区可能流行不同的亚型[24]。因此,在防控时必须认识到BVDV分离株的变异性。据国内外研究报道,BVDV-1a、1b和2a在美国为主要的流行亚型[25],欧洲许多国家主要流行BVDV-1a、1b、1d、1e和1f[11, 26]。日本和韩国主要流行BVDV-1b[27-28],澳大利亚则主要流行BVDV-1c[29]。中国的主要亚型是BVDV-1b和1m[30]。BVDV-1b、1q和1m是中国青藏高原西藏和青海地区牦牛的主要BVDV亚型[17]。本研究中,我们根据E2基因设计特异性引物对检测呈阳性的样本进行E2基因扩增、测序并构建系统发育进化树,并结合5′-UTR和Npro所构建的系统发育树,结果显示5株西藏腹泻牦牛样本与10JJ-SKR毒株相似性较高,均为BVDV-1d亚型,但是5株样本单独聚为一个分支,5株四川腹泻牦牛样本中1株属BVDV-1d亚型,4株与GS5毒株相似性较高,属BVDV-1a亚型,而GS5毒株与标准毒株OregonC24V同源。结果也进一步说明不同的地区所流行的主要亚型是不同的,因此应该因地制宜地制定防控方案。
本研究从四川腹泻牦牛粪便样本中分离两株病毒,经病毒分离培养、RT-PCR与间接免疫荧光方法鉴定,确定两株病毒均为CP型BVDV,并命名为SWU-Z10和SWU-L8,根据Reed-Muench法测定两株病毒TCID50·100 μL-1分别为10-8.11和10-5.81,可见,两株病毒的毒力相差很大,经分析原因可能有以下几点:(1)样本采集地区差异。川藏地区由于地理、文化和经济等多种因素导致牦牛的养殖多属于小型养殖或散养,而BVDV的传播具有地域差异[30],因此可能导致两株分离株存在明显的毒力差异。(2)通过同源性比对及系统进化树显示SWU-Z10属于BVDV-1a亚型,与BVDV-1a标准毒株OregonC24V和NADL的同源关系较近,位于同一分支上,而BVDV OregonC24V和NADL毒株均为毒力较强的CP型BVDV标准毒株。(3)SWU-Z10样本采集于四川地区腹泻十分严重的牦牛,该牦牛临床症状明显,有排血便的现象。因此,我们也将在下一步的研究中着重研究两株病毒的致病性及致病力等相关问题。
4 结 论
对四川和西藏部分高原地区采集的149份临床腹泻牦牛粪便开展牛病毒性腹泻病毒(BVDV)分子流行病学调查,BVDV阳性检出率为19.46%。随机取10份阳性样本,5′-UTR、Npro和E2基因分析结果表明10份样本为BVDV-1型,包括BVDV-1a(n=4)和1d(n=6)亚型。成功分离鉴定出2株致细胞病变型BVDV,分别属于牦牛BVDV-1a和1d亚型,命名为SWU-Z10和SWU-L8。川藏部分高原地区牦牛存在BVDV感染,BVDV-1a和1d为牦牛感染的主要亚型。
参考文献(References):
[1]LANYON S R, HILL F I, REICHEL M P, et al. Bovine viral diarrhoea: pathogenesis and diagnosis[J].VetJ, 2014, 199(2): 201-209.
[2]韩玉霞, 孟露萍, 孙志华, 等. 不同生物型BVDV感染对MDBK细胞类泛素基因转录水平的影响[J]. 动物医学进展, 2015, 36(12): 11-17.
HAN Y X, MENG L P, SUN Z H, et al. Effects of different biological-types of Bovine Viral Diarrhea Virus infection on SUMO gene transcription levels in MDBK cells[J].ProgressinVeterinaryMedicine, 2015, 36(12): 11-17. (in Chinese)
[3]BACHOFEN C, VOGT H R, STALDER H, et al. Persistent infections after natural transmission of bovine viral diarrhoea virus from cattle to goats and among goats[J].VetRes, 2013, 44: 32.
[4]TAO J, LIAO J H, WANG Y, et al. Bovine viral diarrhea virus (BVDV) infections in pigs[J].VetMicrobiol, 2013, 165(3-4): 185-189.
[5]HELAL M A, OKAMATSU H, TAJIMA M. Bovine viral diarrhea virus infection in a dairy herd with high prevalence of persistently infected calves[J].JpnJVetRes, 2012, 60(2-3): 111-117.
[6]PINIOR B, FIRTH C L, RICHTER V, et al. A systematic review of financial and economic assessments of bovine viral diarrhea virus (BVDV) prevention and mitigation activities worldwide[J].PrevVetMed, 2017, 137: 77-92.
[8]COUVREUR B, LETELLIER C, COLLARD A, et al. Genetic and antigenic variability in bovine viral diarrhea virus (BVDV) isolates from Belgium[J].VirusRes, 2002, 85: 17-28.
[10]DENG M L, JI S K, FEI W T, et al. Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China[J].PLoSOne, 2015, 10(4): e0134777.
[11]GIAMMARIOLI M, CEGLIE L, ROSSI E, et al. Increased genetic diversity of BVDV-1: recent findings and implications thereof[J].VirusGenes, 2015, 50(1): 147-151.
[12]ZEMKE J. Characterization of recombinant BVDV-2 vaccine prototypes based on packaged replicons and replication competent deletion mutants[D]. LMU München: Tierärztliche Fakultät, 2010.
[13]张倩, 陶洁, 张东, 等. 国内新型基因2型牛病毒性腹泻病毒研究进展[J]. 中国动物传染病学报, 2017, 25(1): 80-86.
ZHANG Q, TAO J, ZHANG D, et al. Research progress of genotype 2 bovine viral diarrhea virusin China[J].ChineseJournalofVeterinaryParasitology, 2017, 25(1): 80-86. (in Chinese)
[14]陈新诺, 张朝辉, 徐林, 等. 青藏高原牦牛感染BVDV和BEV的分子流行病学调查[J]. 动物医学进展, 2016, 37(9): 35-38.
CHEN X N, ZHANG C H, XU L, et al. Investigation on molecular epidemiology of BVDV and BEV infections in yaks of Qinghai-Tibetan Plateau[J].ProgressinVeterinaryMedicine, 2016, 37(9): 35-38. (in Chinese)
[15]何美琳, 张焕容, 王永, 等. 川西北牦牛3种病毒性腹泻病血清学调查[J]. 中国畜牧兽医, 2014, 41(3): 248-251.
HE M L, ZHANG H R, WANG Y, et al. Serological survey on three viral diarrhea diseases of yaks in Northwest Sichuan Province[J].ChineseJournalofAnimalHusbandryandVeterinaryMedicine, 2014, 41(3): 248-251. (in Chinese)
[16]KUTA A, POLAK M P, LARSKA M, et al. Predominance of bovine viral diarrhea virus 1b and 1d subtypes during eight years of survey in Poland[J].VetMicrobiol, 2013, 166(3-4): 639-644.
[17]GONG X W, LIU L H, ZHENG F Y, et al. Molecular investigation of bovine viral diarrhea virus infection in yaks (Bosgruniens) from Qinghai, China[J].VirolJ, 2014, 11: 29.
[18]拜彬强, 郝力壮, 柴沙驼, 等. 牦牛肉品质特性研究进展[J]. 食品科学, 2014, 35(17): 290-296.
BAI B Q, HAO L Z, CHAI S T, et al. Progress in understanding meat quality characteristics of yak[J].FoodScience, 2014, 35(17): 290-296. (in Chinese)
[19]李齐发, 赵兴波, 刘红林, 等. 牦牛分类地位研究概述[J]. 动物分类学报, 2006, 31(3): 520-524.
LI Q F, ZHAO X B, LIU H L, et al. A review of the research on taxonomic status in yak (Poephagus)[J].ActaZootaxonomicaSinica, 2006, 31(3): 520-524. (in Chinese)
[20]范晴, 谢芝勋, 谢志勤, 等. 牛病毒性腹泻病毒抗原捕获ELISA方法的建立[J]. 动物医学进展, 2015, 36(2): 4-2.
FAN Q, XIE Z X, XIE Z Q, et al. Development of antigen capture ELISA of detection bovine viral diarrhea virus[J].ProgressinVeterinaryMedicine, 2015, 36(2): 4-2. (in Chinese)
[21]GAO J F, LIU M Y, MENG X R, et al. Seroprevalence of bovine viral diarrhea infection in Yaks (Bosgrunniens) on the Qinghai-Tibetan Plateau of China[J].TropAnimHealthProd, 2013, 45(3): 791-793.
[22]KALAYCIOGLU A T. Bovine viral diarrhoea virus (BVDV) diversity and vaccination. A review[J].VetQ, 2007, 29(2): 60-67.
[23]PECORA A, MALACARI D A, PEREZ AGUIRREBURUALDE M S, et al. Development of an APC-targeted multivalent E2-based vaccine against bovine viral diarrhea virus types 1 and 2[J].Vaccine, 2015, 33(39): 5163-5171.
[24]OSTACHUK A. Bovine viral diarrhea virus structural protein E2 as a complement regulatory protein[J].ArchVirol, 2016, 161(7): 1769-1782.
[25]RIDPATH J F, LOVELL G, NEILL J D, et al. Change in predominance ofBovineviraldiarrheavirussubgenotypes among samples submitted to a diagnostic laboratory over a 20-year time span[J].JVetDiagnInvest, 2011, 23(2): 185-193.
[27]ABE Y, TAMURA T, TORII S, et al. Genetic and antigenic characterization of bovine viral diarrhea viruses isolated from cattle in Hokkaido, Japan[J].JVetMedSci, 2016, 78(1): 61-70.
[28]OEM J K, CHUNG J Y, ROH S, et al. Characterization and phylogenetic analysis ofBovineviraldiarrheavirusin brain tissues from nonambulatory (downer) cattle in Korea[J].JVetDiagnInvest, 2010, 22(4): 518-523.
[29]LANYON S R, REICHEL M P. Bovine viral diarrhoea virus (‘pestivirus’) in Australia: to control or not to control[J].AustVetJ, 2014, 92(8): 277-282.
[30]王炜. 牛主要呼吸道病毒病血清学调查、牛病毒性腹泻病毒分离株鉴定及疫苗研究[D]. 北京: 中国农业科学院, 2014.
WANG W. Serosurvey of major bovine respiratory viruses and identification of BVDV isolates and vaccine development[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)

