副猪嗜血杆菌TbpA对仔猪的免疫效力评价
姚焱彬,陈 章,储霞飞,魏建忠,孙 裴,李 郁
(安徽农业大学动物科技学院,合肥 230036)
副猪嗜血杆菌(Haemophilusparasuis,HPS)是猪上呼吸道的一种常在菌,为格拉瑟氏病(Glässer′s disease)的病原菌。随着养猪集约化程度的提高以及饲养条件和饲养管理的改变,由HPS引起的以猪纤维素性多发性浆膜炎、关节炎、脑膜炎、呼吸困难、高热及高死亡率为特征的传染性疾病呈现逐年上升的趋势,给养猪业带来巨大的经济损失,并已成为世界范围的一种严重的细菌性传染病[1-2]。目前针对Glässer′s病的防控措施主要是应用抗菌药物和灭活疫苗。然而,随着抗菌药物的大量使用,甚至乱用或滥用,导致HPS的耐药谱逐渐拓宽,多重耐药现象日益严重[3];同时由于HPS血清型众多,各型菌株间的毒力或致病性差异都很大,且相互之间缺乏有效的交叉保护力,致使HPS灭活疫苗的保护效果十分有限[4-5]。
铁是细菌生长代谢中不可缺少的元素,但宿主体内是一种低铁浓度的环境,铁离子往往是与宿主糖蛋白、转铁蛋白、乳铁蛋白等络合在一起,致使细菌必须以某种机制来摄取铁。目前已知的铁调节蛋白包括6种:铁调节外膜蛋白、铁结合蛋白、转铁结合蛋白(transferrin-binding protein,Tbp,包括TbpA和TbpB)、乳铁结合蛋白及血红素结合蛋白[6]。HPS 可利用转铁蛋白提供细菌生长必需的铁离子[7]。N. Charland等已证明猪血清中Tbp受体的存在,并分析两种Tbp的多肽结构分别是:TbpA 94~96 ku,TbpB 60 ku,也只能特异性结合猪的转铁蛋白[8]。2010年,S. Martínez等克隆表达了HPS血清5型tbpA基因中一段600 bp核苷酸序列,并证实该片段具有免疫原性[9]。2011年,本研究室辛伟等对血清型13型HPS 的tbpA基因分3段进行克隆表达,研究结果显示三段重组蛋白(rTbpA1、rTbpA2、rTbpA3大小分别为62、54、44 ku)均具有良好的反应原性,其中rTbpA1更具有良好的免疫原性[10]。2012年,本研究室黄晓慧等进一步对血清型13型HPS的tbpA全基因进行原核表达,大小为110 ku的重组TbpA具有良好的免疫活性[11]。
在前期研究中,我们利用HPS血清型13型重组TbpA蛋白(110 ku)免疫豚鼠,结果显示对豚鼠具有良好的免疫保护。当免疫蛋白量达到100 μg时,对血清型13型HPS的保护率高达80%,血清型4型攻毒后保护率为60%[12]。本试验系在此研究基础上,采用HPS血清型13型不同蛋白质浓度的重组TbpA免疫仔猪,通过测定血清抗体(IgG)及细胞因子(IL-5、IL-10、IFN-γ、TNF-α)水平,同时对免疫后仔猪进行同型菌株的攻毒,记录攻毒后仔猪存活和死亡情况,观察和比较病理学变化,结果表明血清型13型HPS的TbpA蛋白可为仔猪提供较好的免疫保护并能抵抗同一血清型菌株的攻击,为下一步探究重组TbpA对本动物仔猪的免疫交互试验奠定基础。
1 材料与方法
1.1 菌株和质粒
HPS血清型13 型安徽分离菌株(HPS-LJ3)、重组质粒pET-SUMO-tbpA、E.coilDH5α/Rosetta(DE3)菌株均由安徽农业大学动物科技学院传染病实验室保存。
1.2 试验仔猪及试验场地
14日龄及42日龄仔猪购自安徽浩翔农牧科技有限公司,试验场地由安徽东方帝维生物制品股份有限公司提供。
1.3 主要试剂
烟酰胺腺嘌呤二核苷酸(NAD)、氨苄青霉素(Amp)、异丙基-β-D-硫代半乳糖苷(IPTG)、3,3″,5,5″-四甲基联苯胺(TMB)显色液、二氨基联苯胺(DAB)、30%丙烯酰胺溶液、考马斯亮蓝 R250、β-巯基乙醇购自上海生工生物工程技术服务有限公司;新生小牛血清购自杭州四季青有限公司;含0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)、含0.6%酵母浸膏胰酪胨大豆琼脂(TSA-YE)、LB肉汤购自绍兴天恒生物科技有限公司;Ni-NTA His Bind Purification Kit 购自 Novagen 公司;十二烷基硫酸钠(SDS)、过硫酸铵、三羟甲基氨基甲烷(Tris 碱)、弗氏完全佐剂、HRP标记山羊抗猪IgG(IgG-HRP) 购自SIGMA公司;细胞因子(IL-5、IL-10、IFN-γ和TNF-α)ELISA试剂盒购自美国 RB 公司。
1.4 重组TbpA的表达及纯化
参照黄晓慧等[11]的方法,对重组TbpA进行表达和纯化,具体方法如下:将重组质粒pET-SUMO-tbpA转化至Rosetta(DE3)感受态细胞,挑取单克隆接种于含50 μg·mL-1Amp LB液体培养基中,37 ℃振荡培养(150 r·min-1)过夜。按1∶100将过夜培养的菌液转接至100 mL上述LB液体培养基中,37 ℃振荡培养至对数生长期(OD600 nm为0.6~0.8)。加入终浓度0.3 mmol·L-1的IPTG,20 ℃ 120 r·min-1过夜诱导表达。将诱导后菌液13 000 g离心5 min,弃上清,收集沉淀,5 mL 裂解液重悬沉淀后超声破碎。10 000 g离心10 min收集沉淀即为包涵体。将包涵体复性后利用 Ni-his-resin纯化蛋白质,最后用500 mmol·L-1咪唑洗脱目的蛋白质,通过全波长多功能酶标仪测定纯化后的蛋白质浓度,并进行SDS-PAGE分析蛋白质表达及纯化效果。
1.5 重组TbpA的Western blotting鉴定
纯化后的重组TbpA用半干转移电泳转至硝酸纤维素膜上(15 V, 40 min),含5%脱脂奶粉的封闭液中4 ℃过夜。以兔抗HPS-LJ3株阳性血清(1∶400稀释)为一抗,室温摇床孵育1 h,洗膜后用带HRP标记的山羊抗兔IgG (1∶5 000稀释) 为二抗,室温摇床孵育1 h,最后用DAB 显色液试剂盒显色。
1.6 筛选HPS抗体阴性健康仔猪
自前腔静脉采集50头42日龄左右的仔猪血液,采用黄晓慧(X.H.Huang)等建立的间接ELISA检测方法[12]筛选出15头HPS抗体阴性健康仔猪。
1.7 HPS-LJ3株LD50的测定
采用Reed-Muench法,将15头HPS抗体阴性健康仔猪,随机分为5组,每组3头。第一组攻毒剂量为1011CFU·mL-1,依次进行10倍稀释到第5组。腹腔攻毒后,观察仔猪临床症状并记录死亡数量,同时对死亡仔猪进行细菌分离回收。将试验死亡动物数和存活动物数进行累积相加和,再用加和的数据计算死亡率。距离比例r=(A-50)÷(A-B)(A为刚好死亡率大于50%;B为刚好死亡率小于50%);lg LD50=高于50%死亡率稀释度倒数的对数+距离比例×稀释倍数的对数。
1.8 HPS-LJ3株灭活全菌体的制备及重组TbpA的乳化
1.8.1HPS-LJ3株灭活全菌体的制备挑取HPS单菌落接种于5 mL TSB肉汤培养基中,37 ℃ 200 r·min-1振荡培养12 h,将培养物1∶100转接至新的TSB肉汤培养基中,37 ℃培养18 h(菌落总数达1.5×109CFU·mL-1),0.3%甲醛37 ℃灭活24 h。无菌检验合格后,与弗氏佐剂按照1∶1进行配比乳化。
1.8.2重组TbpA的乳化将重组TbpA与弗氏佐剂按照1∶1进行配比乳化,置于4 ℃备用。
1.9 重组TbpA和HPS-LJ3株灭活全菌体的免疫保护试验
1.9.1免疫试验25头HPS抗体阴性健康仔猪,随机分为5组(编号分别为A、B、C、D、E),每组5头(表1)。其中A、B组接种纯化的重组TbpA,蛋白质浓度分别为0.5和0.25 mg·4 mL-1,免疫剂量均为4 mL·头-1;C组接种HPS-LJ3株灭活全菌体,免疫剂量为4 mL·头-1;D组为攻毒对照组,E组为阴性对照组,均接种灭菌PBS,4 mL·头-1。接种途径均为颈部肌肉注射,共三次,每次间隔时间为14 d。第一次免疫接种使用弗氏完全佐剂,第二、三次均使用弗氏不完全佐剂。
表1试验仔猪分组及免疫接种情况
Table1Groupingandvaccinationoftestedpiglets

组别Groups免疫接种类型Typeofimmunization剂量/(mL·头-1)DoseA0.5mg·4mL-1的重组TbpA4B0.25mg·4mL-1的重组TbpA4CHPS-LJ3株灭活全菌体4D灭菌PBS(攻毒对照组)4E灭菌PBS(阴性对照组)4
1.9.2血清中IgG及细胞因子检测自一免和二免14 d、三免10 d后,从前腔静脉采集仔猪血液,静置后离心分离血清,保存于-20 ℃。参考黄晓慧(X.H.Huang)等[12]建立的方法,检测仔猪免疫后抗体水平,并按照细胞因子ELISA检测试剂盒说明书进行细胞因子(IL-5、IL-10、IFN-α、TNF-γ)含量的测定。
1.9.3攻毒保护试验三免10 d后,用7 LD50剂量的HPS-LJ3株对A、B、C、D组仔猪进行腹腔攻毒,E组注射等体积无菌PBS。攻毒后,连续14 d观察仔猪的精神状态、饮食欲及死亡情况,并按无菌操作从死亡仔猪的脾、肺、肝、肾中采样,分别接种于TSA琼脂培养基(含有0.01%NAD和5%小牛血清),37 ℃培养18~24 h,取可疑菌落进行涂片、染色镜检,并经PCR鉴定。最终计算免疫保护率(免疫保护率=存活仔猪数/攻毒仔猪数×100%)。
1.9.4病理学检查眼观各组仔猪内脏器官(心、脾、肺、肝、肾)的病理变化,同时采集肺和脾,制作石蜡切片,HE染色,镜检观察组织病理学变化。
2 结 果
2.1 重组TbpA的诱导表达及纯化
pET-SUMO-tbpA转化至Rosetta(DE3)感受态细胞,经IPTG诱导产生大小约为110 ku的目的蛋白,经Ni-his-resin纯化的重组TbpA质量浓度为 1 mg·mL-1(图1)。

M. 蛋白质相对分子质量标准;1. 纯化前的TbpA;2~5. 纯化后的TbpAM. Protein molecular weight marker; 1. Unpurified TbpA; 2-5. Purified TbpA 图1 纯化蛋白质SDS-PAGE分析Fig.1 SDS-PAGE analysis of purified protein
2.2 重组TbpA的Western blotting鉴定
纯化的重组TbpA经Western blotting 鉴定,在110 ku处出现明显的条带,而阴性对照无明显条带,表明表达的产物能够与阳性血清发生抗原抗体特异性结合,具有良好的反应原性(图2)。
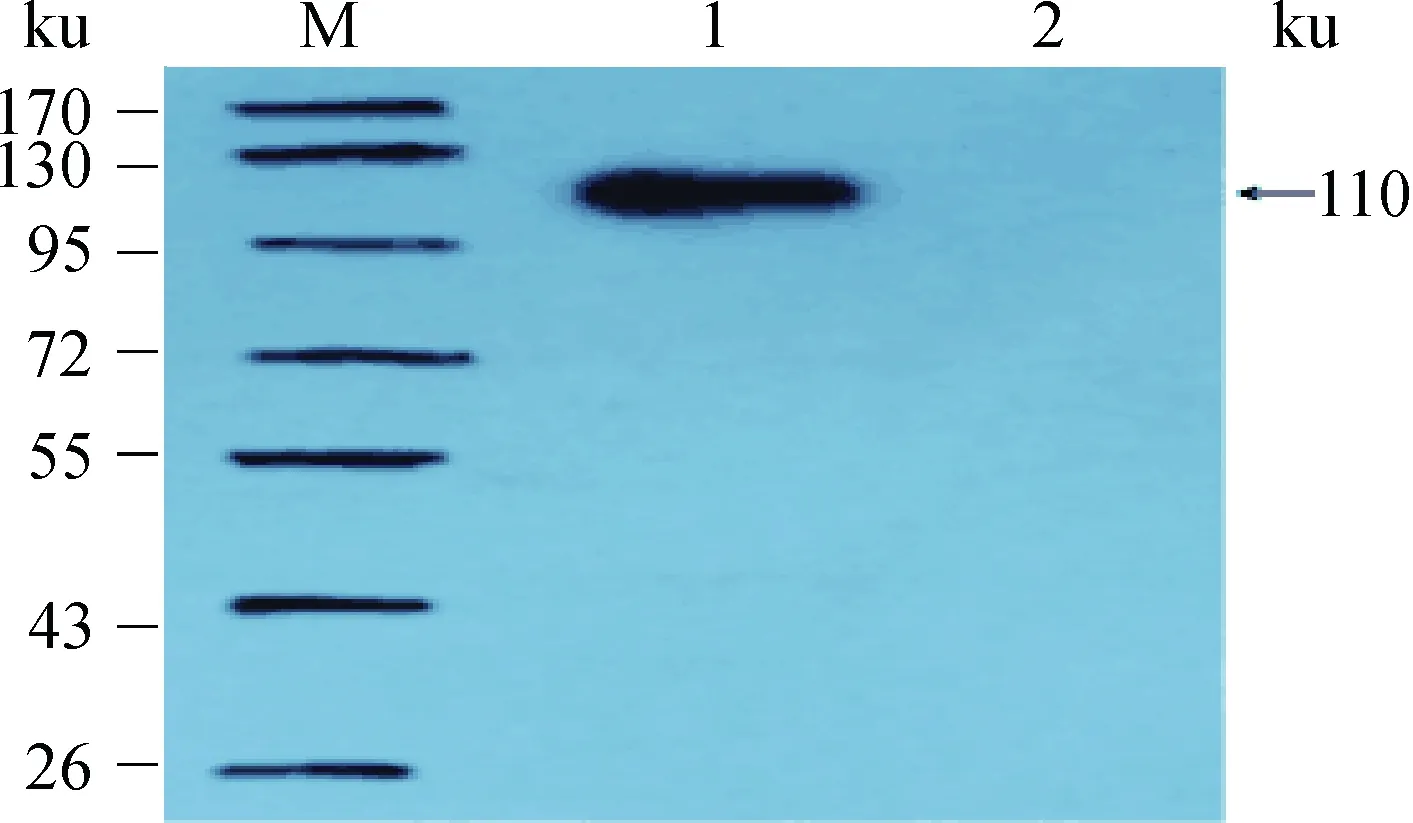
M.蛋白质相对分子质量标准;1.纯化的TbpA;2. 阴性对照M. Protein molecular weight marker; 1. Purified TbpA; 2. Negative control图2 纯化重组蛋白质的Western blotting分析Fig.2 Western blotting analysis of purified recombinant protein
2.3 HPS-LJ3株LD50的测定
以剂量1011CFU·mL-1腹腔注射后,仔猪全部死亡;以剂量1010CFU·mL-1腹腔注射后,仔猪死亡2只;以剂量109CFU·mL-1腹腔注射后,仔猪死亡1只;以剂量108CFU·mL-1腹腔注射后,仔猪死亡1只;以剂量107CFU·mL-1腹腔注射后,仔猪全部存活。经计算,HPS-LJ3株对仔猪的LD50为1.778·109CFU·mL-1。
2.4 重组TbpA和HPS-LJ3株灭活全菌体的免疫保护试验
2.4.1IgG 检测用不同剂量的重组TbpA和HPS-LJ3株灭活全菌体对仔猪进行了三次免疫。 A、B组在一免后HPS抗体水平与E组之间均差异不显著(P>0.05),而二免和三免后HPS抗体水平均显著高于E组(P<0.05)。A、B组三免后HPS抗体水平均显著高于二免抗体水平(P<0.05),且两组之间差异不显著。C组一免、二免和三免后抗体水平显著高于E组(P<0.05)。一免和二免后C组抗体水平显著高于A、B组 (P<0.05),三免后C组抗体水平与A组和B组之间差异大为缩小(图3)。
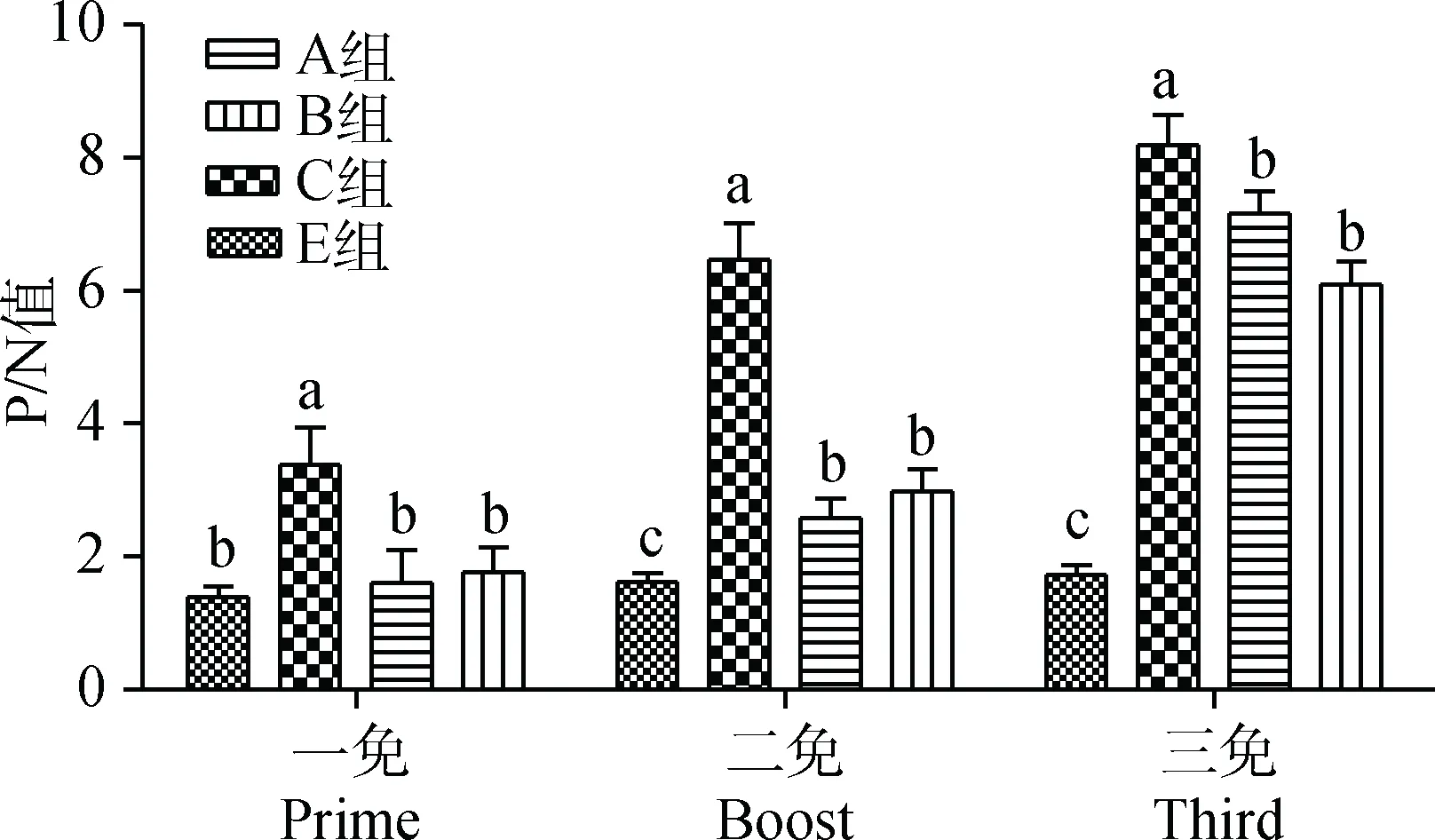
A.0.5 mg·4 mL-1重组TbpA免疫;B.0.25 mg·4 mL-1重组TbpA免疫;C.HPS-LJ3株灭活全菌体免疫;E.灭菌PBS免疫对照。标注不同字母者表示差异显著(P<0.05)A. 0.5 mg·4 mL-1 TbpA immunized group; B. 0.25 mg·4 mL-1 TbpA immunized group; C. Inactivated HPS-LJ3 immunized group; E. PBS control. Bars with different letter are different significantly (P<0.05)图3 仔猪免疫后血清中IgG抗体检测Fig.3 Levels of IgG production to piglets after immunization
2.4.2细胞因子检测在一免和二免后,A、B、C组的细胞因子IL-5、IL-10、IFN-γ、 TNF-α 水平与E组之间大部分时间点差异显著(P<0.05),而三免后,A、B、C组的细胞因子水平均显著高于E组(P<0.05)(图4)。
2.4.3攻毒保护试验结果显示,A、C组精神状况良好,保护率均为100%;B组从3头死亡仔猪的肺、脾分离到大量HPS,2头存活仔猪则分离到少量HPS,保护率为40%; D组仔猪精神沉郁,死亡率100%,并从死亡仔猪的肺、脾分离到大量HPS;E组仔猪全部存活(图5)。
2.4.4 病理学检查
2.4.4.1大体病变:A、B、C、E组存活仔猪剖检后均未见明显病理变化。B组死亡仔猪后肢关节切开有积液,腕关节和跗关节肿大,触摸有波动感,肺间质水肿,肺两侧肺叶的尖叶、心叶、膈叶及副叶坏死,纤维素性渗出,胸腔黏连,胸外膜出血。脾出血、稍肿大,表面可见出血性梗死灶和大量纤维素性渗出物。腹腔黏连,有纤维素性渗出,腹水增多。肠系膜淋巴结及腹股沟淋巴结出血。D组死亡仔猪表现肺出血、坏死,纤维素性肺炎,脾边缘坏死。
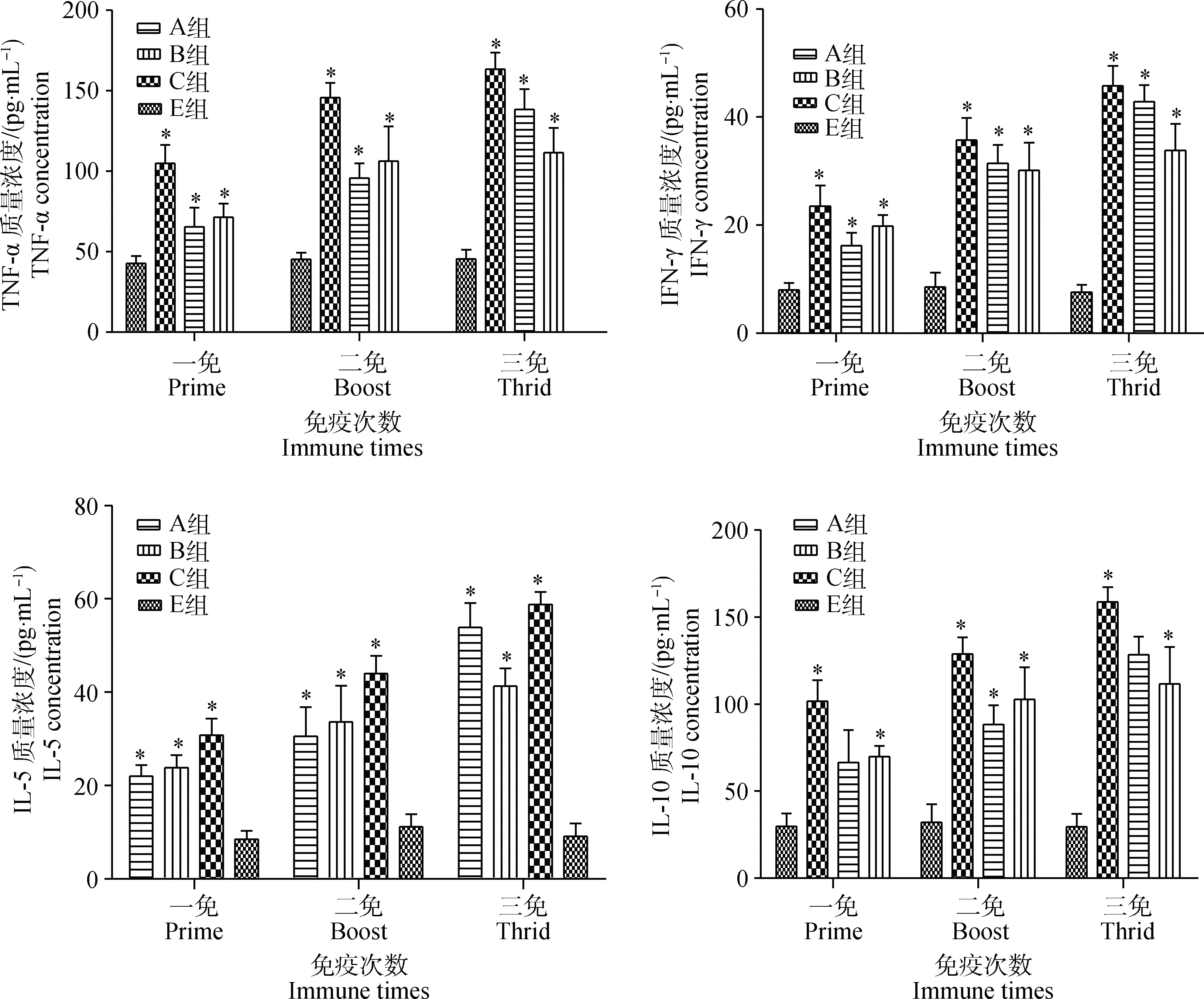
A.0.5 mg·4 mL-1重组TbpA免疫;B.0.25 mg·4 mL-1重组TbpA免疫;C.HPS-LJ3株灭活全菌体免疫;E.灭菌PBS免疫对照。*.P<0.05A. 0.5 mg·4 mL-1 TbpA immunized group; B. 0.25 mg·4 mL-1 TbpA immunized group; C. Inactivated HPS-LJ3 immunized group; E. PBS control.*.P<0.05图4 仔猪免疫后细胞因子水平变化Fig.4 Levels of cytokine production after immunization
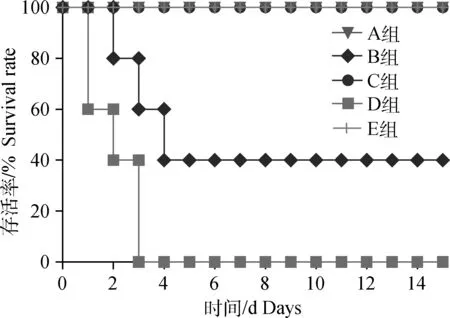
A.0.5 mg·4 mL-1 TbpA免疫+攻毒;B.0.25 mg·4 mL-1TbpA免疫+攻毒;C.HPS-LJ3株灭活全菌体免疫+攻毒;D.攻毒对照组;E.PBS免疫不攻毒对照A. 0.5 mg·4 mL-1 TbpA immunization & challenge; B. 0.25 mg·4 mL-1 TbpA immunization & challenge; C. Inactivated HPS-LJ3 immunization & challenge; D. HPS-LJ3 challenge group;E. PBS control图5 免疫攻毒后仔猪存活情况Fig.5 Survival of immunized piglets following HPS challenge
2.4.4.2组织学检查:取各组的HE染色石蜡切片,镜检。
肺:A组肺间质有极少量炎性细胞、肺泡间隔增宽、肺小叶少量出血,有浆细胞和成纤维细胞。B组存活仔猪肺间质有少量炎性细胞浸润、肺小叶出血严重,肺泡内有少量纤维素性渗出物;B组死亡仔猪肺泡间隔增宽,支气管肺炎,肺间质大量炎性细胞浸润,肺泡内有渗出液和纤维素性渗出物,肺气肿、边缘塌陷,肺小叶严重出血,肺固有结构消失,有大量的红细胞。C组肺间质只有极少量炎性细胞,肺小叶轻微出血,有浆细胞、成纤维细胞生成。D组肺泡间隔增宽,支气管肺炎、肺小叶出血,肺泡内有纤维素性渗出物。E组没有明显病理变化(图6)。
脾:A组无明显病理变化。B组存活仔猪,脾小体有少量炎性细胞浸润,红髓区出血严重;B组死亡仔猪,脾小体淡染,大量炎性细胞浸润,红髓区和边缘区严重出血,有大量红细胞弥漫性分布。C组无明显病理变化。D组脾小体淡染, 红髓区出血,有大量炎性细胞。E组无明显病理变化(图7)。
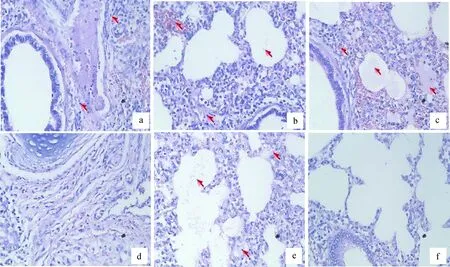
a.0.5 mg·4 mL-1TbpA免疫+攻毒;b.0.25 mg·4 mL-1TbpA免疫+攻毒(存活);c.0.25 mg·4 mL-1 TbpA免疫+攻毒(死亡); d.HPS-LJ3株灭活全菌体免疫+攻毒;e.攻毒对照组;f.PBS免疫不攻毒对照a. 0.5 mg·4 mL-1 TbpA immunization & challenge; b. 0.25 mg·4 mL-1 TbpA immunization & challenge (alive); c. 0.25 mg·4 mL-1 TbpA immunization & challenge (dead); d.Inactivated HPS-LJ3 immunization & challenge; e. HPS-LJ3 challenge group;f. PBS control图6 各组仔猪肺病理组织学检查(HE 染色,40×)Fig.6 The histology of lung from piglets in various groups(HE staining,40 ×)
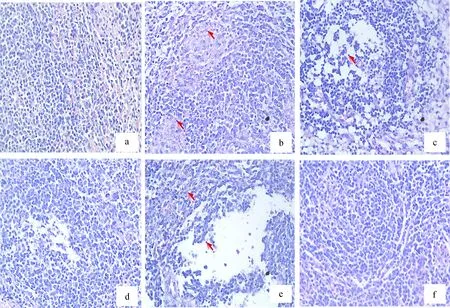
a.0.5 mg·4 mL-1TbpA免疫+攻毒;b.0.25 mg·4 mL-1TbpA免疫+攻毒(存活仔猪);c.0.25 mg·4 mL-1 TbpA免疫+攻毒(死亡仔猪); d.HPS-LJ3株灭活全菌体免疫+攻毒;e.攻毒对照组;f.PBS免疫不攻毒对照a. 0.5 mg·4 mL-1 TbpA immunization & challenge; b. 0.25 mg·4 mL-1 TbpA immunization & challenge; c. 0.25 mg·4 mL-1 TbpA immunization & challenge (dead); d.Inactivated HPS-LJ3 immunization & challenge; e. HPS-LJ3 challenge group;f. PBS control图7 各组仔猪脾病理组织学检查(HE染色,40 ×) Fig.7 The histology of lung from piglets in various groups (HE staining,40 ×)
3 讨 论
近几年,国内关于Glässer′s病的报道越来越多,该病给养殖业造成了巨大的经济损失。目前,主要采用药物治疗和接种疫苗防控此病,但由于养殖场滥用抗生素等因素,使得 HPS 的耐药谱逐年增加,产生大量的多重耐药菌株[3]。易新建等和赵战勤(Z.Q.Zhao)等虽研制了HPS三价(血清型4型、5型、12型)灭活疫苗,较传统的灭活疫苗相比,具有更高的免疫效力[13-14],但由于HPS不同血清型菌株之间的致病力存在较大的差异,同时HPS各血清型菌株之间缺乏有效的交叉保护力[15],此外,HPS具有明显的地方性特征,相同血清型的不同地方分离株致病力也不尽相同[16-17]等原因,造成了灭活疫苗免疫效果的不确实。因此,筛选免疫保护性抗原,研制高效广谱的HPS新疫苗是防控Glässer′s病的新途径。目前已有的研究表明,HPS的外膜蛋白(OMPs)、TbpA、TbpB 等均可作为研制HPS亚单位疫苗的候选抗原,但迄今为止尚未见到这些蛋白质免疫仔猪后能抵抗不同血清型HPS的报道[18-19]。本研究是在黄晓慧(X.H.Huang)等[12]研究基础上,进一步探讨了HPS血清型13型的TbpA对仔猪的免疫保护作用,TbpA不仅能诱导仔猪产生较好的免疫抗体水平,而且对同型HPS的攻击具有较强的抵抗力,从而为后续进行TbpA免疫仔猪是否能够抵抗不同血清型的HPS的感染,以及不同血清型HPS的TbpA可否使仔猪产生交叉免疫保护的研究奠定基础。
抗原能否刺激机体产生免疫反应及产生免疫反应的类型,对于其能否作为有效的疫苗候选抗原起着至关重要的作用。IgG是动物自然感染和人工主动免疫后,机体所产生的主要抗体类型,是动物机体抗感染免疫的主力军[20]。本研究对仔猪进行了三次免疫,与前二次免疫相比,三免后,A、B、C组均显著诱导机体产生IgG,且其之间已很接近,表明重组TbpA与灭活全菌体免疫机体后均能产生良好的体液免疫反应。细胞因子表达水平的变化可以反映机体发生的免疫反应类型, Th1细胞分泌IFN-γ、TNF-α 和IL-2等,其中TNF-α 在机体发热和炎症的发生中起免疫调节作用[21],可促进细胞免疫应答;Th2细胞分泌IL-5和IL-10等,其中IL-5可以促进B细胞分化与增长,诱导嗜酸性粒细胞分化[22],可促进体液免疫应答。仔猪三免后,A、B、C组的细胞因子水平(IL-5、IL-10、IFN-γ、TNF-α)均显著高于E组,且其之间也无显著差异,表明重组TbpA与灭活全菌体同样能够很好地诱导机体的Th1和Th2型免疫反应。
炎症反应实质上是一种以防御为主的病理过程。炎性细胞浸润是炎症反应的重要指征,炎性细胞在慢性炎症中吞噬病原体和组织碎片并进行消化,引起组织和细胞的损伤。本研究中,攻毒菌株毒力较强,攻毒后仔猪均出现急性死亡,故攻毒对照组仔猪病理变化以出血为主,组织损伤不明显。B组仔猪死亡时间比D组迟,内脏出血比D组轻,但组织损伤较严重。B组存活仔猪内脏也有一定程度的出血及组织损伤,但比死亡仔猪及D组仔猪轻。A、C组仔猪内脏未见出血,仅有轻微组织损伤,两组仔猪病理组织损伤差异不明显。可见机体在发挥免疫作用的同时,也会造成自身组织和细胞的损伤。炎症痊愈的结局是机体溶解吸收炎性渗出物及坏死组织。本研究中,B组存活仔猪肺和脾有一定量的炎性细胞变性坏死,A、C组仔猪肺和脾只有少量炎性细胞并且发生变性坏死,均提示为炎症的转归。机体对所形成组织损伤进行修补恢复的过程称为修复,修复后可完全或部分恢复原组织的结构和功能。本研究中,B组存活仔猪有一定程度组织损伤,处于修复初始阶段,A、C组仔猪组织损伤很轻微,可见已基本完成修复过程[23]。
抗体是由浆细胞产生,正常机体浆细胞存在于脾和淋巴结相应组织处,浆细胞产生抗体并释放到周围的组织液中。浆细胞具有合成、贮存抗体的功能,参与机体体液免疫反应。成纤维细胞为多突的纺锤形,核仁大而明显。处于静止状态的纤维细胞,胞体较小,当在外伤等因素刺激下,部分纤维细胞可转为功能活动旺盛的成纤维细胞,当机体受到损伤时,均会造成不同程度的细胞变性、坏死和组织缺损,必须通过细胞增生和细胞间质的形成来进行组织修复并参加细胞免疫,成纤维细胞在积极参加细胞免疫过程中有很重要的作用[24]。A组和C组的仔猪肺均出现浆细胞和成纤维细胞,表明对仔猪进行攻毒之后,重组TbpA(0.5 mg·4 mL-1)与灭活全菌体对仔猪均具有很好的免疫保护作用。
4 结 论
HPS血清型13型的TbpA能诱导仔猪产生免疫保护力,其中免疫剂量为0.5 mg·4 mL-1、免疫3次,对同型菌株的攻毒具有与免疫灭活全菌体相同的抵抗力,免疫保护率均为100%,这为进一步开展仔猪免疫血清型13型TbpA对不同血清型HPS的抵抗力,以及不同血清型HPS的TbpA诱导仔猪交叉免疫保护力的研究奠定了良好基础。
参考文献(References):
[1]孙尚芬, 白宁, 姜振国, 等. 副猪嗜血杆菌病研究进展[J]. 农业灾害研究, 2012, 2(2): 54-56, 69.
SUN S F, BAI N, JIANG Z G, et al.Research progress ofHaemophilusparasuis[J].JournalofAgriculturalCatastrophology, 2012, 2(2): 54-56, 59. (in Chinese)
[2]KIM J, CHUNG H K, JUNG T, et al. Postweaning multisystemic wasting syndrome of pigs in Korea: prevalence, microscopic lesions and coexisting microorganisms[J].JVetMedSci, 2002, 64(1): 57-62.
[3]付丹, 谭晓婷, 曹玉琴, 等. 副猪嗜血杆菌耐药性研究进展[J]. 中国预防兽医学报, 2016, 38(7): 591-594.
FU D, TAN X T, CAO Y Q, et al. Advances in drug resistance ofHaemophilusparasuis[J].ChineseJournalofPreventiveVeterinaryMedicine, 2016, 38(7): 591-594. (in Chinese)
[4]王乐, 赵战勤, 薛云, 等. 副猪嗜血杆菌国内流行血清型菌株的致病性比较研究[J]. 中国兽医学报, 2014, 34(11): 1748-1752.
WANG L, ZHAO Z Q, XUE Y,et al. Comparative study on pathogenicity of the most prevalent serovars ofHaemophilusparasuisisolates in China[J].ChineseJournalofVeterinaryScience, 2014, 34(11): 1748-1752. (in Chinese)
[5]LI M, CAI R J, SONG S, et al. Evaluation of immunogenicity and protective efficacy of recombinant outer membrane proteins ofHaemophilusparasuisserovar 5 in a murine model[J].PLoSOne,2017, 12(4): e0176537.
[6]PORCHERON G, DOZOIS C M. Interplay between iron homeostasis and virulence: fur and RyhB as major regulators of bacterial pathogenicity[J].VetMicrobiol, 2015, 179(1-2): 2-14.
[7]MEY A R, WYCKOFF E E, KANUKURTHY V, et al. Iron and fur regulationinvibriocholerae and the role of fur in virulence[J].InfectImmun, 2005, 73(12): 8167-8178.
[8]CHARLAND N, D’SILVA C G, DUMONT R A, et al. Contact-dependent acquisition of transferrin-bound iron by two strains ofHaemophilusparasuis[J].CanJMicrobiol, 1995, 41(1): 70-74.
[10]辛伟, 李郁, 黄晓慧, 等. 副猪嗜血杆菌转铁结合蛋白A基因的分段表达及其免疫原性分析[J]. 畜牧兽医学报, 2011, 42(12): 1743-1749.
XIN W, LI Y, HUANG X H,et al. Expression and immunogenicity of transferrin-binding protein A gene ofHaemophilusparasuis[J].ActaVeterinariaetZootechnicaSinica,2011, 42(12): 1743-1749. (in Chinese)
[11]黄晓慧, 辛伟, 魏建忠, 等. 副猪嗜血杆菌转铁结合蛋白A基因的原核表达与鉴定[J]. 中国兽医科学, 2012, 42(10): 1053-1057.
HUANG X H, XIN W, WEI J Z,et al. Prokaryotic expression of transferrin-binding protein A gene fromHaemophilusparasuisand immunological analysis of the recombinant protein[J].ChineseVeterinaryScience, 2012, 42(10): 1053-1057. (in Chinese)
[12]HUANG X H, LI Y, FU F G,et al. Cross-protective efficacy of recombinant Transferrin-binding protein A ofHaemophilusparasuisin guinea pigs[J].ClinVaccineImmunol,2013, 20(6): 912-919.
[13]易新健, 王小波, 高清清, 等. 苏皖地区副猪嗜血杆菌的分离鉴定与三价灭活疫苗的初步研制[J]. 中国兽医学报, 2017, 37(5): 823-827.
YI X J, WANG X B, GAO Q Q, et al. Isolation and identification ofHaemophilusparasuisin Jiangsu and Anhui province and preliminary development of trivalent inactivated bacterin[J].ChineseJournalofVeterinaryScience, 2017, 37(5): 823-827. (in Chinese)
[14]ZHAO Z Q, LIU H S, XUE Y,et al. Analysis of efficacy obtained with a trivalent inactivatedHaemophilusparasuisserovars 4, 5, and 12 vaccine and commercial vaccines against Glässer's disease in piglets[J].CanJVetRes,2017, 81(1): 22-27.
[15]ZHANG J M, XU C G, GUO L L, et al. Prevalence and characterization of genotypic diversity ofHaemophilusparasuisisolates from southern China[J].CanJVetRes, 2012, 76(3): 224-229.
[16]GALINA PANTOJA L, STAMMEN B, MINTON B, et al. Serologic profiling ofHaemophilusparasuis-vaccinated sows and their litters using a novel oligopeptide permease A enzyme-linked immunosorbent assay reveals unexpected patterns of serological response and maternal antibody transfer[J].JVetDiagnInvest, 2014, 26(1): 125-130.
[17]BELLO-ORTI B, COSTA-HURTADO M, MARTINEZ-MOLINER V, et al. Time courseHaemophilusparasuisinfection reveals pathological differences between virulent and non-virulent strains in the respiratory tract[J].VetMicrobiol, 2014, 170(3-4): 430-437.
[18]BARASUOL B M, GUIZZO J A, FEGAN J E, et al. New insights about functional and cross-reactive properties of antibodies generated against recombinant TbpBs ofHaemophilusparasuis[J].SciRep, 2017, 7: 10377.
[19]LI M, CAI R J, SONG S, et al. Evaluation of immunogenicity and protective efficacy of recombinant outer membrane proteins ofHaemophilusparasuisserovar 5 in a murine model[J].PLoSOne, 2017, 12(4): e0176537.
[20]GALL-DEBRECENI A, LAZAR J, KADAS J, et al. Specific detection and quantitation of bovine igG in bioreactor derived mouse mab preparations[J].JImmunolMethods, 2016, 438: 26-34.
[21]PINTO R A, ARREDONDO S M, BONO M R, et al. T helper 1/T helper 2 cytokine imbalance in respiratory syncytial virus infection is associated with increased endogenous plasma cortisol[J].Pediatrics, 2006, 117(5): e878-e886.
[22]SINGH U, KUMAR A, SINHA R, et al. Calreticulin transacetylase catalyzed modification of the TNF-α mediated pathway in the human peripheral blood mononuclear cells by polyphenolic acetates[J].ChemBiolInteract, 2010, 185(3): 263-270.
[23]JUNG K, CHAE C.In-situhybridization for the detection ofHaemophilusparasuisin naturally infected pigs[J].JCompPathol, 2004, 130(4): 294-298.
[24]张从纪. 成纤维细胞免疫调节作用新概念[J]. 西南国防医药, 2000, 10(2): 120-123.
ZHANG C J. New concept ofimmunomodulatory effect of fibroblasts[J].MedicalJournalofNationalDefendingForcesinSouthwestChina, 2000, 10(2): 120-123. (in Chinese)

