体外法探究果寡糖对猪后肠微生物代谢苯丙氨酸和色氨酸的影响
慕春龙,马梅蕾,何香玉,朱伟云
(南京农业大学消化道微生物实验室,江苏省消化道营养与动物健康重点实验室,南京 210095)
苯丙氨酸(Phe)和色氨酸(Trp)属于芳香族氨基酸,是人和动物体的必需氨基酸,对机体的生长发育和新陈代谢都发挥着重要作用。此外,肠道共生的微生物具有利用苯丙氨酸和色氨酸的能力[1-2]。研究指出,日粮中大量苯丙氨酸和色氨酸能够逃避小肠内酶及肠液的消化到达结肠经微生物代谢利用,产生苯乙酸、吲哚和3-甲基吲哚(粪臭素)等物质[3]。其中,粪臭素能够经肠壁吸收进入血液循环,一部分粪臭素储存在脂肪和肌肉组织,影响猪肉品质;另一部分经肝代谢随粪尿排到体外,严重污染环境[4]。体外试验发现,添加果寡糖(Fructo-oligosaccharides,FOS)可以改变动物肠道微生态区系和发酵模式,进而影响吲哚和粪臭素的产生[5-6]。猪不同肠道部位微生物组成存在差异,回肠、盲肠和结肠中优势菌群不同[7-8],然而关于后肠不同部位吲哚和粪臭素产生量的研究相对较少。
本试验研究了外源添加苯丙氨酸、色氨酸、果寡糖对后肠微生物发酵液中吲哚和粪臭素的影响,比较后肠微生物对其利用的差异。这为提高猪肉品质,降低猪体外粪臭素污染和后肠氮营养素利用提供参考数据和理论支持。
1 材料与方法
1.1 食糜接种物及厌氧培养液制备方法
回肠、盲肠和结肠的食糜样品取自于4头健康的杜×长×大育肥猪。分别采集3个肠段的中段内容物,混匀,称量。用37 ℃预热的灭菌磷酸盐缓冲液9∶1进行稀释。将混合液经四层无菌纱布滤过至充满CO2的血清瓶中。厌氧培养基及其制备参考Z.L.Dai等[1]的方法,分装82 mL至血清瓶,再加入1 mL果寡糖母液(0.5 和0.75 g·mL-1),115 ℃灭菌15 min。氨基酸培养基需将10 mL氨基酸母液注入血清瓶中使终浓度为10 mmol·L-1。接种前将1 mL维生素溶液和1 mL还原剂溶液注入培养基,37 ℃预热30 min。
1.2 试验设计
每种氨基酸均按3 × 3正交试验设计,即分别添加0、0.5、0.75 g果寡糖和接种5 mL 肠道(回肠、盲肠、结肠)稀释液于含有10 mmol·L-1单一氨基酸(Phe或Trp)37 ℃预热的培养基中。每个处理组设置4个重复。将所有血清瓶置于37 ℃恒温水浴锅培养24 h。
1.3 猪后肠发酵液发酵指标测定
体外培养24 h后冰水浴终止发酵,参照M.Weatherburn[9]的方法改进后测定NH3-N浓度;参照H.P.S.Makkar等[10]改进方法测定菌体蛋白MCP浓度;参照Z.L.Dai等[11]方法测定氨基酸浓度。参照Y.X.Yang等[12]的方法测定吲哚和粪臭素的含量。
1.4 猪后肠发酵液总菌DNA的提取和Real-time PCR
参照W.Y.Zhu等[13]的方法,采用珠磨法(bead-beating)及酚-氯仿-异戊醇抽提发酵液样品基因组DNA。根据S.E.Denman等[14]的方法采用Real-time PCR对发酵液样品进行总菌的绝对定量。
1.5 数据统计分析
发酵指标等试验数据经Excel 2012整理后,利用SPSS 17.0 进行多因素方差分析,用 Duncan法进行多重比较。结果以“平均值(Mean)”表示,以P<0.05作为差异显著的判断标准。
2 结 果
2.1 FOS对猪不同肠段发酵液中Phe和Trp降解率的影响
发酵液中Phe和Trp降解率变化如图1。Phe发酵结果显示,不同肠段细菌对于Phe的利用率不同,盲肠>结肠>回肠。不同FOS添加量对Phe的利用不同,在盲肠组中,添加0.75 g FOS可使发酵液中Phe降解率显著低于0.5 g FOS组(P<0.05)。Trp发酵结果显示,不同肠段细菌对于Trp的利用率不同,回肠>结肠和盲肠。不同FOS添加量对Trp的利用不同,在不同肠段发酵液中添加0.75 g FOS可使发酵液中Trp降解率显著低于0和0.5 g FOS组(P<0.05)。统计分析表明,FOS和肠段对发酵液中Trp降解率存在显著的交互作用(P<0.05)。
2.2 FOS对猪不同肠段发酵液中氨基酸发酵特性的影响
发酵液中NH3-N和MCP浓度变化见表1。Phe发酵结果显示,FOS和肠段均显著影响发酵液中NH3-N和MCP浓度,并有显著交互作用(P<0.05)。FOS显著降低回肠和结肠NH3-N浓度(P<0.05),且结肠NH3-N减少量大于回肠;FOS可显著升高盲肠和结肠MCP浓度(P<0.05),且结肠MCP增加量大于盲肠。Trp发酵结果显示,FOS和肠段均显著影响发酵液中NH3-N和MCP浓度(P<0.05)。FOS显著降低回肠和盲肠NH3-N浓度,而结肠NH3-N浓度显著低于回肠和盲肠(P<0.05);FOS显著升高盲肠和结肠MCP浓度(P<0.05),且盲肠MCP增加量大于结肠,在回肠组中添加0.5 g FOS可引起 MCP浓度上升。另外,FOS和肠段对Trp发酵液中MCP存在显著交互作用(P<0.05)。
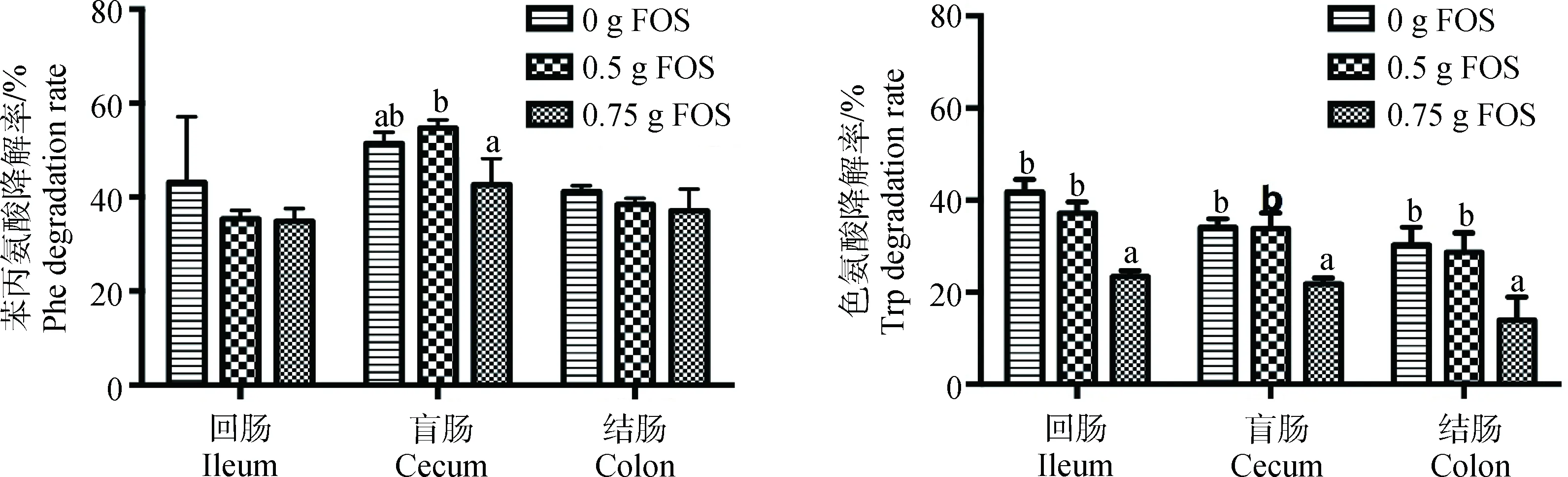
图1 FOS对猪不同肠段发酵液中苯丙氨酸和色氨酸消失率的影响Fig.1 The effects of FOS on degradation rate of Phe and Trp in fermentation broths of pig different intestinal segments in vitro
2.3 FOS对猪不同肠段发酵液中吲哚和粪臭素浓度的影响
不同肠段发酵液中吲哚和粪臭素浓度测定结果见表1。Phe和Trp发酵中,回肠中均没有粪臭素产生。Phe体外发酵中,所有肠段均没有吲哚产生,仅盲肠和结肠有少量粪臭素产生,且FOS和肠段均显著影响粪臭素浓度,FOS可显著升高粪臭素浓度(P<0.05),添加0.75 g FOS盲肠和结肠粪臭素浓度分别为 20.58 和83.13 mg·L-1。同时,所有处理中结肠粪臭素浓度均显著高于盲肠(P<0.05)。Trp体外发酵中,FOS对发酵液中吲哚浓度变化影响显著(P<0.05),回肠吲哚浓度显著高于盲肠和结肠(P<0.05),其吲哚浓度可高达1 016.83 mg·L-1。FOS显著降低发酵液中粪臭素浓度(P<0.05),且结肠粪臭素浓度显著低于盲肠(P<0.05),添加0.75 g FOS可使发酵液中盲肠和结肠粪臭素浓度分别降低201.93和305.66 mg·L-1。综合比较Phe和Trp发酵结果可知,FOS对粪臭素的产生存在剂量效应。另外,FOS和肠段对发酵液中粪臭素浓度存在交互作用(P<0.05)。
表1FOS对猪不同肠段发酵液中氨氮、微生物蛋白、吲哚和粪臭素浓度的影响
Table1TheeffectsofFOSonconcentrationsofNH3-N,MCP,indoleandskatoleinfermentationbrothsofpigdifferentintestinalsegmentsinvitro
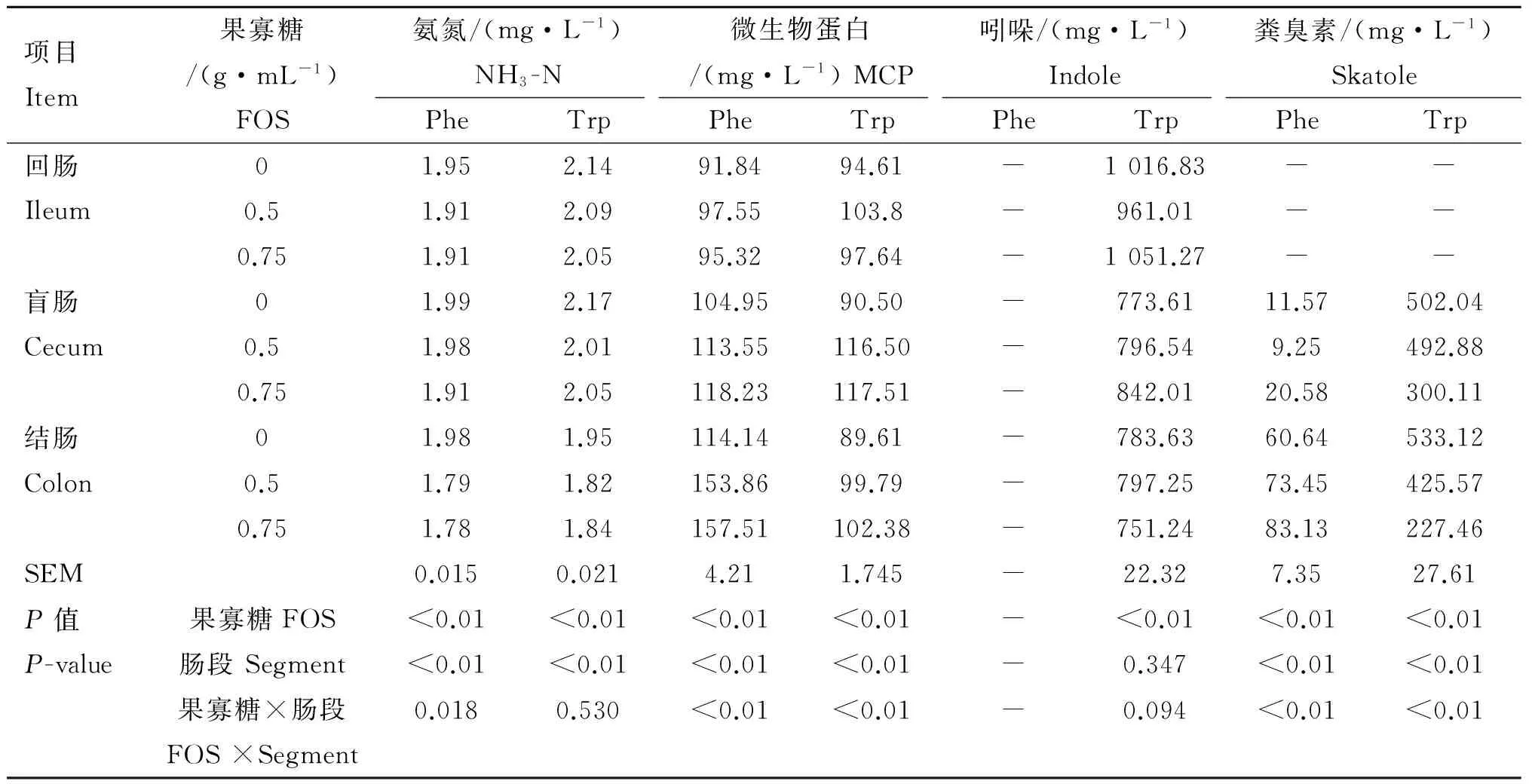
项目Item果寡糖/(g·mL-1)FOS氨氮/(mg·L-1)NH3-N微生物蛋白/(mg·L-1)MCP吲哚/(mg·L-1)Indole粪臭素/(mg·L-1)SkatolePheTrpPheTrpPheTrpPheTrp回肠Ileum01.952.1491.8494.61-1016.83--0.51.912.0997.55103.8-961.01--0.751.912.0595.3297.64-1051.27--盲肠Cecum01.992.17104.9590.50-773.6111.57502.040.51.982.01113.55116.50-796.549.25492.880.751.912.05118.23117.51-842.0120.58300.11结肠Colon01.981.95114.1489.61-783.6360.64533.120.51.791.82153.8699.79-797.2573.45425.570.751.781.84157.51102.38-751.2483.13227.46SEM0.0150.0214.211.745-22.327.3527.61P值P-value果寡糖FOS<0.01<0.01<0.01<0.01-<0.01<0.01<0.01肠段Segment<0.01<0.01<0.01<0.01-0.347<0.01<0.01果寡糖×肠段FOS×Segment0.0180.530<0.01<0.01-0.094<0.01<0.01
-. 该指标含量未检测到
-. No detection
2.4 FOS对猪不同肠段发酵液中总菌数量的影响
不同肠段发酵液中的总菌数量见图2。结果显示, Phe体外发酵中,FOS对回肠总菌数量无显著影响;不同剂量FOS处理引起盲肠中总菌数量先下降再升高,0.75 g FOS组显著高于0.5和 0 g FOS组(P<0.05);FOS能够降低结肠总菌数量,0.75 和0.5 g FOS组显著低于 0 g FOS组(P<0.05)。不添加FOS和添加0.5 g FOS处理组,发酵液中总菌数量存在如下关系:结肠>回肠>盲肠,添加0.75 g FOS处理组为结肠>盲肠>回肠。Trp发酵结果显示,添加不同剂量FOS将引起回肠总菌数量先下降后上升,盲肠总菌数量不存在剂量效应,添加0.5和0.75 g FOS使结肠总菌数量显著升高(P<0.05)。无FOS添加时,发酵液中总菌数量存在如下关系:结肠>盲肠>回肠;添加不同剂量的FOS都将导致发酵液中总菌数量表现为:结肠>盲肠和回肠。
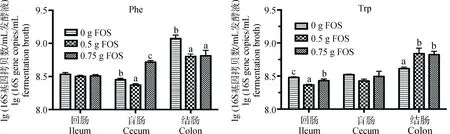
图2 FOS对猪不同肠段发酵液中总菌数量的影响Fig.2 The effects of FOS on numbers of total bacteria in fermentation broths of pig different intestinal segments in vitro
3 讨 论
3.1 果寡糖对猪不同肠段体外发酵液中Phe和Trp降解率的影响
本研究发现,不同肠段细菌对于Phe的利用率不同,依次为盲肠>结肠>回肠,而不同肠段细菌对于Trp的利用率依次为回肠>结肠和盲肠。对Phe和Trp利用的这种差异,可能与不同肠段微生物组成不同有关。马梅蕾等[15]发现,不同芳香族氨基酸的肠道代谢菌具有差异性,本结果与之相一致。Z.L.Dai等[1]基于16S rRNA基因的分子技术研究发现,小肠细菌利用及代谢氨基酸有一定的细菌种属特异性,而Y.X.Yang等[2]发现,不同肠道区室微生物对氨基酸的代谢不同,这与本研究结果相一致。
后肠中的Phe和Trp可以被细菌代谢利用,使氨基酸的降解率降低。本研究发现,添加0.75 g FOS可使盲肠发酵液中Phe降解率显著低于0.5 g FOS组。各肠段添加0.75 g FOS可使发酵液中Trp降解率显著低于0 和0.5 g FOS组。这可能是由于添加碳水化合物后使后肠微生物减少对氨基酸的分解代谢,更多的用于合成菌体蛋白。L.P.Zhou等[16]和Y.Sun等[17]在猪日粮中添加抗性淀粉的研究中发现,后肠中可发酵碳水化合物增加,微生物对氨基酸的发酵降低,微生物的组成发生改变。R.Pieper等[18]在仔猪的研究中发现相似的结果,日粮中可发酵碳水化合物(非淀粉多糖、寡糖和FOS)等不能被胃和小肠消化酶分解,直接进入大肠作为微生物发酵底物,从而降低后肠微生物发酵蛋白产生的毒性物质,改变了菌群的发酵模式。罗玉衡等[19]在猪日粮中添加高水平豌豆纤维的研究发现,盲肠的微生物群落结构组成改变,从而改变后肠的发酵方式。本研究表明,增加后肠可发酵碳水化合物,后肠微生物会更多趋向于利用碳水化合物,降低对Phe或Trp的发酵。
3.2 果寡糖对猪不同肠段体外发酵液中代谢产物的影响
饲料中含有一些消化率较低的蛋白质饲料,由于不能被猪小肠消化,进入后肠在微生物的发酵下产生一些有害的气体或化合物。蛋白质或含氮化合物在大肠中被细菌发酵,产生氨氮、MCP、吲哚等代谢产物[20]。本研究发现,FOS可以显著降低Phe(回肠和结肠)组、Trp(回肠和盲肠)组发酵液中NH3-N浓度,且Trp(回肠和盲肠)组存在剂量效应。其原因可能是添加FOS使得C和N平衡,促进肠道细菌合成菌体蛋白,减少NH3-N的产生。研究发现,添加FOS可显著升高盲肠和结肠发酵液中MCP浓度。这一结果说明FOS可以促进盲肠和结肠细菌利用Phe和Trp合成菌体蛋白,且不受FOS添加量的影响。综合比较发酵液中NH3-N和MCP测定结果发现,FOS对NH3-N与MCP的影响作用具有肠段差异性。且添加0.5 g FOS可使Phe和Trp更多的合成菌体蛋白。
吲哚和粪臭素是猪后肠微生物降解色氨酸的主要代谢产物。本研究发现,在Trp体外发酵液中FOS能够降低盲肠组和结肠组发酵液中粪臭素浓度,且存在剂量效应,这与前人的研究结果相一致[5]。同时添加FOS还可以促进发酵液中吲哚的生成。但是,在本研究中发酵液中吲哚浓度不受FOS添加的影响,其原因可能是Trp可利用量较高。本研究中Trp添加量为10 mmol·L-1,远远高于以往体外试验中250 μmol·L-1Trp添加量[1]。色氨酸在大肠杆菌和梭菌的参与下生成吲哚-3-乙酸,然后经过梭菌和乳酸杆菌转化生成粪臭素[21-22]。因此,本研究中FOS可能抑制了吲哚-3-乙酸的脱羧作用和色氨酸的降解,减少了粪臭素的生成,对吲哚生成途径无调控作用。这与前人在动物日粮中添加发酵型碳水化合物减少动物肠道中色氨酸降解的结果相一致[23]。Phe体外发酵中仅盲肠和结肠有少量粪臭素生成,且FOS促进了粪臭素的形成。其原因可能是肠道中大量微生物能够利用FOS发酵产生SCFA等为微生物提供能量,使得微生物有较多的碳源用于合成Trp,进而导致Phe发酵中粪臭素的产生。因此可知,本研究中Phe和Trp发酵产生粪臭素的机理存在差异。另外,本研究发现Phe和Trp发酵中回肠均没有粪臭素产生,仅Trp(回肠)组中有大量吲哚生成,这可能是由于回肠中不存在色氨酸及粪臭素产生菌。
3.3 果寡糖对猪不同肠段发酵液中总菌数量的影响
有研究表明,FOS能显著提高粪样中菌群多样性[24-26]。本研究中,FOS对不同肠段微生物体外发酵液中总菌数量的影响显著,其原因可能与不同肠段内微生物种类及数量不同有关。FOS添加量及肠段微生物菌落结构的差异引起组间总菌数量上的差异。Phe发酵试验组中,FOS显著降低结肠总菌数量。有研究报道,葡萄糖和FOS作为不同碳源类型影响氨基酸向菌体生成或代谢利用的转化[27]。随着肠段后移葡萄糖可利用量也逐渐降低,导致FOS添加后细菌总菌数量降低。Trp发酵过程中,FOS显著升高结肠总菌数量,这和以往研究结果相一致[28]。添加FOS降低发酵液中粪臭素含量,减少粪臭素对微生物菌群的危害作用,进而引起结肠总菌数量的增加。但是,随着FOS添加量的上升,回肠总菌数量呈现先降低后升高的趋势,这可能是由于添加FOS影响了发酵液中C、N比例,并且改变了肠道细菌群落结构,引起细菌发酵类型改变,最终导致组间总菌数量的差异。
4 结 论
本研究表明,后肠添加可发酵果寡糖,后肠微生物会更趋向于利用果寡糖,降低对Phe或Trp的发酵。果寡糖能够降低粪臭素的产生量, 却对吲哚产生没有影响,提示其可降低色氨酸向粪臭素的转化;外源添加果寡糖对苯丙氨酸和色氨酸发酵特性的影响不同。
参考文献(References):
[1]DAI Z L, ZHANG J, WU G Y, et al. Utilization of amino acids by bacteria from the pig small intestine[J].AminoAcids, 2010, 39(5): 1201-1215.
[2]YANG Y X, DAI Z L, ZHU W Y. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs[J].AminoAcids, 2014, 46(11): 2489-2501.
[3]SMITH E A, MACFARLANE G T. Enumeration of human colonic bacteria producing phenolic and indolic compounds: effects of pH, carbohydrate availability and retention time on dissimilatory aromatic amino acid metabolism[J].JApplBacteriol, 1996, 81(3): 288-302.
[4]YOKOYAMA M T, CARLSON J R. Microbial metabolites of tryptophan in the intestinal tract with special reference to skatole[J].AmJClinNutr, 1979, 32(1): 173-178.
[5]盛清凯, 成建国, 赵红波, 等. 外源L-色氨酸、果聚糖、酪蛋白对猪粪发酵液粪臭素浓度的影响[J]. 动物营养学报, 2014, 26(9): 2797-2804.
SHENG Q K, CHENG J G, ZHAO H B, et al. Effects of additionalL-Tryptophan, fructan and casein on skatole concentration in pig manure fermentation broths[J].ChineseJournalofAnimalNutrition, 2014, 26(9): 2797-2804. (in Chinese)
[7]MU C L, YANG Y X, SU Y, et al. Differences in microbiota membership along the gastrointestinal tract of piglets and their differential alterations following an early-life antibiotic intervention[J].FrontMicrobiol, 2017, 8: 797.
[8]ZHAO W J, WANG Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J].PLoSOne, 2015, 10(2): e0117441.
[9]WEATHERBURN M. Phenol-hypochlorite reaction for determination of ammonia[J].AnalChem, 1967, 39(8): 971-974.
[10]MAKKAR H P S, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J].JDairySci, 1982, 65(11): 2170-2173.
[11]DAI Z L, WU Z L, JIA S C, et al. Analysis of amino acid composition in proteins of animal tissues and foods as pre-columno-phthaldialdehyde derivatives by HPLC with fluorescence detection[J].JChromatogrB, 2014, 964: 116-127.
[12]YANG Y X, MU C L, LUO Z, et al. Bromochloromethane, a methane analogue, affects the microbiota and metabolic profiles of the rat gastrointestinal tract[J].ApplEnvironMicrobiol, 2016, 82(3): 778-787.
[13]ZHU W Y, WILLIAMS B A, KONSTANTINOV S R, et al. Analysis of 16S rDNA reveals bacterial shift duringinvitrofermentation of fermentable carbohydrate using piglet faeces as inoculum[J].Anaerobe, 2003, 9(4): 175-180.
[14]DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].FEMSMicrobiolEcol, 2006, 58(3): 572-582.
[15]马梅蕾, 何香玉, 朱伟云. 体外法研究猪后肠道对芳香族氨基酸的发酵特性[J]. 微生物学报, 2016, 56(11): 1786-1793.
MA M L, HE X Y, ZHU W Y. Metabolic pattern of pig hindgut bacteria on aromatic amino acids by aninvitrofermentation method[J].ActaMicrobiologicaSinica, 2016, 56(11): 1786-1793. (in Chinese)
[16]ZHOU L P, FANG L D, SUN Y, et al. Effects of a diet high in resistant starch on fermentation end-products of protein and mucin secretion in the colons of pigs[J].Starch-Stärke, 2017, 69(7-8): 1600032.
[17]SUN Y, ZHOU L P, FANG L D, et al. Responses in colonic microbial community and gene expression of pigs to a long-term high resistant starch diet[J].FrontMicrobiol, 2015, 6: 877.
[18]PIEPER R, KRÖGER S, RICHTER J F, et al. Fermentable fiber ameliorates fermentable protein-induced changes in microbial ecology, but not the mucosal response, in the colon of piglets[J].JNutr, 2012, 142(4): 661-667.
[19]罗玉衡, 陈洪, 余冰, 等. 短期或长期饲喂高水平豌豆纤维对猪盲肠微生物群落结构和代谢产物的影响[J]. 畜牧兽医学报, 2017, 48(8): 1459-1467.
LUO Y H, CHEN H, YU B, et al. Short-term or long-term intake of high-level pea fiber specifically affects the bacterial community and metabolites in the cecum of pigs[J].ActaVeterinariaetZootechnicaSinica, 2017, 48(8): 1459-1467. (in Chinese)
[20]DAI Z L, WU G, ZHU W Y. Amino acid metabolism in intestinal bacteria: links between gut ecology and host health[J].FrontBiosci, 2011, 16: 1768-1786.
[21]DESLANDES B, GARIÉPY C, HOUDE A. Review of microbiological and biochemical effects of skatole on animal production[J].LivestProductSci, 2001, 71(2-3): 193-200.
[22]CHUNG K T, ANDERSON G M, FULK G E. Formation of indoleacetic acid by intestinal anaerobes[J].JBacteriol, 1975, 124(1): 573-575.
[23]JENSEN M T, COX R P, JENSEN B B. 3-Methylindole (skatole) and indole production by mixed populations of pig fecal bacteria[J].ApplEnvironMicrobiol, 1995, 61(8): 3180-3184.
[24]KONSTANTINOV S R, ZHU W Y, WILLIAMS B A, et al. Effect of fermentable carbohydrates on piglet faecal bacterial communities as revealed by denaturing gradient gel electrophoresis analysis of 16S ribosomal DNA[J].FEMSMicrobiolEcol, 2003, 43(2): 225-235.
[25]SCOTT K P, GRATZ S W, SHERIDAN P O, et al. The influence of diet on the gut microbiota[J].PharmacolRes, 2013, 69(1): 52-60.
[26]FLINT H J, SCOTT K P, DUNCAN S H, et al. Microbial degradation of complex carbohydrates in the gut[J].GutMicrobes, 2012, 3(4): 289-306.
[27]王政, 毛胜勇, 朱伟云. 一株产吲哚菌的分离鉴定及其碳源发酵特性分析[J]. 南京农业大学学报, 2011, 34(3): 140-142.
WANG Z, MAO S Y, ZHU W Y. Carbohydrate utilization of an indole-producing bacterium[J].JournalofNanjingAgriculturalUniversity, 2011, 34(3): 140-142. (in Chinese)
[28]LI C Y, LIU J X, WANG Y Z, et al. Influence of differing carbohydrate sources onL-tryptophan metabolism by porcine fecal microbiota studiedinvitro[J].LivestSci, 2009, 120(1-2): 43-50.

