检测兔出血症病毒抗体胶体金试纸条的研制及初步应用
魏后军,范志宇,王 芳,宋艳华,胡 波,仇汝龙,陈萌萌,徐为中,薛家宾
(江苏省农业科学院兽医研究所·农业部动物疫病诊断与免疫重点开放实验室· 国家兽用生物制品工程技术研究中心,南京 210014)
兔病毒性出血症(RHD),俗称“兔瘟”,是由兔出血症病毒(RHDV)引起的一种高度致死性、急性败血性传染病,该病发病率、病死率极高,给养兔业造成极大经济损失[1]。目前,我国主要通过疫苗接种来预防和控制兔瘟。体液免疫应答在兔瘟的感染及免疫中起到重要的作用。通过检测特异性抗体的应答能诊断RHDV的感染。检测免疫后或恢复期动物体内特异性抗体滴度可预测家兔抵抗RHDV感染的能力。因此,建立能快速、准确检测RHDV抗体水平的方法显得尤为重要。目前,检测兔出血症病毒抗体主要使用血凝抑制试验(HI)[2]、间接ELISA和竞争ELISA[3],有研究者报道血清血凝抑制效价为3log2以上的家兔,能抵抗RHDV强毒攻击[4]。但这些方法步骤繁琐,需要专业的设备和技术人员,不适合基层推广。胶体金试纸条在畜禽疾病监测方面得到广泛的研究和应用[5-8],具有快速、简便、准确的特点,非常适合临床应用。
衣壳蛋白VP60是RHDV的主要结构蛋白,重组杆状病毒表达系统能够高效表达VP60,并且能够在体外自聚成形态学以及抗原性上与天然 RHDV病毒粒子几乎无差异的病毒样颗粒[9-10]。本实验室已经建立了以重组VP60蛋白作为包被抗原检测RHDV抗体的ELISA方法,具有较高的特异性、敏感性等,同时避免了直接包被病毒存在的散毒风险[11];目前还未见以病毒样颗粒作为金标抗原研制试纸条的报道。一个金黄色葡萄球菌蛋白A(SPA)分子可以和多个IgG结合,与兔IgG有较强的结合能力[12-13]。因此,本研究用纯化的VP60蛋白作为金标抗原,具有较好的特异性,并具有良好的生物安全性;在NC膜上C线、T线分别包被抗RHDV VP60单克隆抗体A3C、金黄色葡萄球菌蛋白A(SPA);以检测HI效价为3log2的样品,T线、C线出现相同颜色深度条带为标准,优化反应条件,研制出可以根据T线、C线显色情况反映兔出血症病毒抗体水平的胶体金试纸条。该试纸条用血清作为样本即可进行抗体检测,为兔病毒性出血症流行病学调查和疫苗免疫效果评价提供了一种快速、便捷的方法。
1 材料与方法
1.1 毒株及细胞
抗RHDV VP60 单克隆抗体A3C[5]和杆状病毒表达系统表达的重组VP60蛋白[9]由本实验室制备[14-15]。
1.2 血清
兔出血症病毒强阳性(HI效价大于等于4log2)、阳性(HI效价为3log2)、弱阳性(HI效价为1log2或2log2)血清和兔多杀性巴氏杆菌(Pm)、兔支气管败血波氏杆菌(Bb)、兔A型产气荚膜梭菌(CpA)的阳性血清均由本实验制备;阴性血清来自邳州市东方养殖有限公司的SPF兔。
1.3 主要试剂
金黄色葡萄球菌蛋白A(SPA)购自北京博尔西科技有限公司;不含IgG的牛血清白蛋白(BSA)购自上海翊圣生物科技有限公司;PEG 20000购自Biosharp公司;氯金酸、柠檬酸三钠购自国药集团化学试剂有限公司。兔出血症基因工程疫苗[9]由本实验室制备,商品化兔出血症组织灭活疫苗购自南京天邦生物科技有限公司。
1.4 试纸条材料
硝酸纤维素膜购自Millipore公司,样品垫、金标垫、吸水纸、支撑板、塑料卡购自上海捷宁生物科技有限公司。
1.5 胶体金的制备
采用柠檬酸三钠法制备直径20 nm的胶体金颗粒[8],用透射电镜观察,2~8 ℃保存、备用。
1.6 胶体金试纸条的制备
1.6.1胶体金标记VP60最适pH值的选择取9支试管,每支试管加入1 mL胶体金溶液,分别加入0.1 mol·L-1K2CO3溶液1、2、3、4、5、6、7、8、9 μL调节pH值,各试管滴加50 μL 1 mg·mL-1的VP60,混匀后作用30 min,加入10%NaCl 100 μL,混匀室温放置30 min后,记录溶液保持红色的最低0.1 mol·L-1K2CO3添加量,并用精密pH试纸检测该溶液的pH值,即为胶体金标记VP60最适pH值。
1.6.2胶体金标记VP60最适蛋白量的选择取9支试管,每支试管加入1 mL调节到最适pH值的胶体金溶液,分别加入1 mg·mL-1的VP60 5、10、15、20、25、30、35、40、45 μL,混匀后作用30 min,加入10%NaCl 100 μL,混匀室温放置30 min后,溶液保持红色的最低VP60的添加量,在此基础上增加20%即为最适标记蛋白量。
1.6.3胶体金标记蛋白向调至最佳pH的胶体金溶液中,缓慢加入最适蛋白量的VP60,室温搅拌30 min;加入10% PEG20000 至终浓度1%作为稳定剂;将上述胶体金溶液经离心法纯化[8],加入重悬液(含0.1%PEG20000的0.002 mol·L-1硼酸缓冲液)重悬至原体积的1/10,置2~8 ℃备用。
1.6.4试纸条的组装依次把吸水垫、金标垫和样品垫粘贴到NC膜上,各垫之间有1 mm重叠,用切条机切成4 mm宽的试纸条,装入塑料卡,置于铝箔袋中,加干燥剂密封。
1.7 试纸条条件优化
1.7.1金标VP60溶液稀释度的选择将金标溶液用重悬液按一定比例稀释,喷在金标垫上,温箱烘干;NC膜C线、T线分别包被过量的A3C、SPA;组装成试纸条。用试纸条分别检测100倍稀释的强阳性、阳性、弱阳性血清,选择的稀释度满足条件:检测强阳性血清时,T线颜色比C线深;阳性血清时,T线、C线颜色相同;检测弱阳性血清时,T线颜色比C线浅。
1.7.2T线、C线的浓度的选择以T线SPA,C线 A3C不同蛋白浓度做点阵,与包被最佳稀释度金标溶液的金标垫等组装成试纸条。用试纸条分别检测100倍稀释的强阳性、阳性、弱阳性血清,T线、C线浓度的选择满足条件:检测强阳性血清时,T线颜色比C线深;阳性血清时,T线、C线颜色相同;检测弱阳性血清时,T线颜色比C线浅。
1.8 敏感性
强阳性血清(HI效价为8log2)用生理盐水依次倍比稀释1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512,即HI效价分别为7log2、6log2、5log2、4log2、3log2、2log2、1log2、0log2、-1log2,将生理盐水稀释100倍的以上样品和不稀释的强阳性血清,吸取100 μL滴加到试纸条加样孔中,10 min判断结果。
1.9 特异性
将兔多杀性巴氏杆菌(Pm)、兔支气管败血波氏杆菌(Bb)、兔A型产气荚膜梭菌(CpA)的阳性血清用生理盐水100倍稀释,吸取100 μL滴加到试纸条加样孔中,10 min判断结果。
1.10 重复性
从3批次试纸条中各抽取40条,检测强阳性、阳性、弱阳性、阴性血清样品,观察试纸条检测结果。
1.11 稳定性
试纸条2~8 ℃保存,每隔一个月抽取试纸条检测强阳性、阳性、弱阳性、阴性血清样品,观察试纸条检测结果。
1.12 符合率
取已测HI效价的强阳性血清、阳性血清、弱阳性血清各80份,阴性血清20份,用试纸条检测并计算与血凝抑制方法的符合率。
1.13 试纸条的初步应用
兔出血症基因工程疫苗、兔出血症组织灭活疫苗、PBS各1 mL分别皮下注射5只实验兔;在免疫后0、3、7、14、21 d采血,用试纸条检测血清,比较两种疫苗的抗体产生期。
2 结 果
2.1 胶体金的制备
采用柠檬酸三钠法制备胶体金颗粒,通过透射电镜扫描观察,胶体金分布均匀、大小均一;随机取50个胶体金颗粒,测量其直径,粒径为(20.6±2.0)nm。
2.2 胶体金标记VP60最适pH值
胶体金标记VP60最适pH值选择试验结果显示,每毫升胶体金溶液中最少添加6 μL 0.1 mol·L-1K2CO3,溶液仍保持红色,此时溶液pH值为7.5,即为标记VP60最适pH值。
2.3 胶体金标记VP60最适蛋白量
胶体金标记VP60最适蛋白量的选择试验结果显示,每毫升胶体金溶液中最少添加15 μL 1 mg·mL-1的VP60能使溶液保持红色,在此基础上增加20%,即18 μL 1 mg·mL-1的VP60为最适蛋白量。
2.4 试纸条条件优化
金标VP60溶液用重悬液按1∶4稀释;T线SPA质量浓度为0.6 mg·mL-1,C线A3C质量浓度为2.0 mg·mL-1。优化条件后制备的试纸条检测强阳性血清(HI效价大于等于4log2)时,T线颜色比C线深;阳性血清(HI效价为3log2)时,T线、C线颜色相同;检测弱阳性血清(HI效价为1log2或2log2)时,T线颜色比C线浅(图1)。
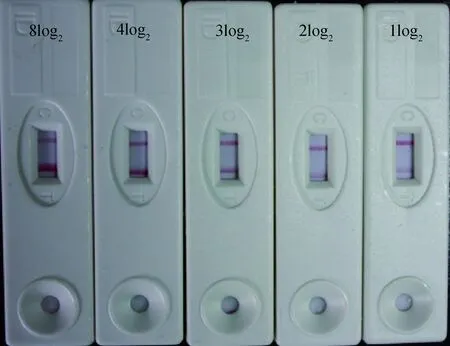
图1 经优化试纸条的检测结果Fig.1 The detection result of optimized strips
2.5 敏感性
试纸条敏感性试验结果显示,试纸条可以直接检测强阳性血清,最低可以检测到经生理盐水100倍稀释的1log2样品,说明试纸条检测范围为:原液至1∶12 800;试纸条在检测100倍稀释的样品时,敏感性与血凝抑制方法相同。
2.6 结果判定
待检血清用生理盐水100倍稀释后,吸取100 μL
滴加到加样孔中,10 min判断结果。T线颜色比C线深判定为强阳性;T线、C线颜色相同判定为阳性;T线颜色比C线浅判定为弱阳性;T线不显色、C线显色判定为阴性;C线不显色则试纸条无效。
2.7 特异性
试纸条特异性试验显示,兔多杀性巴氏杆菌(Pm)、兔支气管败血波氏杆菌(Bb)、兔A型产气荚膜梭菌(CpA)的阳性血清及阴性(SPF)血清结果均为阴性,而RHDV阳性血清检测结果为阳性,说明该试纸条特异性良好。
2.8 重复性、稳定性
3批次试纸条检测强阳性、阳性、弱阳性、阴性血清结果一致。试纸条2~8 ℃保存6个月,检测强阳性、阳性、弱阳性、阴性血清结果不变。
2.9 符合率
胶体金试纸条检测强阳性、阳性、弱阳性、阴性血清的结果与血凝抑制试验的符合率分别为93.75%、88.75%、91.25%、95.00%,260份样品中,两种检测方法结果相同的共75+71+73+19=238份,总的符合率为91.54%(表1)。
表1胶体金试纸条与血凝抑制试验比较
Table1ComparisonofcolloidalgoldteststripwithHItest
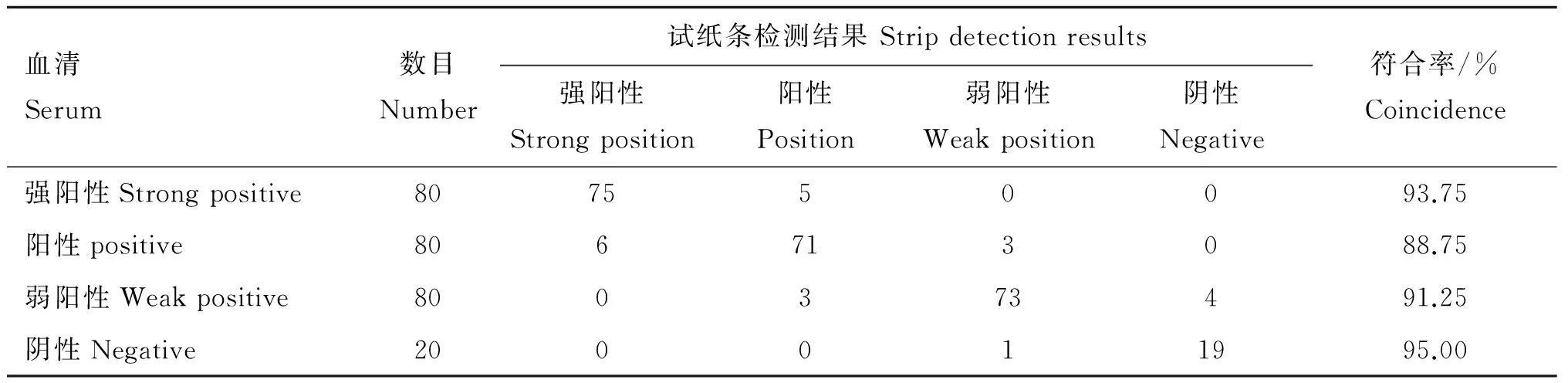
血清Serum数目Number试纸条检测结果Stripdetectionresults强阳性Strongposition阳性Position弱阳性Weakposition阴性Negative符合率/%Coincidence强阳性Strongpositive807550093.75阳性positive806713088.75弱阳性Weakpositive800373491.25阴性Negative200011995.00
2.10 试纸条的初步应用
试纸条检测免疫兔血清中的抗体水平,基因工程苗免疫后0、3 d 5只均阴性,7 d 2只弱阳性、3只阴性,14 d 1只弱阳性、3只阳性、1只强阳性,21 d 4只强阳性、1只阳性;组织灭活苗免疫后0、3、7 d 5只均阴性,14 d 4只弱阳性、1只阴性,21 d 4只弱阳性、1只阳性;PBS免疫后至21 d均未检测到抗体。
3 讨 论
3.1兔病毒性出血症感染率、死亡率高,给养殖业造成巨大的经济损失。目前主要通过接种疫苗来控制与预防该病。因此,能快速、准确检测疫苗免疫后抗体水平的方法显得尤为重要。检测方法主要有血凝抑制试验和ELISA方法[2,11],但这些方法耗时长,操作繁琐。本试验研制的胶体金试纸条,加样后10 min得到结果,根据显色情况就能判定血清中抗体水平。兔出血症病毒抗体为阳性或强阳性的兔,能抵抗RHDV强毒攻击,弱阳性兔部分抵抗RHDV强毒攻击,阴性兔不能抵抗RHDV强毒攻击[4],因此,试纸条检测结果为阳性或强阳性时,说明兔不需加强免疫;试纸条检测结果为弱阳性或阴性时,需加强免疫。
3.2为防止试纸条检测不稀释的强阳性血清时,金标VP60被血清中过量的特异性抗体结合,导致没有多余未标记的金标VP60和C线上的蛋白反应,出现C线条带极淡或没有的现象,制备试纸条时,C线包被的单抗与VP60的结合应不被多抗阻断,即VP60与多抗结合后仍能结合单抗。因此在选择单抗时,我们用阻断ELISA方法[3],以VP60包被ELISA板,用兔抗VP60多抗阻断单抗与VP60反应,同时间接ELISA方法[11]检测单抗效价。结果显示,实验室制备的4株单抗均未被阻断,可用于包被C线,但A3C效价较高,因此选择A3C作为质控线包被蛋白。
3.3在临床使用试纸条时,检测全血会比检测血清更加便捷。普通样品垫不能拦截红细胞,会导致NC膜红色背景,影响结果判断。本研究使用滤血垫作为样品垫,可以有效地拦截红细胞。全血中约含50%的血清[16],因此检测全血样品时,需用生理盐水50倍稀释后再检测。
4 结 论
成功建立检测兔出血症病毒抗体的胶体金试纸条,可通过试纸条显色结果判定血清中抗体水平,可用于兔病毒性出血症的流行病学调查和抗体水平监测。
参考文献(References):
[1]ABRANTES J, VAN DER LOO W, LE PENDU J, et al. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV): a review[J].VetRes, 2012, 43: 12.
[2]FITZNER A, NIEDBALSKI W. Serological survey for RHD antibodies in rabbits from two types of rabbit breeding farms[J].PolJVetSci, 2016, 19(3): 597-607.
[3]CAPUCCI L, SCICLUNA M T, LAVAZZA A. Diagnosis of viral haemorrhagic disease of rabbits and the European brown hare syndrome[J].RevSciTech, 1991, 10(2): 347-370.
[4]薛家宾, 杨龙圣, 徐为中, 等. 免疫日龄对兔病毒性出血症抗体水平和保护率的影响[J]. 江苏农业科学, 2006, 34(6): 327-329.
XUE J B, YANG L S, XU W Z, et al. Effects of immunization age on antibody level and protective rate of RHD (rabbit hemorrhagic disease)[J].JiangsuAgriculturalSciences, 2006, 34(6): 327-329. (in Chinese)
[5]蔡少平, 王芳, 贾华敏, 等. 兔出血症病毒胶体金免疫层析试纸条诊断方法的建立及初步应用[J]. 畜牧兽医学报, 2012, 43(11): 1795-1801.
CAI S P, WANG F, JIA H M, et al. Development and primary application of an immunochromatographic colloidal gold test strip for rabbit hemorrhagic disease virus[J].ActaVeterinariaetZootechnicaSinica, 2012, 43(11): 1795-1801. (in Chinese)
[6]JU Y, HAO H J, XIONG G H, et al. Development of colloidal gold-based immunochromatographic assay for rapid detection ofStreptococcussuisserotype 2[J].VetImmunolImmunopathol, 2010, 133(2-4): 207-211.
[7]XU R, FENG J T, HONG Y, et al. A novel colloidal gold immunochromatography assay strip for the diagnosis of schistosomiasis japonica in domestic animals[J].InfectDisPoverty, 2017, 6: 84.
[8]彭伏虎. 禽流感与新城疫胶体金免疫层析快速检测技术及初步应用研究[D]. 武汉: 华中农业大学, 2008.
PENG F H. Studies on development and preliminary application of the colloidal gold immunochromatographic rapid detecting technology for avian influenza and new castle disease viruses[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
[9]王芳, 胡波, 任雪枫, 等. 兔出血症病毒衣壳蛋白在昆虫细胞中的表达及对家兔的免疫保护效果[J]. 畜牧兽医学报, 2008, 39(10): 1382-1387.
WANG F, HU B, REN X F, et al. Expression of the capsid protein of rabbit haemorrhagic disease virus in insect cells and its protective efficacy to rabbits[J].ActaVeterinariaetZootechnicaSinica, 2008, 39(10): 1382-1387. (in Chinese)
[10]WANG X, XU F T, LIU J S, et al. Atomic model of rabbit hemorrhagic disease virus by cryo-electron microscopy and crystallography[J].PLoSPathog, 2013, 9(1): e1003132.
[11]李超美, 王芳, 蔡少平, 等. 检测兔出血症病毒抗体间接ELISA方法的建立[J]. 江苏农业学报, 2010, 26(3): 546-550.
LI C M, WANG F, CAI S P, et al. An indirect ELISA for detection of antibodies against rabbit hemorrhagic disease virus[J].JiangsuJournalofAgriculturalSciences, 2010, 26(3): 546-550. (in Chinese)
[12]李迪, 曹永生, 徐晶晶, 等. 金黄色葡萄球菌蛋白AB结构域的基因优化与原核表达及其亲和性鉴定[J]. 中国兽医科学, 2013, 43(3): 277-282.
LI D, CAO Y S, XU J J, et al. Codon optimization, prokaryotic expression and affinity determination of B domain of staphylococcal protein A[J].ChineseVeterinaryScience, 2013, 43(3): 277-282. (in Chinese)
[14]DHANASOORAJ D, KUMAR R A, MUNDAYOOR S. Subunit protein vaccine delivery system for tuberculosis based on hepatitis B virus core VLP (HBc-VLP) particles[M]//THOMAS S. Vaccine Design: Methods and Protocols, Volume 2: Vaccines for Veterinary Diseases. New York, NY: Humana Press, 2016: 377-392.
[15]MATSUDA S, NEROME R, MAEGAWA K, et al. Development of a Japanese encephalitis virus-like particle vaccine in silkworms using codon-optimised prM and envelope genes[J].Heliyon, 2017, 3(4): e00286.
[16]谷子林, 秦应和, 任克良. 中国养兔学[M]. 北京: 中国农业出版社, 2013: 58.
GU Z L, QIN Y H, REN K L. China rabbit science[M]. Beijing: China Agriculture Press, 2013: 58. (in Chinese)

