壳聚糖/纳米TiO2复合涂膜抗菌及物理性能分析
邢亚阁,刘 茜,江雨若,郭训练,岳文婷,许青莲,苟 俊(.西华大学食品与生物工程学院,四川 成都 6009; .西华大学西华学院,四川 成都 6009;. 阿坝州农业畜牧局农产品质量安全中心,四川 阿坝藏族羌族自治州 64000)
壳聚糖(chitosan,CTS)属直链型多糖,是甲壳素的脱乙酰产物。它在自然界资源丰富,无毒无害、可食用、安全可靠,具有良好的成膜性[1-2]。壳聚糖可以形成半透膜覆于物体表面,这种膜具有通透性,对各种气体分子的通透性不同,形成了微气调环境,从而抑制了呼吸强度[3-4]。壳聚糖具有抑菌效果,涂膜后使果蔬表皮处于一个微酸环境,微酸环境具有较强的抗菌抑菌效果,能有效地阻挠病毒的入侵并抑制病菌的生长[5]。近年来,壳聚糖作为一种天然保鲜剂被广泛地应用于果蔬贮藏保鲜上,但是纯壳聚糖膜抗菌性能较差,极大地限制了其进一步应用。将纳米材料作为抗菌剂添加于壳聚糖涂膜载体上已成为国内外的研究热点[6-8]。
纳米TiO2是目前应用非常广泛的一种新型无菌抗菌剂,具有光催化杀菌能力,可抑制甚至杀灭贮藏过程中的细菌和微生物,可以降低乙烯的浓度,延长果蔬的贮藏时间[9-10]。但TiO2纳米粒子粒径小、比表面大、表面能高,在壳聚糖溶液中容易发生团聚,故通常采用表面活性剂对纳米TiO2颗粒表面进行改性[11],以提高其分散性。朱燕峰等[12]实验表明,纯TiO2膜与改性纳米TiO2相比,后者具有更好的耐蚀性和保护性能。谢淑慧等[13]和赖特明等[14]使用壳聚糖/纳米TiO2对砂糖桔和赣南脐橙进行涂膜保鲜,这种涂膜处理有效降低了砂糖桔和赣南脐橙的失重率和腐烂率,提高了它们的总糖、总酸及Vc含量,并且能够对指状青霉、桔青霉、黑曲霉等真菌产生抑制作用。
本文以壳聚糖材料为载体,制备壳聚糖/纳米TiO2复合保鲜膜材料,以纳米TiO2粒径、超声时间、超声功率、吐温80添加量等几个因素作为变量,考察不同变量条件下制得的复合膜对金黄色葡萄球菌生长的影响;对复合膜抗菌性能影响突出的纳米TiO2粒径这一变量单独考察,对TiO2(粒径30 nm)不同添加量制得的复合膜材料进行微观形态观察而热失重分析,为进一步研究和开发适合果蔬保鲜的抗菌材料提供参考。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度85.61%),济南海得贝海洋生物工程有限公司;纳米TiO2(99%),北京德科岛金科技有限公司;月桂酸钠,大连美仑生物技术有限公司;吐温-80,郑州市富泰程化工产品有限公司;冰醋酸,分析纯,成都市科隆化学品有限公司;丙三醇,分析纯,成都市科隆化学品有限公司;金黄色葡萄球菌,由西华大学果蔬贮藏与保鲜实验室提供。
1.2 仪器与设备
KQ-100DE型数控超声波清洗器,昆山市超声仪器有限公司; SH-3加热磁力搅拌器;BPG-9070A型精密鼓风干燥箱,上海一恒科学仪器有限公司;SpectraMax i3x型多功能酶标仪,美谷分子仪器(上海)有限公司; STA449F3型同步热分析仪(DSC/DTA-TG),德国Netzsch公司;冷场发射扫描电子显微镜(JSM-7500F),日本电子株式会社(JEOL)。
1.3 试验方法
1.3.1纯壳聚糖膜制备
将1.0 g甘油加入100 mL 1%(V/V)的冰醋酸溶液中,搅拌均匀,缓慢加入1 g壳聚糖,加热磁力搅拌20 min使壳聚糖完全溶解,得到纯壳聚糖溶液,将壳聚糖溶液定量在平板上流延成膜,置于(25±1)℃恒温干燥箱中约48 h,揭膜,干燥器中保存,备用。
1.3.2纳米TiO2的改性
纳米TiO2的改性参照刘瑞麟等[15]的方法,稍作改动。称取5.0 g纳米TiO2缓慢加入70 mL去离子水中,用1 mol/L HCl或1 mol/L NaOH调节pH值至5.0,然后加入0.75 g 月桂酸钠。在40 ℃加热磁力搅拌器上低速搅拌30 min,随后在4 000 r/min速率下,用去离子水离心洗涤3次(每次15 min),弃去上清液,在(105±1) ℃干燥箱中干燥24 h,得到白色改性纳米粉体,研磨成粉末,干燥器中保存,备用。
1.3.3不同条件复合膜的制备
依据表1所示的变量条件进行复合膜的制备。将0.03 g一定粒径的改性纳米TiO2溶入1.0 g甘油中,再加入100 mL 1%(V/V)的冰醋酸溶液,搅拌均匀,并缓慢加入壳聚糖1.0 g,加热磁力搅拌20 min使壳聚糖完全溶解,静置,再加入一定量的吐温80,固定功率下超声消泡一定时间,至纳米TiO2粉体均匀分散、脱泡后得到复合膜溶液。将复合膜溶液定量在平板上流延成膜,于(25±1) ℃恒温干燥箱中约48 h,揭膜,干燥器中保存,备用。

表1 不同变量及相应处理组
注:表中标记数据为考察某一变量时,其他变量的固定值。
由表1可知,当超声时间为50 min、超声功率为50 W、吐温添加量为0.5% 时,纳米TiO2的粒径为 10、30、50 nm; 当超声功率为50 W、吐温添加量为0.5% 、纳米TiO2的粒径为30 nm,超声时间取值为 40、50、60 min;当超声时间为 50 min、吐温添加量为0.5% 、纳米TiO2的粒径为30 nm,超声功率的取值为 40、50、70 W;当超声时间为50 min、超声功率为 50 W、纳米TiO2的粒径为30 nm时,吐温80添加量为0.1%、0.3%、0.5%。以未超声改性处理的膜做空白对照组。
1.3.4壳聚糖/纳米TiO2复合膜抗菌性能的测定[16]
1.3.4.1试验菌液的制备
将冻干菌融化分散在5 mL的营养肉汤中成悬浮状,在37 ℃下培养18~24 h。用接种环蘸取菌悬液以划线法接种到琼脂营养平皿上,在37 ℃下培养18~24 h。从培养皿上取典型菌落接种在琼脂营养斜面试管上,在37 ℃下培养18~24 h。将斜面试管贮藏于冰箱内5~10 ℃作为保存菌,保存期不超过1个月,每月传代1次,传代次数不超过10代。
1)用接种环取保存菌,以划线法接种到营养琼脂培养基平皿上,37 ℃培养24 h(注:该平皿在5~10 ℃条件下保存,在一周内使用)。
2)取营养肉汤20 mL放入100 mL的三角烧瓶内,用接种环取上述平皿上的典型菌落接种在肉汤(NB)内培养。培养条件为:37 ℃,120 r/min的摇床内培养18~24 h。
3)用蒸馏水20倍稀释营养肉汤,用其调节培养后的菌浓度为1×107~1×108CFU/mL,将其作为试验菌液。采用血球计数法测定菌液浓度。
1.3.4.2抑菌率的测定
取样品膜(80 mm×100 mm)加入含有99 mL营养肉汤和1 mL培养24 h后菌液浓度接近106~107CFU/mL的菌悬液的锥形瓶中,用空白膜和无膜作为对照组和阴性对照。锥形瓶内培养物在120 r/min、37 ℃下培养12 h。利用96孔板测不同组分的吸光度值,每组3个平行。利用酶标仪在570 nm下测金黄色葡萄球菌的吸光度值。每隔1 h测1次,一共测10组数据。

式中,Ai和At分别表示对照组的吸光度值和样品组的吸光度值。菌液的吸光度值(ODnm)的大小可评价膜抗菌性能的相对强弱。样品膜抗菌性能的强弱与菌液吸光度值成反比。
1.3.5扫描电镜(SEM)分析
采用SEM观察壳聚糖/纳米TiO2的复合膜的表观形态及纳米粒子分散情况。将样品膜干燥,取适当大小样品膜,用导电双面胶带固定于不锈钢载物台上,溅射喷金,用SEM在10kV条件下观察膜的微观特征并拍照。
1.3.6热重(TG)分析
采用NETZSCH STA 449F3 STA449F3A-1054-M型分析仪测定膜的热稳定性能,样品质量为8~13 mg,以N2作为载气,流速是20 mL/min,测试温度范围20~800 ℃,升温速率10 ℃/min,记录得到的TG曲线。
2 结果与讨论
2.1 不同粒径纳米TiO2对抗菌性能的影响
不同粒径纳米TiO2材料对壳聚糖复合涂膜抗金黄色葡萄菌性能的影响如图1。

图1 纳米TiO2粒径对复合膜抗菌性能的影响
由图可知,纳米TiO2粒径为10 nm和30 nm的组分其吸光度值一直低于对照组,而粒径为50 nm的组分吸光度值一直较高于对照组。当纳米TiO2粒径为30 nm时,其菌液吸光度值从第2 h时后一直是最低,即金黄色葡萄球菌的数量最少,抑菌效果最好,纳米TiO2粒径为10 nm其次。壳聚糖-纳米TiO2复合涂膜的抗菌性能可能归因于壳聚糖本身的抗菌性能和TiO2纳米效应[17~19]。纳米TiO2在光照射条件下可能会表现出更强的抗菌性能,这是因为在光诱导条件下可能会产生氧化性很强的活性自由基,并进一步氧化一些微生物体内的蛋白质,抑制微生物的生长甚至杀死微生物[17]。光诱导和不同纳米TiO2添加量等因素对复合涂膜抗菌性能的影响需要进一步研究。结合吸光度值,选用粒径为30 nm的纳米TiO2为宜。
2.2 超声时间及功率对抗菌性能的影响
壳聚糖和纳米TiO2难溶于水,超声波处理能有效地促进壳聚糖和纳米TiO2在溶液中的溶解与分散。由图2中可知,相比于超声40 min和超声60 min,当超声时间为50 min时,其吸光度一直低于对照组,其金黄色葡萄球菌的数量更少,抑菌效果更好。超声时间太短(20、30 min)时,对复合膜的抗菌性能影响不明显,所以图2中未展示。超声时间过短,壳聚糖和纳米TiO2在溶液中不能溶解与均匀分散,不能形成很好的包埋体系,而超声时间过长,又会导致壳聚糖的取代度较低,降低其抗菌效果;因此,适宜的超声波处理时间为50 min[18]。

图2 超声时间对复合膜抗菌性能的影响
由图3可知,在第3 h后,样品组菌液的吸光度皆低于对照组。超声功率为50 W时,菌液的吸光度最小,即金黄色葡萄球菌的数量最少,其抑菌效果最好。超声波的空化作用可以实现介观均匀混合,消除局部浓度的不均匀,提高反应速率,促进新相的形成,并对纳米TiO2团聚体起到剪切破碎的作用,使其更好地发挥抗菌作用。
2.3 乳化剂吐温80的添加量对抗菌性能的影响
由图4知,吐温80的添加量为0.5%时,菌液的吸光度最小,即金黄色葡萄球菌的数量最少,表明吐温80的添加量在此浓度时的抑菌效果最好。吐温80作为表面活性剂添加在复合膜中,在浓度较低的时候能显著地降低溶液表面张力,增加壳聚糖复合膜溶液在果蔬表面的黏附力,使复合涂膜剂在果蔬表面直接成膜更加容易,使壳聚糖和纳米TiO2更好地发挥其抑菌作用,从而达到改善其保鲜效果的目的。
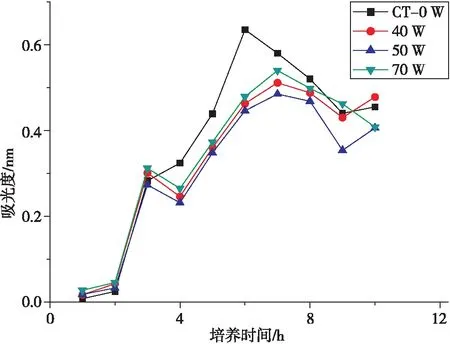
图3 超声功率对复合膜抗菌性能的影响
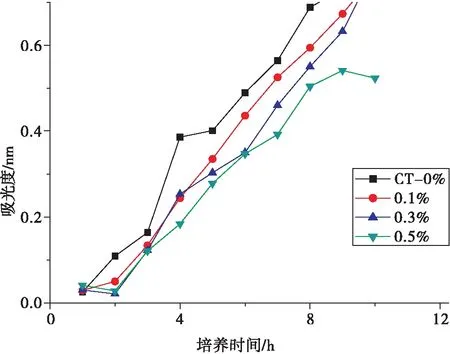
图4 吐温80添加量对复合膜抗菌性能的影响
2.4 不同条件下的抗菌率
比较表2抗菌率的大小,可以评价试样膜的抗菌性能的强弱。结果表明:纳米TiO2粒径为30 nm时的抗菌率为最大(38.52%),并且比纯膜抗菌率高出了30.05%;其次是吐温80添加量为0.5%时,复合涂膜的抗菌率37.89%;当超声时间为50 min时,抗菌率仅为24.70%;当采用的超声处理功率为50 W时,膜的抗菌率最小,为10.77%。结果表明不同条件下复合膜的抗菌率皆高于纯壳聚糖膜的抗菌率(7.77%),说明与纯壳聚糖相比在不同条件下制备的复合膜其抗菌性能均能显著提高。

表2 不同条件下最佳水平在培养金黄色葡萄球菌10 h后的抗菌率
2.5 SEM分析
通过考察不同变量对复合膜抗菌性能的影响可以看出,纳米材料的粒径对金黄色葡萄球菌的抑制效果比较明显,其中,粒径为30 nm时,复合抗菌性能较好。因此,采用粒径为30 nm的纳米TiO2,分析其不同添加量对复合膜的微观形态的影响。图5是纯壳聚糖膜和复合膜放大100倍的SEM照片。图中隆起的小点是包埋在壳聚糖中的纳米TiO2,因其分散在膜的内部而不是覆盖在膜的表面,所以SEM照片中纳米TiO2粒子不是特别清晰。添加纳米TiO2复合膜的SEM(图5)显示,纳米TiO2与壳聚糖溶液有较好的相容性。由图5可以看出,随着纳米TiO2含量的增加,复合膜的表面出现越来越多的团聚的细小晶粒;但是较好的包埋在壳聚糖中,整体表现出良好的分散性,但存在少许团聚现象。

图5 纯壳聚糖膜、不同含量纳米TiO2复合膜的SEM图
2.6 热重分析
热重(thermogravimetric,TG)分析是评估材料热稳定性的一个重要的方法[19]。图6为纯壳聚糖膜和不同TiO2含量的壳聚糖复合膜在升温速率10℃·min-1的热失重曲线图。由图6可知,膜的热分解过程大致可分成3个阶段。第1个阶段从22~135 ℃,各种膜都呈现少量的质量损失(失重不超过10%),主要是由于膜中残留的乙酸和水分等小分子蒸发引起的,此阶段壳聚糖的内部分子结构不会受影响。第2个阶段是热分解的主要阶段,纯壳聚糖膜在145~345 ℃大量分解,壳聚糖/TiO2复合膜在165~385 ℃大量分解;在添加纳米TiO2后,质量损失明显降低,且复合膜的残留率随着纳米TiO2含量的增加而提高(TiO2含量为0.05 g的复合膜残留率优于其他复合膜)。最后一个阶段是500~800 ℃,随着温度的升高,各种膜质量损失缓慢,最终主要以炭化残渣的形式存在。
由以上分析可以看出,壳聚糖/TiO2复合膜的热稳定性能优于纯壳聚糖膜,这是因为加入纳米TiO2,生成Ti-O键,增强壳聚糖分子间的作用[20],使物质的稳定性变高。复合膜的残留率并不是随着纳米TiO2添加量的增加而提高(纳米TiO2添加量为0.05 g的复合膜的热稳定性优于其他复合膜),可能是因为过量的纳米 TiO2形成的团聚物破坏了复合膜结构的致密性;因此,适量的纳米TiO2有利于提高复合膜的热稳定性。

图6 壳聚糖/纳米TiO2复合膜的TG曲线图
(CK:纯壳聚糖膜;CTS-1~CTS-5分别为纳米TiO2添加量为0.01、0.03、0.05、0.07、0.09 g的壳聚糖/纳米TiO2复合膜。)
3 讨论
纳米TiO2因其高活性、高化学稳定性、生物相容性和廉价的商业可用性而被认为是最有前途的材料[16~19]。纳米材料与同样容积的大颗粒相比拥有多种效应:表面效应、量子尺寸效应、体积效应、宏观量子隧道效应、界面相关效应[19]。本研究将纳米TiO2添加与壳聚糖载体中制备成复合涂膜材料,结果表明,纳米TiO2粒径为30 nm时复合涂膜对金黄色葡萄球菌的抑菌效果最好,其抗菌率为38.52%;吐温80的添加量越高,对金黄色葡萄球菌的抑菌效果越好;当超声时间为50 min和超声功率为50 w时对金黄色葡萄球菌有较好抑菌效果。锐钛矿型纳米TiO2可能在光催化条件下能够表现更强的抗菌活性,光诱导复合涂膜的抗菌性需进一步研究。另外,本文仅研究了不同添加量的纳米TiO2的外观形态和热稳定性,结果表明,纳米材料能够较好的包埋在壳聚糖中,整体表现出良好的分散性,虽然存在少数小的团聚。并且,纳米TiO2的加入能够提高壳聚糖复合涂膜的热稳定性。纳米TiO2的添加量、形状等因素势必为影响壳聚糖复合涂膜的结构和抗菌性能,需进一步研究[16~22]。另外,壳聚糖-纳米TiO2吸附耦合结构对微生物细胞协同抗菌作用关系的了解非常有限,光诱导下的壳聚糖/纳米TiO2的抗菌机制尚不清楚,对此方面深入系统的探讨将是一个具有突破性的研究方向。
[1]DODANE V, VILIVALAM V D.Pharmaceutical applications of chitosan [J].Pharmaceutical Science & Technology Today,1998,1(6):246.
[2]郭仕华,贺艳丽.壳聚糖在医药领域中的应用[J].食品与药品,2005,7(8A):1.
[3]GHAOUTH AEI, PONNAMPALAM R, CASTAIGNE F ,et al.Chitosan coating to extent storagelife of tomatoes[J].Hort Science,1992,27(9):1016.
[4]陶希芹,王明力,谯顺彬.壳聚糖/纳米TiO2复合膜的抗菌性能研究[J].广州化工,2015(13):85.
[5]杨远谊.壳聚糖/纳米二氧化钛抗菌保鲜膜的研制及性能研究[D].重庆:西南大学,2008.
[6]刘晓菲,程春生,覃宇悦,等.壳聚糖/纳米蒙脱土复合涂膜对枇杷保鲜的研究[J].食品研究与开发,2011,32(4):168.
[7]徐云龙,肖宏,钱秀珍,等.壳聚糖/蒙脱土纳米复合材料的结构与性能研究[J].功能高分子学报,2005,18(3):383.
[8]DINESH K S,ALOK R R.Biomedical applications of chitin.chitosan,and their derivatives[J].Journal of Mcaromolecular Science, Part C,2000,40(1):69.
[9]叶盛英,刘诗乐,贺明书,等.纳米二氧化钛闪照强光光催化杀菌与保鲜技术初探[J].农业工程学报,2003,19(4):180.
[10]崔晓莉,江志裕.纳米二氧化钛薄膜的制备及特性研究[J].电镀与涂饰,2002,21(5):17.
[11]董战峰,杜予民,樊李红,等.壳聚糖/明胶/TiO2三元复合膜的制备与功能特性[J].功能高分子学报,2004,17(1):61.
[12]朱燕峰,张娟,张义永,等.溶胶-凝胶法制备改性TiO2纳米薄膜及其防腐蚀性能[J].物理化学学报,2012,28(2):393.
[13]解淑惠,邵兴峰,王鸿飞,等.纳米保鲜包装对柑橘果实贮藏品质的影响[J].食品工业科技,2014(1):326.
[14]赖特明,杨文侠,钟八莲,等.新型纳米涂膜用于赣南脐橙保鲜的研究[J].食品科技,2014(2):47.
[15]刘瑞麟,徐淑艳,方海峰,等.Ag+/纳米TiO2/壳聚糖复合膜制备及其对桑葚的保鲜效果[J].食品工业科技,2015,36(9):331.
[16]XING Y,LI X,ZHANG L, et al.Effect of TiO2nanoparticles on the antibacterial and physical properties of polyethylene-based film[J].Progress in Organic Coatings,2012,73(2/3):219.
[17]张文林,席万鹏,赵希娟,等.纳米技术在果蔬产品中的应用及其安全风险[J].园艺学报,2013,40(10):2067.
[18]欧秀娟,杜海燕.纳米TiO2粉体的分散性研究[J].硅酸盐通报,2006,25(2):74.
[19]苗琦,曹水兵,张石群,等.纳米材料的抗真菌活性及其机制研究进展[J].中国真菌学杂志,2012,7(2):111.
[20]陈红,李彩云,李侠,等.壳聚糖/微晶甾醇可食性复合膜的制备、性能及结构表征[J].食品科学,2017,38(9):91.
[21]张显策,张顺花,李慧艳,等.壳聚糖/纳米TiO2复合膜的制备及其性能分析[J].浙江理工大学学报,2007,24(6):621.
[22]MANEERAT C,HAYAT Y. Antifungal activity of TiO2photocatalysis againstpenicilliumexpansumin vitro and in fruit tests[J]. International Journal of Food Microbiology, 2006,107:99.

