施磷与接种耐酸根瘤菌对酸性黄壤中紫花苜蓿生长、结瘤的影响
王晓锋 ,张 磊 ,袁兴中
(1.重庆师范大学 地理与旅游学院,重庆 400047;2.长江上游湿地科学研究中心,重庆 400047;3.西南大学 资源环境学院,重庆 400716;4.重庆大学 资源及环境科学学院,重庆 400030)
由于人类活动影响,近年来土壤酸化问题不断加剧[1]。我国受大面积施肥、酸雨和氮沉降等影响,土壤酸化问题严重,导致土壤肥力和生产力退化[2]。据统计我国酸性土壤面积达到203万平方千米,占我国国土面积21%,且90%以上酸性土壤分布在长江流域及其以南地区[2]。三峡库区位于长江流域中上游,分布着大面积酸性黄壤(仅重庆市pH<6.5的土壤面积就达到3.86万平方千米,占重庆市国土面积的46.8%①http://www.cqates.com/cqsoil/),加之库区生态环境整体较为脆弱,酸性土壤恢复与治理对三峡库区生态恢复意义重大。紫花苜蓿(Medicago sativa L.,俗称alfalfa)是一种在欧亚大陆和世界各国广泛种植的优良豆科绿肥,其根系发达,适应性强,与根瘤菌共生后具有极强的固氮能力[3],因此被应用于多种退化土壤的培肥和修复。随着我国西部开发战略和土壤保护发展需要,紫花苜蓿被列入我国“北草南引”的重大战略名录。然而,酸性土壤下紫花苜蓿的生长、结瘤受到极大限制[4],成为南方酸性土壤中种植紫花苜蓿修复土壤的重要阻碍。提高紫花苜蓿在酸性土壤中的适应性和结瘤固氮能力对解决这一限制至关重要。
研究表明,酸性环境能够影响根瘤菌繁殖[5]、宿主根毛伸长[6]、根瘤菌与宿主植物间的信号识别过程[7]以及豆科植物-根瘤菌体系固氮酶活性和固氮能力[8]等,进而不利于豆科作物的生长。为提高酸性土壤中豆科植物-根瘤菌共生体系的固氮能力,研究者进行了大量的探索。接种耐酸根瘤菌被认为是提高豆科植物在酸性条件下生长和固氮的有效途径[9-11]。在三叶草根瘤菌的研究中,Chen等[11]通过接种耐酸根瘤菌ANU1173使得宿主在pH值为4.4条件下结瘤并有效固氮。研究表明,接种从酸性土壤中分离到的一些中等耐酸的苜蓿根瘤菌可使紫花苜蓿在pH值为5.6下高效固氮[12]。同时,根瘤菌与宿主的结瘤共生过程被认为必须有磷素的参与[13-14],甚至有研究表明磷素能够直接参与共生过程中的信号物质的生成和传递[15]。进一步研究表明,施磷与接种根瘤菌能够有效提高豆科植物-根瘤菌结瘤共生[15]。紫花苜蓿对酸性极为敏感,因此通常被作为豆科植物-根瘤菌酸性环境适应性研究的模式植物。
近年来,研究者在施磷与接种根瘤菌对紫花苜蓿的影响方面开展了一些研究[16-17],且认为施磷与接种根瘤菌能够显著提高黄河三角洲紫花苜蓿的产量和品质[17],并能提高紫花苜蓿结瘤率、根瘤重等[16]。然而,酸性土壤条件下,施磷与接种耐酸根瘤菌对紫花苜蓿生长、结瘤以及固氮的影响的研究较少。本研究组保藏了多株高效耐酸紫花苜蓿根瘤菌,能够在pH值为4.6~5.0条件下繁殖并侵染宿主[18]。本文通过室内培养试验研究接种耐酸根瘤菌和施磷对紫花苜蓿在酸性土壤中结瘤固氮的改善效果,以期为酸化土壤的修复提供科学参考。
1 材料方法
1.1 试验材料
供试菌株为苜蓿根瘤菌91522,由西南大学资源环境学院微生物研究室提供,通过16 s RNA鉴定为中华苜蓿根瘤菌属,该菌株能够在pH值为4.8的YMA固体培养基上生长繁殖,并能与紫花苜蓿在pH值为4.5的条件下高效结瘤[18]。根瘤菌培养基采用改进的YMA培养基:甘露醇10 g,酵母浸出粉5 g,氯化钠(NaCl)0.1 g,七水硫酸镁(Mg⁃SO4· 7H2O)0.2 g,磷酸氢二钾(K2HPO4)0.5 g[19]。
供试植物为三得利紫花苜蓿(Medicago sativaL.cv.Sanditi),购自江苏省连云港草业中心(发芽率:85.4%)。紫花苜蓿种子经过0.1%的氯化汞溶液和95%乙醇表面消毒10 min,于28℃暗室-光照交替催芽2~3 d备用。
供试土壤采自重庆市北碚区缙云山农田区的酸性冷沙黄泥土,pH<4.8,种植前茬作物为马铃薯与玉米。供试土壤基本理化性质如表1所示:

表1 供试土壤化学性质Table 1 Chemical properties of the experimental soil
1.2 试验设计及分析方法
试验设置接种耐酸根瘤菌和施磷2个因子。接种处理分为(1)不接种;(2)接种耐酸根瘤菌(1 kg土壤接种OD600=1.0的菌液1 mL)。施磷处理以不同浓度磷酸氢二钠(Na2HPO4)溶液为磷源,分为(1)不施磷;(2)施加4µmol/kg;(3)施加30µmol/kg。共形成6个处理组,各处理组缩写见表2,每个处理3个重复。试验于2012年4月至6月在西南大学温室内进行。
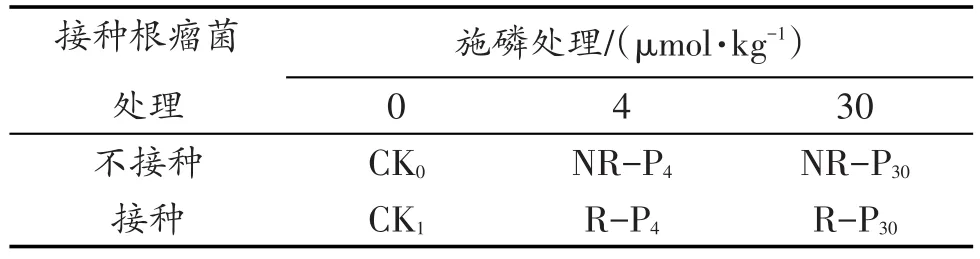
表2 接种与施磷试验处理Table 2 Rhizobium and phosphate fertilizer treatments
试验用塑料盆每盆盛土2 kg,均匀散播经催芽的紫花苜蓿种子40粒,表面覆少量湿土,将培养好的OD600=1.0的菌液2 mL用无菌水稀释后均匀浇灌于每盆中,用牛皮纸盖上,保持湿度,待发芽后打开牛皮纸,开始光照/黑暗=16 h/8 h的培养。苜蓿幼苗长出2~3片子叶时(2周),进行施磷处理。施磷处理的方法为,每天用浓度为0µmol/L,4µmol/L,30µmol/L的Na2HPO4溶液进行浇灌一次,每次200 mL,累计处理2 000 mL后停止(10 d),之后用自来水进行日常灌溉管理,保持土壤含水量为田间持水量的40%~50%。从散入苜蓿种子起,培养100 d后收获,宿主植物地上部与地下部分开收获,测定生物量、全氮含量和其他农艺性状。
随机取15~20株苜蓿根清洗干净,将结瘤的根系分别剪开,统计肉眼可见的结瘤数、根瘤重。采用氯化三苯基四氮唑(TTC)法测定植物根系活力[20];主根上的瘤子可用剥皮法取下,侧根瘤要带少量根剪断,总计取饱满根瘤2 g于150 mL血清瓶中,盖上胶塞,立即向血清瓶中注入15 mL乙炔(C2H2),28℃培养1 h后利用气相色谱测定瓶中乙烯(C2H4)产生量,并用根瘤还原C2H2为乙烯的量表征固氮酶活性[21]。植株全氮含量采用半微量凯氏定氮法测定;在收获植物后,取植物根周土壤,利用稀释平板计数法测定各处理土壤中根瘤菌数量。
1.3 数据处理
原始数据在Excel中进行标准化处理,应用SPSS18.0软件对试验数据进行方差分析,在0.05水平下进行LSD多重比较检验。
公司采购处理速度快的计算机设备(每台设备8千元),机器设备估计使用寿命6年,办公设备及装潢使用寿命为5年,期末无残值,按直线折旧法计算。
2 结果分析
2.1 施磷与接种耐酸根瘤菌对紫花苜蓿生长的影响
表3所示,接种耐酸根瘤菌能够提高酸性土壤中紫花苜蓿鲜重,且地下部鲜重显著提高(P<0.05)。与对照组(CK0)相比,施磷能够显著增加紫花苜蓿生物量,但低磷(NR-P4)与高磷(NR-P30)处理相比差异不具有统计学意义(P>0.05)。接种耐酸根瘤菌时,高磷处理下(R-P30)紫花苜蓿生物量显著高于低磷处理(R-P4),可见接种耐酸根瘤菌能够有效促进紫花苜蓿对磷的利用。接种耐酸根瘤菌同时施用高磷(R-P30)的条件下紫花苜蓿在酸性土壤中生物量最高。
紫花苜蓿在酸性土壤中长势主要受到磷肥施用的影响(表3)。仅接种根瘤菌对紫花苜蓿株高和根长的影响均不显著。而仅施磷肥能够显著提高苜蓿的株高和根长,尤其在高磷条件下,苜蓿株高和根长比对照组分别增加了117%和58%。施磷与接种根瘤菌对紫花苜蓿株高、根长的交互作用不显著,但高磷和接种根瘤菌处理下株高、根长均最大。
紫花苜蓿全氮含量与其氮吸收能力和根瘤固氮密切相关。本研究中,接种耐酸根瘤菌(CK1)后苜蓿地上和地下部全氮含量分别提高了42%和70%,提升效果显著,与不接种耐酸根瘤菌(CK0)相比差异具有统计学意义(P<0.01)。磷素的补充对植物全氮含量也具有一定的增加效果,但并不显著,可能是施磷促进了植物根系生长,进而增加了对氮素的吸收。高磷与低磷处理植物氮含量间差异不具有统计学意义(P>0.05)。在同时进行高磷和接种耐酸根瘤菌处理下(R-P30),植物全氮含量最高,与CK0相比,苜蓿地上与地下部氮含量分别提高了71%和105%,总固氮量提高了3.8倍。由此可见,在酸性土壤中,高磷与接种耐酸根瘤菌处理对紫花苜蓿生长、固氮具有极显著的改善效果,可作为酸性土壤改良的重要手段。

表3 施磷与接种耐酸根瘤菌对酸性土壤中紫花苜蓿生长的影响Table 3 Effects on growth of alfalfa in acid soil by phosphorus fertilization and acid-tolerant rhizobium inoculation
2.2 施磷与接种耐酸根瘤菌对紫花苜蓿根系活力及根周土壤根瘤菌数量的影响
根系活力是在逆行环境中植物根系吸收营养以及与根周微生物相互作用的重要保障。对豆科植物而言,植物根系活力和根周土壤中根瘤菌数量属二者正常结瘤共生的重要因子。图1显示为不同处理下,紫花苜蓿根系活力和根周土壤中根瘤菌数量的比较。

图1 紫花苜蓿根系活力与根周土壤根瘤菌数量Fig.1 The root vigor of alfalfa and the rhizobia number in the root soil under different treatments
图1(a)显示,低磷对酸性土壤苜蓿根系活力的影响不显著,但高磷条件下,苜蓿根系活力较CK0提高了77%。在相同施磷条件下接种耐酸根瘤菌处理下,紫花苜蓿根系活力均高于不接种处理,比相应单施磷处理高出50%~80%;高磷处理下接种耐酸根瘤菌能够显著提高苜蓿根系活力,显著高于其他处理。
根周土壤中根瘤菌数量是苜蓿结瘤的前提[5]。本研究结果显示,在自然酸性黄壤中,存在少量土著根瘤菌,且随施磷量增加,土著根瘤菌数量随之增加,但总体显著低于接种处理[图1(b)]。接种耐酸根瘤菌后,根周土壤根瘤菌数量比未接种处理提高了10倍多,能够显著改善酸性土壤中根瘤菌数量的不足;接种耐酸根瘤菌同时施加高磷(R-P30),耐酸根瘤菌数量显著高于单接种处理(CK1)和接种-低磷处理(R-P4),可见高磷处理能够有效提高试验根瘤菌在酸性土壤中的存活率和繁殖速度,进而有利于苜蓿结瘤。
2.3 施磷与接种耐酸根瘤菌对酸性土壤中紫花苜蓿结瘤的影响
单株根瘤重量在各处理下变化规律[图2(b)]与根瘤数量相似,均表现为单施磷对根瘤重影响不显著,接种耐酸根瘤菌处理能够显著提高苜蓿根瘤鲜重,较CK0提高了128%;接种耐酸根瘤菌的同时施用磷肥可进一步提高苜蓿根瘤重量,接种和高磷处理下苜蓿根瘤鲜重最大,比CK0提高了4倍。接种耐酸根瘤菌和施磷对于酸性土壤中苜蓿有效结瘤具有显著的促进作用。

图2 紫花苜蓿单株结瘤数量与单株根瘤重Fig.2 The number and the weight of nodules per individual alfalfa
2.4 施磷与接种耐酸根瘤菌对酸性土壤中紫花苜蓿根瘤固氮酶活性的影响
本研究对不同处理下根瘤固氮酶活性进行分析。结果表明,接种耐酸根瘤菌处理下紫花苜蓿根瘤固氮酶活性显著高于自然土壤,固氮酶活性提高了2~3倍。施磷对自然土壤中根瘤固氮酶活性有一定影响,高磷处理下固氮酶活性显著高于低磷和不施磷处理。在接种耐酸根瘤菌的条件下,施磷处理能够进一步提高耐酸根瘤菌结瘤的固氮酶活性,高磷处理下固氮酶活性最高。可见,施磷和接种耐酸根瘤菌能够有效提高酸性土壤中苜蓿根瘤固氮能力。

图3 不同处理下紫花苜蓿根瘤固氮酶活性变化Fig.3 Changes of the nitrogenase activity of the alfalfa nod⁃ules under different treatments
3 讨论
本研究在盆栽条件下模拟酸性土壤中,接种耐酸根瘤菌和施磷对紫花苜蓿生长、结瘤及固氮的影响。本研究中,施磷能够显著提高酸性土壤中紫花苜蓿生物量、株高以及根长(表3)。一方面,磷是植物生长的重要营养元素,施磷能够解除酸性土壤磷营养的限制,进而有利于植物生长;另一方面,磷素能够有效缓解酸性土壤中氯离子与氢离子对紫花苜蓿根系生长的毒害[19],进而可能促进苜蓿生长恢复。豆科植物根系的正常伸长和变形是根瘤菌附着、侵染、结瘤的前提,因此施磷可能在一定程度上缓解酸性条件下苜蓿的结瘤固氮的负面影响。然而,酸性土壤中根瘤菌的生长繁殖也是决定豆科植物结瘤固氮的关键因子,提高酸性土壤中根瘤菌的数量至关重要。本研究中,仅接种耐酸根瘤菌对紫花苜蓿生物量的影响并不显著,这可能因为仅接种根瘤菌虽然提高了土壤中根瘤菌的数量(图1),但在酸性环境下宿主根系生长受到显著影响,根瘤菌与宿主植物的信号交流受阻,并不能有效结瘤[7]。研究表明,施磷能够有效缓解酸性环境对根瘤菌的生长繁殖的影响[22],同时参与根瘤菌与宿主间信号交流过程[13],因此,本研究中,在接种耐酸根瘤菌与施磷的交互处理下,紫花苜蓿地下部与地上部生物量和含氮量均显著高于对照处理,表现出较好的固氮效果。本研究认为施磷与接种耐酸根瘤菌能够有效提高紫花苜蓿-根瘤菌系统在酸性土壤中的适应性。
植物根系是活跃的养分吸收器官和合成器官,根系的生长情况和活力水平直接影响地上部的生长、营养状况及产量水平。为明确施磷与接种耐酸根瘤菌改善酸性土壤中苜蓿生长固氮的机理,本研究对不同处理下苜蓿根系活力进行分析。结果表明,单施磷或单接种耐酸根瘤菌均能够提高植物根系活力,这与徐亮等[23]、郝凤等[24]的研究结果相似;同时施磷和接种耐酸根瘤菌使得根系活力提高2倍多[图1(a)]。根系活力的提高表征根系代谢活动能力升高,其与根周土壤根瘤菌的信号交流可能增强[24],进而有利于根瘤菌与宿主根系的识别、侵染。此外,Fujihara和Yoneyama[25]认为,根瘤菌在进入宿主根系前,对酸性环境极为敏感,因此酸性条件下根周土壤中根瘤菌生存能力和活性是其与宿主结瘤共生的关键。本研究中,接种耐酸根瘤菌能够显著提高苜蓿根周土壤中根瘤菌的数量,为苜蓿结瘤提供了条件。同时,施磷能够缓解H+对根瘤菌繁殖的抑制作用[7-8],而且施用磷素可通过促进苜蓿根系伸长生长,进而刺激根周微生物的活性[22]。分析结果表明,施磷和接种耐酸苜蓿根瘤菌处理能够显著促进紫花苜蓿的结瘤数量[图2 (a)]与单株根瘤重[图2 (b)]。因此,接种耐酸根瘤菌同时施加一定量磷肥,可通过改善酸性胁迫下宿主根系活力和根瘤菌繁殖存活,达到提高二者在酸性环境中共生结瘤的目的。
豆科植物接种根瘤菌能够有效增加根瘤的固氮能力[8]。本研究在酸性土壤中接种耐酸根瘤菌不仅能够促进苜蓿与根瘤菌共生结瘤,而且有效根瘤的固氮酶活性显著高于不接种处理组。同时,王树起等[26]对豆科根瘤菌固氮酶活性与磷浓度关系的研究认为施磷对提高豆科根瘤的固氮酶活性有显著的促进作用,在Tang等[27]对紫花苜蓿的研究中也得到相似结论,这均支持了本研究的结论。本研究认为,施磷能够提高酸性环境中根瘤固氮酶活性,进而增强紫花苜蓿-根瘤菌体系固氮能力。接种耐酸根瘤菌和施磷对酸性土壤中紫花苜蓿的固氮能力具有显著改善作用,可为苜蓿的逆境种植和酸性土壤改良提供科学参考。
4 结论
(1)施磷和接种耐酸根瘤菌能够显著促进紫花苜蓿在酸性土壤中的生长,同时提高苜蓿地上和地下部的氮含量和总固氮量,进而提高了酸性土壤中紫花苜蓿的适应性。
(2)单施磷肥或仅接种耐酸根瘤菌均能够提高酸性条件下紫花苜蓿根系活力和根周根瘤菌数量,且接种耐酸根瘤菌效果优于单施磷肥;耐酸根瘤菌接种配以高磷处理可显著提高宿主根系活力和根周土壤中根瘤菌的繁殖存活,进而有利于酸性条件下紫花苜蓿-根瘤菌的共生结瘤。
(3)施磷-接种耐酸根瘤菌能够有效提高酸性土壤中紫花苜蓿根系结瘤数量和根瘤鲜重,加之提高紫花苜蓿-根瘤菌共生体的固氮酶活性,进而利于酸性土壤结瘤固氮。本研究为紫花苜蓿逆境种植和酸性土壤改良提供支撑。
[1]GUO J H,LIU X J,ZHANG Y,et al.Significant acidifi⁃cation in major chinese croplands[J].Science.2010,327(5968):1008-1010.
[2]杨昂,孙波,赵其国.中国酸雨的分布、成因及其对土壤环境的影响[J].土壤,1999(1):13-18.
[3]张健,黄建国,黄勇富,等.三峡库区紫色石骨子土紫花苜蓿生态适应性研究[J].中国畜牧杂志,2006,42(23):53-56.
[4]TIWARI R P,REEVE W G,GLEENN A R.Mutations conferring acid sensitivity in the acid-tolerant strainsRhi⁃zobium melilotiWSM419 andRhizobium leguminosarumbiovarviciaeWSM710[J].FEMS Microbiology Letters,1992,100(1/2/3):107-112.
[5]SLATTERY J F,PEARCE D J,SLATTERY W J.Effects of resident rhizobial communities and soil type on the ef⁃fective nodulation of pulse legumes[J].Soil Biology and Bio⁃chemistry,2004,36(8):1339-1346.
[6]TABUCHI A,MATSUMOTO H.Changes in cell wall properties of wheat(Triticum aestivum)roots during alu⁃minum-induced growth inhibition[J].Physiologia Plantarum,2001,112(3):353-358.
[7]RICHARDSON A E,DJORDJEVIC M A,ROLFE B G,et al.Effects of pH,Ca and Al on the exudation from clo⁃ver seedlings of compounds that induce the expression of nodulation genes inRhizobium trifolii[J].Plant and Soil,1988,109(1):37-47.
[8]TESFAYE M,DUFAULT N S,DORNBUSCH M R,et al.Influence of enhanced malate dehydrogenase expression by alfalfa on diversity of rhizobacteria and soil nutrient availability[J].Soil Biology and Biochemistry,2003,35(8):1103-1113.
[9]辜建平,张磊,魏世清,等.一株耐酸野生葛藤(Pueraria lobata)根瘤菌的筛选与耐酸机理初步研究[J].微生物学报.2006,46(4):653-656.
[10]ELIZABETH L J,WATKIN,GRAHAM W,et al.Physi⁃ological responses to acid stress of an acid-soil tolerant andanacid-soilsensitivestrainofRhizobiumleguminosarumbiovartrifolii[J].Soil Biology and Biochemistry,2003,35(4):621-624.
[11]CHEN H,RICHARDSON A E,ROLFE B G.Studies of the physiological and genetic basis of acid tolerance inRhizobium leguminosarumbiovartrifolii[J].Applied and Environmental Microbiology,1993,59(6):1798-1804.
[12]SEGUNDO E,MARTINEZ A F,DILLEWIJN P,et al.Characterisation of symbiotically efficient alfalfa-nodulat⁃ing rhizobia isolated from acid soils of Argentina and Uru⁃guay[J].FEMS Microbiology Ecology,1999,28(2):169-176.
[13]DREVON J J,HARTWIG U A.Phosphorus deficiency increased the argon-induced decline of nodule nitrogenase activity in soybean and alfalfa[J].Planta,1997,201(4):463-469.
[14]ALMEIDA J P F,HARTWIG U A,FREHNER M,et al.Evidence that P deficiency induces N feedback regula⁃tion of symbiotic N2fixation in white clover(Trifolium re⁃pensL.)[J].Journal of Experimental Botany,2000,51(348):1289-1297.
[15]苗淑杰,乔云发,韩晓增.磷和根瘤菌交互作用对大豆结瘤和生长的影响[J].大豆科学,2009,28(2):271-274.
[16]朱铁霞,徐安凯,胡自治,等.接种根瘤菌和施磷肥对公农1号紫花苜蓿的影响[J].中国草地学报,2009,31(5):60-63.
[17]李富宽,翟桂玉,沈益新,等.施磷和接种根瘤菌对黄河三角洲紫花苜蓿生长及品质的影响[J].草业学报,2005,14(3):87-93.
[18]韩华君,张磊,谢德体,等.耐酸苜蓿根瘤菌在酸性土壤中的定殖研究[J].西南大学学报(自然科学版),2006,28(5):722-726.
[19]张磊,王晓锋,罗珍,等.钙磷对酸铝土壤中苜蓿根瘤菌迁移定殖和群体感应的影响[J].土壤学报,2014,51(5):1120-1131.
[20]鲍士旦.土壤农化分析(第三版)[M].北京:中国农业出版社,2000.
[21]张国霞,茅庆,何忠义,等.陵水普通野生稻(Oryza rufi⁃pogon)内生菌的固氮及溶磷特性[J].应用与环境生物学报,2006,12(4):457-460.
[22]王晓锋,罗珍,刘晓燕,等.钙磷对酸铝胁迫后紫花苜蓿-根瘤菌体系结瘤固氮的修复效应[J].草业学报,2012,21(6):108-116.
[23]徐亮,王月福,程曦,等.施磷对花生根系生长发育和产量的影响[J].花生学报,2009,38(1):32-35.
[24]郝凤,刘晓静,齐敏兴,等.磷水平和接根瘤菌对紫花苜蓿根系形态特征和根瘤固氮特性的影响[J].草地学报,2015,23(4):818-822.
[25]FUJIHARA S,YONEYAMA T.Effects of pH and osmotic stress on cellular polyamine contents in the soybean rhizo⁃biaRhizobium frediiP220 andBradyrhizobium japonicumA1017[J].Applied&Environmental Microbiology,1993,59(4):1104-1109.
[26]王树起,韩晓增,乔云发,等.缺磷胁迫对大豆根瘤生长和结瘤固氮的影响[J].大豆科学,2009,28(6):1000-1003.
[27]TANG C,HINSINGER P J,DREVON J,et al.Phospho⁃rus deficiency impairs early nodule functioning and enhanc⁃es proton release in roots ofMedicago truncatulaL.[J].An⁃nals of Botany,2001,88(1):131-138.

