不同汲取液在正渗透膜处理垃圾渗滤液过程中的作用
肖 萍,李 静
(1.长江师范学院 三峡库区环境监测与灾害防治工程研究中心,重庆 408100;2.中国科学院 重庆绿色智能技术研究院,重庆 400714)
垃圾渗滤液的处理对于垃圾填埋场的设计、管理及运行至关重要,也一直是水处理领域的难题[1]。研究发现,垃圾渗滤液中含有大量导致其形成高浓度化学需氧量(Chemical Oxygen Demand,COD)、生化耗氧量(Biochemical Oxygen Demand,BOD)、氨氮及色度的有机物、重金属和无机盐,这些物质可导致地面水体缺氧、水质恶化,严重影响地下水和饮用水水源安全,同时污染空气和土壤,进而破坏生态平衡,影响人体健康[1-4]。找到有效且经济的处理工艺势在必行。絮凝沉淀、活性炭吸附和膜工艺作为预处理技术,光催化氧化、电化学技术以及活性污泥、膜生物反应器(Membrane Bio-Reactor,MBR)、反渗透(Reverse Osmosis,RO)等技术作为后端深度处理技术[5-6],这些工艺对于有机物、重金属以及氨氮等污染物有较强的处理效果,但是对于渗滤液中的总溶解固体(Total Dissolved Solids,TDS)作用甚微,甚至会增加其含量,除此之外,这些工艺存在能耗高、占地面积大、运行效果不稳定等缺点[7-10]。正渗透膜技术因具有高截留率、高通量、低能耗和低污染等优点而备受关注[11-16]。发展到现在,正渗透膜技术已经在海水淡化、污水处理、食品及医药行业得到广泛应用[17-23]。但是鲜有在垃圾渗滤液处理过程中应用的报道[24-25]。
汲取液的合理选择是得到高回收率的关键。理想汲取液的特征包括:溶解度高、渗透压高、稀释后的汲取液能进行资源化利用或低能耗再生。碳酸氢铵溶解度高、渗透压高、稀释后的碳酸氢铵溶液可以作为液态肥进行资源化利用,而EDTA钠盐也具有高溶解度和渗透压、稀释后的EDTA钠盐溶液可用纳滤膜进行浓缩再利用[26-28]。此次研究采用碳酸氢铵和EDTA钠盐两种汲取液进行实验,考察不同汲取液浓度、膜朝向对膜通量的影响,再从回收率、膜污染以及生物毒性等方面进行比较,选择性能较好的进行后期中试实验。
1 材料与方法
1.1 材料和试剂
正渗透膜:TFC膜(美国HTI公司),使用之前在纯水中浸泡24 h,之后用纯水作为原料液和汲取液在实验设定流速下运行0.5 h。碳酸氢铵、EDTA-锌钠、盐酸(分析纯,国药集团),Hg,As,Cd,Pb,Cr(标准样品为优级纯,国药集团),纯水:电导率<2 µs/cm2。
以垃圾渗滤液处理过程中的MBR出水(原水)为测试水样,水质情况如表1。
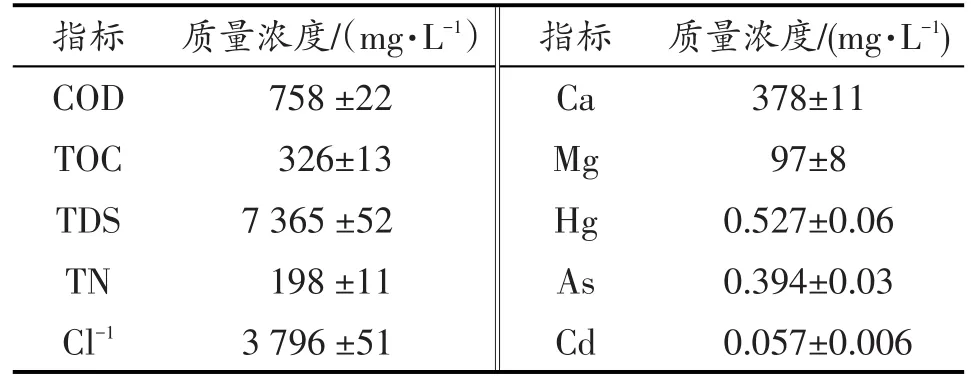
表1 原水水质特性Table 1 Characteristics of the feed solution
1.2 正渗透装置
正渗透小试实验装置如图1所示。装置包括固定膜片位置并提供原料液及汲取液通道的玻璃板,有效膜面积为40 cm2,控制温度的恒温水浴锅(CU-420,上海精密仪器仪表有限公司),控制原料液和汲取液流向及流速的蠕动泵(YZ1515X,Lon⁃gerpump,中国),实时监测并记录汲取液重量变化的电子天平(BSA6202S-CW,Sartorius,德国)。
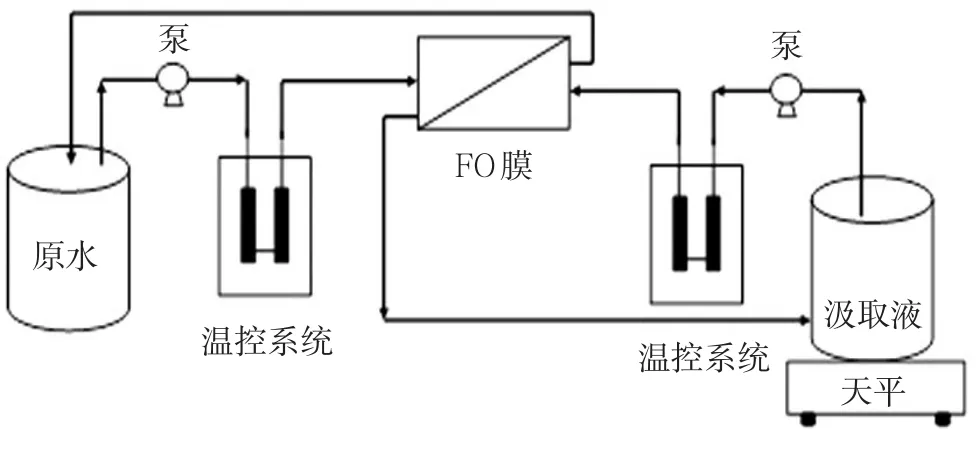
图1 正渗透小试实验装置示意图Fig.1 Schematic diagram of a lab-scale forward osmosis system
1.3 实验方法
1.3.1 原水水质检测方法
TDS采用国家标准《生活饮用水标准检验方法感官性状和物理指标》(GB/T 5750.4-2006)方法检测;采用pH计测定pH值;氯离子和金属离子分别采用离子色谱法和原子吸收光谱法测定;COD含量采用国家标准方法GB 11914-89以及哈希COD测定仪测定;TOC检测采用Multi N/C3100分析仪。
1.3.2 正渗透汲取液浓度及膜朝向实验
在温度为(25±1)℃,错流流速为6.6 cm/s的条件下,分别测试两种膜朝向(PRO,FO)时碳酸氢铵浓度在1.5 mol/L,2.5 mol/L,3.0 mol/L及EDTA-锌钠溶液浓度在0.5 mol/L,0.7 mol/L,0.9 mol/L时的膜通量变化,实验持续4 h。用纯水在错流流速为7.5 cm/s条件下清洗0.5 h,重复试验。膜通量计算方法如下:

式中:JW为膜通量,单位为L/(m2·h);△V表示从原料液进入汲取液中水的体积,单位为L;△t表示运行时间,单位为h;Sm表示膜的有效面积,单位为m2。
1.3.3 回收率
在温度为(25±1)℃,错流流速为6.6 cm/s时,两种膜朝向,碳酸氢铵和EDTA-锌钠溶液初始浓度分别为3.0 mol/L和0.9 mol/L,实验过程中每100 mL水进入汲取液后需往其中添加碳酸氢铵和EDTA钠盐,并溶解搅拌以维持两种汲取液浓度分别为2.75~3.0 mol/L和0.8~0.9 mol/L。得到回收率及截留率,并用扫描电镜表征不同条件下的膜污染情况。
回收率和截留率的计算方法如下:

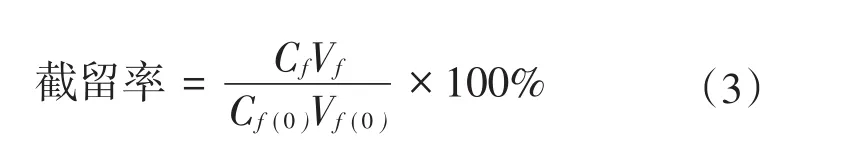
式中:Vf(0)和Vf分别表示处理前后原料液的体积,单位为L;Cf(0)和Cf表示处理前后原料液中污染物的浓度,单位为mol/L。
1.3.4 毒性测试
将成熟的斑马鱼按照标准方法饲养在实验室自动循环水养殖系统中,水恒温28.5℃,14 h/10 h光暗周期。实验前一晚将斑马鱼按照2∶1(雄性:雌性)置于生育箱中过夜,次日收集并选拔发育正常、大小相近的胚胎进行实验。在每个细胞培养板中放置100枚胚胎,分别暴露于体积10 mL的纯水、垃圾渗滤液MBR出水(原水)、碳酸氢铵汲取得到的水(产水1)和EDTA-锌钠汲取得到的水(产水2)中培养三天,产水1是汲取实验后的碳酸氢铵稀释液在80℃条件下加热分解2 h得到的,而产水2是汲取实验后的EDTA-锌钠稀释液用纳滤膜(TS80)在4 MPa的压力下过滤得到。期间用尼康显微镜SMZ 18记录胚胎发育情况并计算存活率。
2 结果与分析
2.1 不同汲取液浓度对正渗透过程的影响
根据正渗透膜的工作机理,膜通量与渗透压差成正比,与膜污染及浓差极化等造成的阻力成反比。膜通量可以表示为:
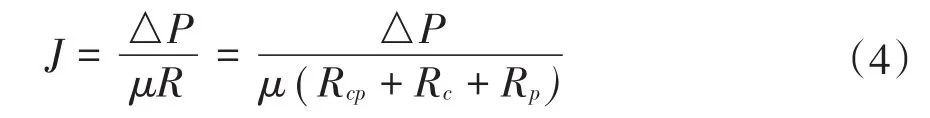
式中:J为膜通量,单位为L/(m2·h);∆P为汲取液和原料液之间的渗透压差,单位为Pa;μ为粘度,单位为Pa·s;R为总阻力,单位为m-1;Rcp为浓差极化造成的阻力,单位为m-1;Rc为滤饼层造成的阻力,m-1;Rp为膜孔堵塞造成的阻力,单位为m-1。
不同汲取液浓度对正渗透过程的影响如图2所示。两种汲取液在不同膜朝向时的通量均随着汲取液浓度增加而增加,当碳酸氢铵浓度为1.5 mol/L,2.5 mol/L,3.0 mol/L时,在FO和PRO模式下运行4 h的平均膜通量分别为2.96 L/(m2·h),5.45 L/(m2·h),6.72 L/(m2·h)和4.75 L/(m2·h),8.10 L/(m2·h),10.02 L/(m2·h),当EDTA-锌钠浓度为0.5 mol/L,0.7mol/L,0.9 mol/L时,在FO和PRO模式下运行4 h的平均膜通量分别为1.72 L/(m2·h),4.01 L/(m2·h),4.47 L/(m2·h)和3.75 L/(m2·h),5.82 L/(m2·h),7.70 L/(m2·h)。这是因为汲取液浓度增加,渗透压差增加,∆P增加,即膜通量增加。
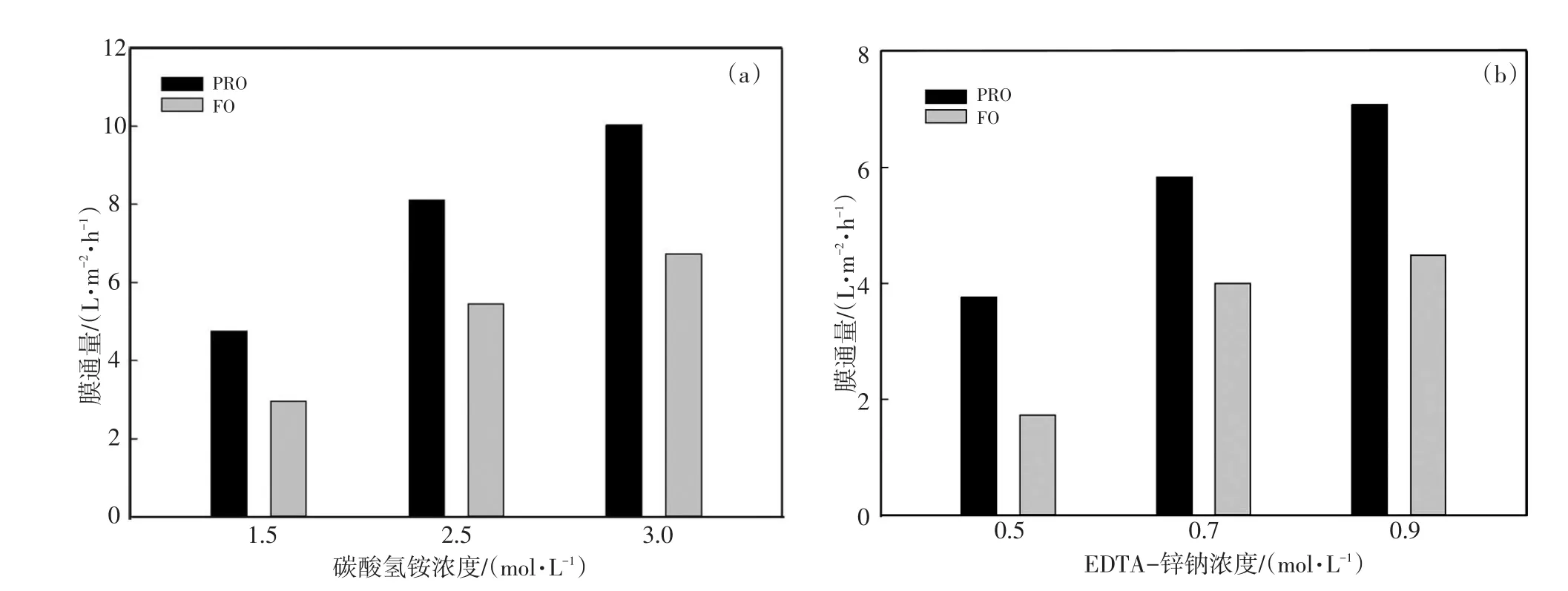
图2 不同汲取液浓度下的膜通量Fig.2 Water flux at different draw solution concentrations
2.2 膜朝向对正渗透过程的影响
在不同膜朝向的膜通量变化及膜清洗之后的膜通量恢复情况如图3所示。结果显示,随着实验的持续进行,膜通量持续降低。这是因为随着实验进行,原料液中的水不断进入汲取液将其稀释,渗透压降低,膜通量降低;另一方面,随着实验进行,膜污染逐渐严重,阻力增加,膜通量降低。
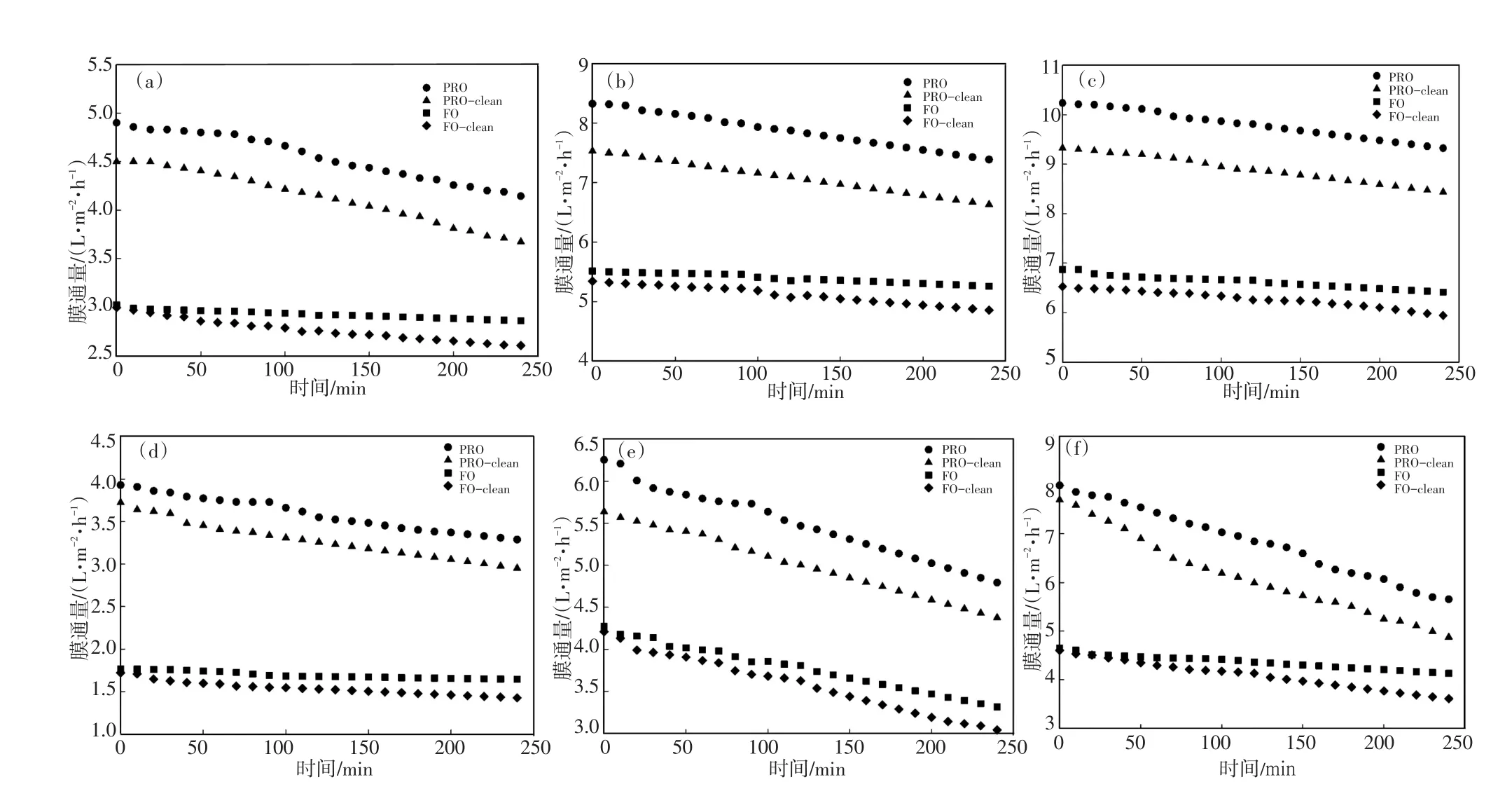
图3 不同膜朝向时的膜通量及膜清洗后通量变化情况Fig.3 Water flux at different membrane orientation and after membrane clean
同时可以看出PRO模式下的膜通量较FO模式高。在碳酸氢铵汲取液浓度为1.5 mol/L,2.5 mol/L,3 mol/L时,PRO模式下实验运行4 h膜通量变化分别为由4.90 L/(m2·h)降到4.14 L/(m2·h),由8.32 L/(m2·h)降到7.38 L/(m2·h),由10.23 L/(m2·h)降到9.32 L/m2h,而在FO模式时膜通量变化分别为由3.02L/(m2·h)降到2.86L/(m2·h),由5.51L/(m2·h)降到5.25 L/(m2·h),由6.86 L/(m2·h)降到6.41 L/(m2·h);在EDTA-锌钠汲取液浓度为0.5 mol/L,0.7 mol/L,0.9 mol/L时,PRO模式下实验运行4 h膜通量变化分别为由3.92 L/(m2·h)降到3.28 L/(m2·h),由6.25 L/(m2·h)降到4.79 L/(m2·h),由7.99 L/(m2·h)降到5.65 L/(m2·h),而在FO模式时膜通量变化分别为由1.76 L/(m2·h)降到1.64 L/(m2·h),由4.27 L/(m2·h)降到3.31 L/(m2·h),由4.64 L/(m2·h)降到4.13 L/(m2·h)。这个结果是浓差极化造成的,在PRO模式下,多孔支撑层对着原料液,活性层对着汲取液,随着实验进行,原料液中水分子渗透到汲取液中,支撑层一侧形成浓缩内浓差极化,而活性层表面形成稀释外浓差极化;反之,在FO模式下,支撑层一侧形成稀释内浓差极化,而活性层表面形成浓缩外浓差极化,而稀释内浓差极化使得支撑层侧的汲取液浓度大幅度降低,渗透压、低膜通量小。
从图3中还可以看出,PRO模式下的膜通量下降速率高于FO模式。这是因为在PRO模式下,污染物会累积在支撑层表面和孔隙中,并在渗透压力的影响下变得更加紧实,从而形成厚的污染饼层及膜孔堵塞;而在FO模式下,污染物质只累积在活性层表面。PRO模式下的膜污染更严重且更难清洗,所以膜通量降低速率更快;而且在用纯水清洗0.5 h之后PRO模式下的膜通量恢复率低于FO模式。
2.3 回收率
为了将碳酸氢铵汲取液和EDTA-锌钠浓度分别维持在2.75~3.0 mol/L和0.8~0.9 mol/L范围内,每汲取得到100 mL水,分别往各自汲取液里加入23.0 g碳酸氢铵和41.4 g EDTA-锌钠并搅拌溶解。碳酸氢铵和EDTA-锌钠两种汲取液在PRO和FO模式下长时间运行情况如图4所示。PRO模式的持续运行时间分别为50.66 h和39.16 h,FO模式下的持续运行时间分别为73.50 h和58.83 h。PRO模式的运行时间较短,这归咎于PRO模式下的内浓差极化和严重的膜污染,同时这也导致了两种汲取液PRO模式下的低回收率。碳酸氢铵和EDTA-锌钠两种汲取液在PRO和FO模式下的回收率分别为86.6%,91.6%和66.5%,71.2%,碳酸氢铵作为汲取液在FO模式下得到的回收率更高。
从图4中还可以看出,随着实验的进行,加入碳酸氢铵和EDTA-锌钠之后的通量恢复率逐渐降低。其一是因为原水浓度越来越高,汲取液和原水之间的渗透压差变小;其二是随着汲取实验的进行,浓差极化和膜污染越来越严重,汲取阻力变大。由图4所知,实验得到的最大回收率为碳酸氢铵在FO模式下的91.6%,为了进一步提高回收率,可在此后加入膜清洗进行深度研究。
图5是碳酸氢铵作为汲取液在不同膜朝向下支撑层的污染情况。从图中明显看出,PRO模式下的污染情况较FO模式严重很多,佐证了PRO模式下膜通量下降速度快、持续运行时间短、回收率低。

图4 长时间运行时膜通量变化Fig.4 Water flux changes during the long-term filtration

图5 扫描电镜图Fig.5 Scanning electron microscope images
2.4 截留率
从表2中可以看出,两种汲取液在PRO和FO模式下对污染物的截留率差别不大,且都在98%以上。正渗透膜对污染物的截留效率高,此方面区分不出两种汲取液的优劣,需在其他方面进行对比。

表2 截留率Table 2 Retention
2.5 毒性测试
斑马鱼胚胎在纯水、产水1、产水2和原水中暴露1 d和3 d的形态如图6所示。经过两种汲取液处理后得到的水对斑马鱼胚胎的影响程度相近,但是斑马鱼胚胎在原水中受到极大损害,暴露短时间后全部死亡。斑马鱼胚胎在纯水、产水1、产水2和原水中暴露3 d之后的存活率分别为80%,76%,68%和0,即碳酸氢铵作为汲取液的产水生物毒性更低。
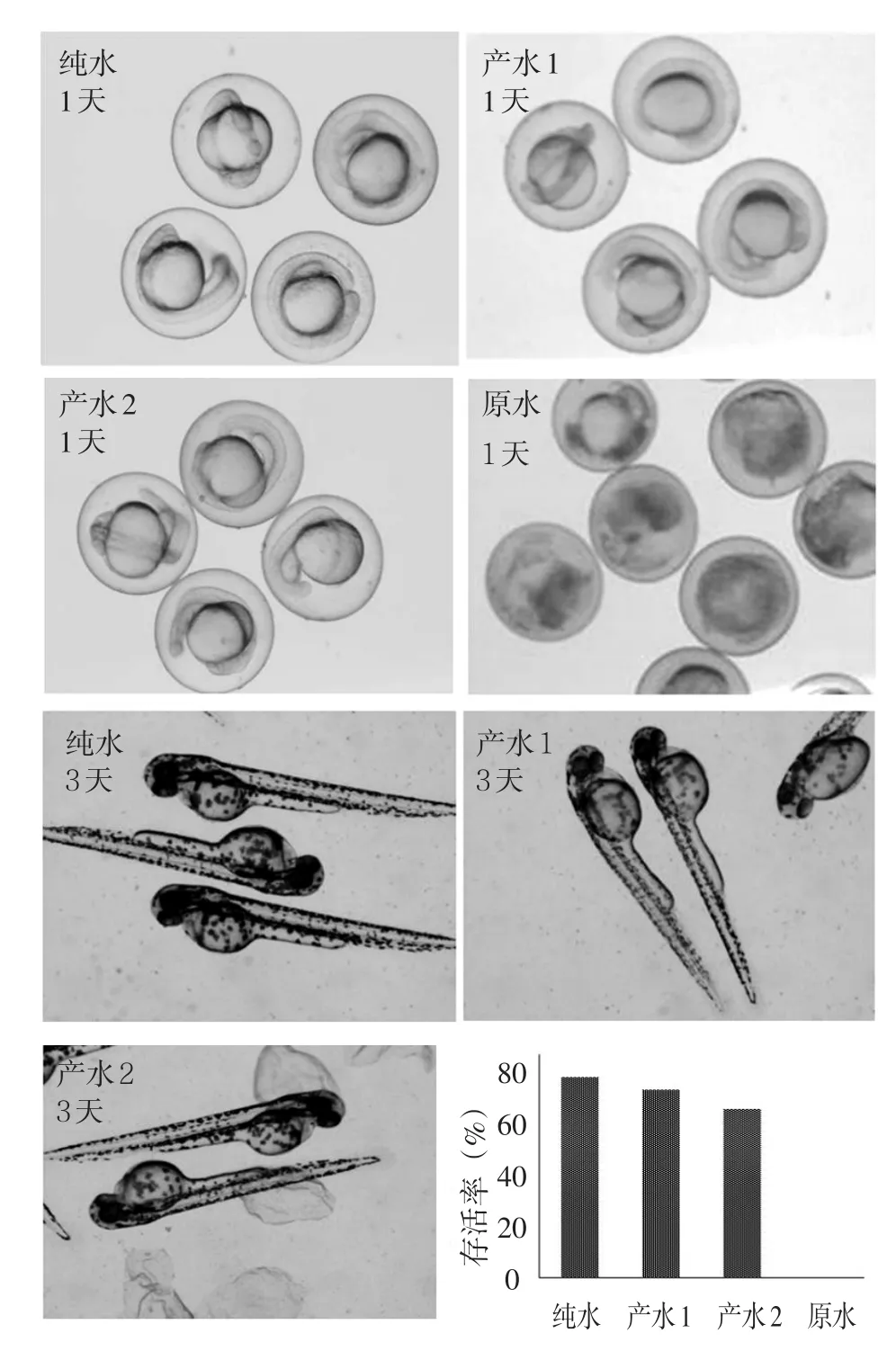
图6 胚胎发育情况Fig.6 Developmental toxicity of embryos
3 结论
(1)正渗透过程中,膜通量随着汲取液浓度增加而变大;PRO模式的膜通量高于FO模式;但在膜污染和浓差极化影响下,PRO模式的通量降低速率高于FO模式,膜清洗之后的通量恢复率低于FO模式。
(2)与EDTA-锌钠相比,碳酸氢铵作为汲取液得到的回收率较高,在FO模式下能达到91.6%。EDTA-锌钠和碳酸氢铵两种汲取液对污染物的截留效果相差无几,都在98%以上。
(3)与EDTA-锌钠相比,斑马鱼胚胎在经过碳酸氢铵汲取液处理得到的水中存活率较高,生物毒性更低。
(4)EDTA-锌钠和碳酸氢铵两种汲取液相比较,碳酸氢铵作为汲取液得到的回收率更高、产水生物毒性更低,其性能更好,选择作为汲取液进行下一步的中试试验。
[1]RICORDEL C,DJELAL H.Treatment of landfill leachate with high proportion of refractory materials by electrocoagu⁃lation:System performances and sludge settling characteris⁃tics[J].Journal of Environmental Chemical Engineering,2014,2(3):1551-1557.
[2]BARDI A,YUAN Q,SIRACUSA G,et al.Effect of cellu⁃lose as co-substrate on old landfill leachate treatment us⁃ing white-rot fungi[J].Bioresource Technology,2017,241:1067-1076.
[3]FERNANDES A,SANTOS D,PACHECO M J,et al.Nitro⁃gen and organic load removal from sanitary landfill leach⁃ates by anodic oxidation at Ti/Pt/PbO2,Ti/Pt/SnO2–Sb2O4and Si/BDDA[J].Applied Catalysis B:Environmental,2014,148/149:288-294.
[4]CORTÉES-LORENZO C,SIPKEMA D,RODRÍGUEZDÍAZ M,et al.Microbial community dynamics in a sub⁃merged fixed bed bioreactor during biological treatment of saline urban wastewater[J].Ecological Engineering,2014,71:126-132.
[5]ALKHAFAJI R A,JIAN G B,ZAIDUN N A.Biological nutrient removal by internal circulation upflow sludge blan⁃ket reactor after landfill leachate pretreatment[J].Journal of Environmental Sciences,2013,25:2130-2137.
[6]SINGH S K,MOODY C M,TOWNSEND T G.Ozonation pretreatment for stabilized landfill leachate high-pressure membrane treatment[J].Desalination,2014,344:163-170.
[7]SINGH S K,TOWNSEND T G,BOYER T H.Evaluation of coagulation(FeCl3)and anion exchange(MIEX)for stabi⁃lized landfill leachate treatment and high-pressure mem⁃brane pretreatment[J].Separaionand Purification Technolo⁃gy,2012,96:98-106.
[8]WANG X J,JIA M S,ZHANG C L.Leachate treatment in landfills is a significant N2Osource[J].Science of The Total Environment,2017,596/597:18-25.
[9]INCE M,SENTURK E,ONKAL E G,et al.Further treat⁃ment of landfill leachate by nanofiltration and microfiltration–PAC hybrid process[J].Desalination,2010,255(1/3):52-60.
[10]WANG G H,FAN Z,WU D X,et al.Anoxic/aerobic granu⁃lar active carbon assisted MBR integrated with nanofiltra⁃tion and reverse osmosis for advanced treatment of munic⁃ipal landfill leachate[J].Desalination,2014,349:136-144.
[11]CATH T Y,CHILDRESS A E,ELIMELECH M.Forward osmosis:principles,applications,and recent developments[J].Journal of Membrance Science,2006,281(1/2):70-87.
[12]MI B X,ELIMELECH M.Organic fouling of forward osmosis membranes:foulingreversibilityandcleaningwithout chemical reagents[J].Journal of Membrance Science,2010,348(1/2):337-345.
[13]WERNER C M,LOGAN B E,SAIKALY P E,et al.Wastewater treatment,energy recovery and desalination using a forward osmosis membrane in an air-cathode mi⁃crobial osmotic fuel cell[J].Journal of Membrance Science,2013,428:116-122.
[14]CATH T Y,HANCOCK N T,LUNDIN C D,et al.A multi-barrier osmotic dilution process for simultaneous desalination and purification of impaired water[J].Journal of Membrance Science,2010,362(1/2):417-426.
[15]ZHAO S F,ZOU L D,TANG C Y,et al.Recent develop⁃ments in forward osmosis:opportunities and challenges[J].Journal of Membrance Science,2012,396:1-21.
[16]LINARESAB R V,LI Z Y,ABU-GHDAIB,et al.Water harvesting from municipal wastewater via osmotic gradi⁃ent:An evaluation of process performance[J].Journal of Membrance Science,2013,447:50-56.
[17]MCCUTCHEON J R,MCGINNIS R L,ELIMELECH M.Desalination by ammonia-carbon dioxide forward osmo⁃sis:Influence of draw and feed solution concentrations on process performance[J].Journal of Membrance Science,2006,278(1/2):114-123.
[18]CORNELISSEN E R,HARMSEN D,KORTE K F,et al.Wessels.Membrane fouling and process performance of forward osmosis membranes on activated sludge[J].Journal of Membrance Science,2008,319:158-168.
[19]WANG L,CHU H Q,DONG B Z.Effects on the purifica⁃tion of tannic acid and natural dissolved organic matter by forward osmosis membrane[J].Journal of Membrance Science,2014,455:31-43.
[20]ZHANG X W,NING Z Y,WANG D K,et al.Processing municipal wastewaters by forward osmosis using CTA membrane[J].Journal of Membrance Science,2014,468:269-275.
[21]KONG F X,YANG H W,WANG X M,et al.Rejection of nine haloacetic acids and coupled reverse draw solute per⁃meation in forward osmosis[J].Desalination,2014,341:1-9.
[22]徐龙生,刘启明,张凯松.正渗透浓缩茶料液中茶多酚研究[J].膜科学与技术,2015,35(3):92-97.
[23]肖维溢,朵雪琴,王铎.三醋酸纤维素正渗透膜用于大豆低聚糖浓缩的研究[J].膜科学与技术,2014,34(6):84-88.
[24]CHO Y H,HAN J,HAN S,et al.Polyamide thin-film composite membranes based on carboxylated polysulfone microporous support membranes for forward osmosis[J].Journal of Membrance Science,2013,445:220-227.
[25]DONG Y,WANG Z W,ZHU C W,et al.A forward osmo⁃sis membrane system for the post-treatment of MBR-treated landfill leachate[J].Journal of Membrance Science,2014,471:192-200.
[26]PHUNTSHO S,SHON H K,HONG S,et al.A novel low energy fertilizer driven forward osmosis desalination for di⁃rect fertigation:Evaluating the performance of fertilizer draw solutions[J].Journal of Membrane Science,2011,375(1/2):172-181.
[27]ZHAO Y Z,REN Y W,WANG X Z,et al.An initial study of EDTA complex based draw solutes in forward os⁃mosis process[J].Desalination,2016,378:28-36.
[28]ZHAO P,GAO B Y,XU S P,et al.Polyelectrolyte-pro⁃moted forward osmosis process for dye wastewater treat⁃ment exploring the feasibility of using polyacrylamide as draw solute[J].Chemical Engineering Jounal,2015,264:32-38.

